Что нужно для синтеза белка: Ученые показали, как эволюционно древний механизм биосинтеза белка помогает клетке противостоять стрессу
Ученые показали, как эволюционно древний механизм биосинтеза белка помогает клетке противостоять стрессу
Биологи МГУ имени М.В.Ломоносова совместно с коллегами из Института молекулярной биологии имени В.А. Энгельгардта (ИМБ РАН) и Института белка РАН, применив метод трансфекции РНК, выяснили, как одна и та же мРНК может направлять синтез белка в клетке четырьмя различными способами. Результаты работы опубликованы в авторитетном журнале Scientific Reports.
Ученые Научно-исследовательского института физико-химической биологии имени А.Н. Белозерского (НИИ ФХБ) МГУ с коллегами применили метод трансфекции для того, чтобы доставить в клетку РНК, что позволило им изучить влияние клеточного стресса на биосинтез белка на коротких временных интервалах.
Клеточный стресс и переформатирование белкового синтеза
«Наша работа посвящена изучению механизмов биосинтеза белка, в том числе в условиях клеточного стресса. В ней освещается три аспекта.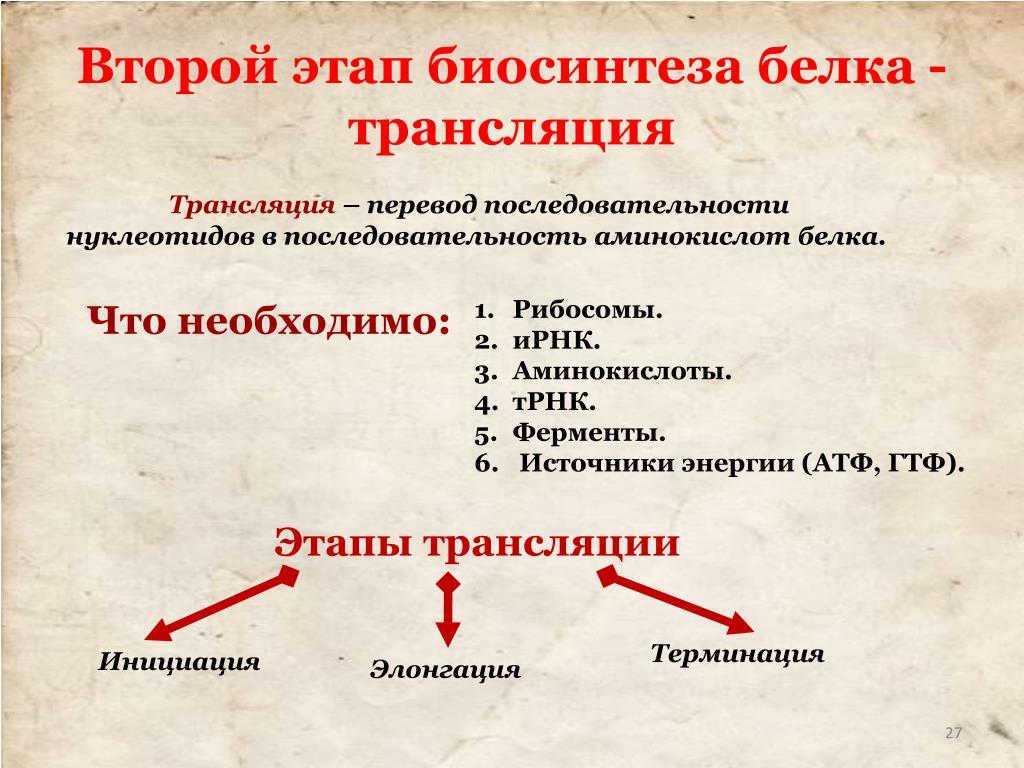
Трансфекция — способ, позволяющий доставлять ДНК и РНК в живую клетку. Обычно в клетку доставляют ДНК: она проникает в ядро, запускает там процессы синтеза новых РНК, и только потом эти РНК попадают в цитоплазму и могут принять участие в получении белков. Биологи МГУ предлагают доставлять в клетку уже готовую РНК, которая сразу может служить матрицей для синтеза белка. РНК доставляется в клетку с помощью специального химического реагента. При попадании в цитоплазму она освобождается и сразу начинает участвовать в производстве белков: ей остается только встретиться с рибосомой. Таким образом, путь до конечного продукта получается сильно короче. Уже через час-два можно наблюдать активность белка и оценивать его количество.
Этот метод позволяет изучать стрессовые воздействия на клетку на коротких временных интервалах. К клеточным стрессам относятся, например, тепловой шок, вызванный повышением температуры, окислительный стресс, спровоцированный активными формами кислорода, реакция на химические агенты, нарушающие гомеостаз, в том числе на антибиотики и терапевтические препараты. Факторы клеточного стресса вынуждают клетку приостановить биосинтез белка (либо «переформатировать» его), пока система не придёт в равновесие.
«Эти процессы обычно занимают от 1 до 4 часов, и их действие удобнее всего изучать с помощью нашего метода «быстрой» РНК-трансфекции. Мы проводили работу на культивируемых клетках почки человека — стандартном модельном объекте для подобных исследований. В результате нами была разработана методика, которая позволяет получать искусственную РНК, трансфицировать её в клетку и видеть результат через очень короткое время. Вся эта процедура была обозначена нами аббревиатурой FLERT (от англ.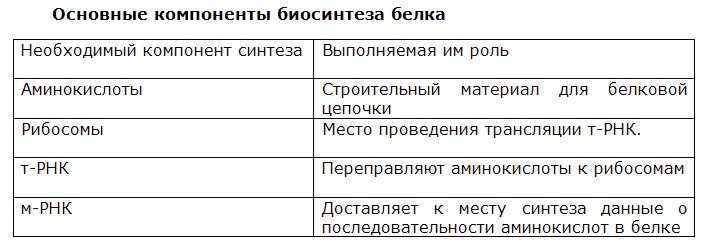
Почему у рибосомы сумма 40S и 60S равна 80S
Матричная РНК (мРНК) — полимер из нуклеотидов, кодирующий белок. Одну аминокислоту кодируют 3 нуклеотида. Для производства белка в клетке существует специальная молекулярная машина под названием рибосома, которая, двигаясь вдоль мРНК, считывает с неё информацию тройками. Именно так, используя мРНК как матрицу, рибосома и синтезирует белок.
Машина для синтеза белка устроена очень сложно. Она состоит из двух субчастиц — малой (40S) и большой (60S). Когда они соединяются, получается целая рибосома, но она, как ни странно, обозначается не 100S, а 80S. Дело в том, что эти числа отражают не массу частицы, а коэффициент седиментации, определяемый при центрифугировании. Этот коэффициент зависит от нескольких параметров, в том числе от формы частицы.
Для того чтобы приступить к раскодированию информации, нужно сначала найти правильную точку старта — триплет, с которого предстоит начать считывание. Обнаружить точку старта — это нетривиальная задача, поскольку триплеты в мРНК никак не обозначены. Но если начать читать не с того нуклеотида, то рамка считывания окажется сбита, и всё пойдёт вкривь и вкось. Найти в матрице то место, с которого следует начать читать триплеты, рибосоме помогают специальные белки (факторы инициации трансляции).
Обнаружить точку старта — это нетривиальная задача, поскольку триплеты в мРНК никак не обозначены. Но если начать читать не с того нуклеотида, то рамка считывания окажется сбита, и всё пойдёт вкривь и вкось. Найти в матрице то место, с которого следует начать читать триплеты, рибосоме помогают специальные белки (факторы инициации трансляции).
Обычно в цепочке мРНК точка старта отстоит от её начала на какое-то расстояние. Часть мРНК, предшествующая стартовому кодону, именуется лидером. Этот лидер рибосома должна «проехать», не читая. Российские ученые заинтересовались вопросом, что будет, если мРНК сразу начнется со стартового кодона, с «первого слова». Интересно, что у архей (одноклеточные организмы-прокариоты, живущие на Земле миллиарды лет и способные выживать в экстремальных условиях) и у некоторых других примитивных организмов большинство мРНК начинаются прямо со стартового кодона. Такие РНК называются безлидерными. Принято считать, что безлидерные мРНК — эволюционный прообраз матричных РНК, ведь древние рибосомы ещё не умели находить стартовые точки и начинали декодирование с самого начала.
Для того чтобы рибосома связалась с мРНК и начала синтез белка, ей нужно пройти несколько стадий. Как правило, сначала с мРНК связывается 40S-субчастица рибосомы, а уже потом на стартовом кодоне к ней присоединяется большая 60S-субчастица. А вот безлидерная мРНК может связываться сразу с целой рибосомой. Это открытие сделал ещё в 90-е годы профессор МГУ имени М.В.Ломоносова Иван Шатский.
В новой работе ученые показали, что благодаря своим уникальным свойствам безлидерные РНК устойчивы ко многим видам стресса и продолжают направлять синтез белков даже в условиях, при которых обычные РНК с лидером прекращают работать в первые же минуты после воздействия. С помощью метода FLERT это удалось показать в системе in vivo.
Все дороги хороши — выбирай на свой вкус
Продолжение работы принесло ещё более интересные результаты. Оказалось, что уникальные свойства безлидерной мРНК придают ей большую пластичность в выборе механизмов синтеза белка.
Ранее у эукариот было найдено несколько способов, с помощью которых рибосома может оказаться на стартовом кодоне. Эти способы опосредуются разным набором белков — факторов инициации трансляции — и были открыты на разных мРНК.
Самый распространенный способ, которым может воспользоваться любая клеточная мРНК, обеспечивается белком eIF2. Однако этот фактор быстро становится неактивным при любом стрессовом воздействии. В результате рибосомы перестают распознавать стартовые кодоны на всех мРНК, кроме тех, которые пользуются другими факторами инициации.
Позднее ученые обнаружили, что eIF2 — не единственный фактор, который подходит для этих целей. Например, мРНК вируса гепатита С способна обойтись без eIF2, а вместо него использовать другие факторы — eIF5B или eIF2D (это открытие также было сделано учеными МГУ имени М.В.Ломоносова ранее). Считалось, что вирус в этом плане уникален: если обычные матрицы пассивно ждут, пока с ними свяжется рибосома, то мРНК вируса гепатита С сама «хватает» 40S-субчастицу и «сажает» ее на нужное место в цепочке.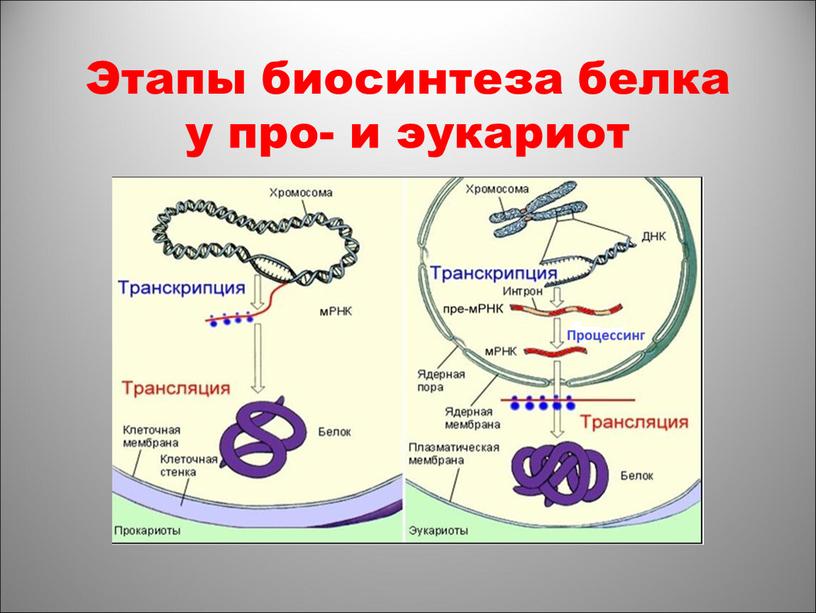 Это необычное свойство и делает возможным использование альтернативных путей. Теперь же ученые показали, что безлидерная мРНК способна делать то же самое.
Это необычное свойство и делает возможным использование альтернативных путей. Теперь же ученые показали, что безлидерная мРНК способна делать то же самое.
Интересно, что фактор eIF5B есть у всех организмов — это эволюционно консервативный белок. А классический eIF2 присутствует только у эукариот, у высших организмов, т.е. он универсальным не является. Совокупность упомянутых работ позволяет сказать, что хорошо изученный классический фактор eIF2 нужен только тогда, когда рибосомы узнают мРНК посредством поиска стартового кодона. Такой способ инициации трансляции называется сканированием, именно для него и нужен eIF2. Когда стартовый кодон найден, на место eIF2 приходит eIF5B и начинается биосинтез белка. Эволюционно более древняя безлидерная мРНК может использовать примитивный механизм, сразу привлекая фактор eIF5B.
«У нас получился красивый результат, который сразу всё объяснил. Мы обнаружили, что примитивная РНК может использовать эволюционно древний механизм.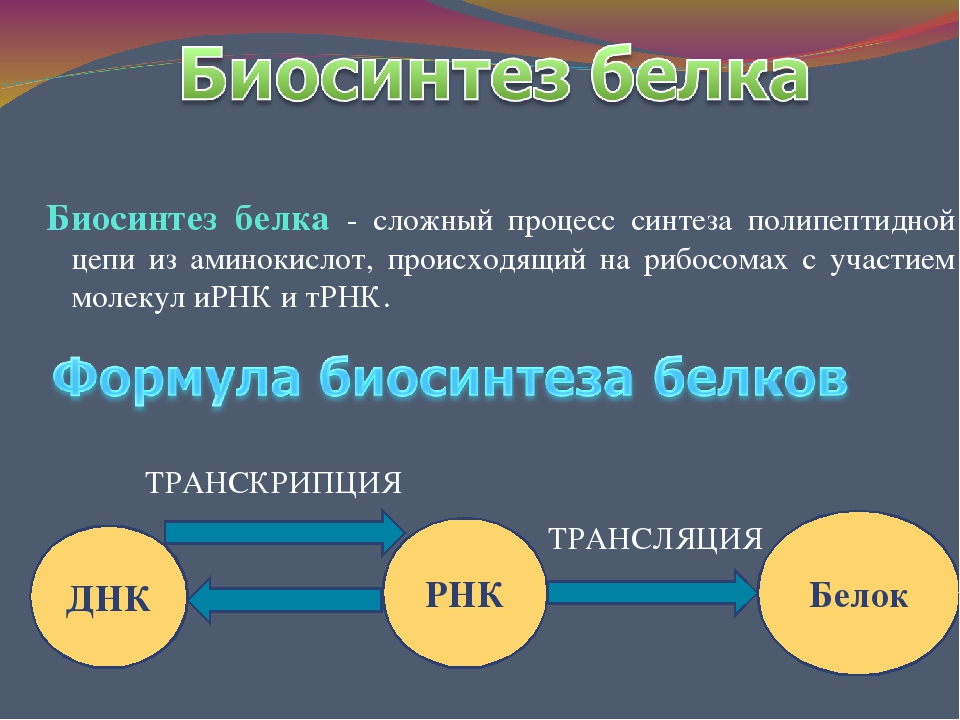 А кроме того, она умеет пользоваться и тремя остальными путями: через eIF2, eIF2D или прямое связывание целой 80S рибосомы», — заключает Сергей Дмитриев.
А кроме того, она умеет пользоваться и тремя остальными путями: через eIF2, eIF2D или прямое связывание целой 80S рибосомы», — заключает Сергей Дмитриев.
С чего начинается синтез белка
Исследователи из МГУ уточнили картину молекулярных сигналов на начальных этапах белкового синтеза.
Мы, как известно, примерно на 65% состоим из воды, но следом за водой идут белки, составляющие 20% массы тела. Информация о белках зашифрована в ДНК, в виде последовательности четырёх химических «букв» (азотистых оснований аденина, тимина, гуанина и цитозина), и для того, чтобы информация превратилась в реальную белковую молекулу, должна быть проделана довольно сложная молекулярная работа.
Молекулярная схема рибосомы: рибосомная РНК (синие нити), почти скрыта под молекулами рибосомных белков. (Иллюстрация Evolution Tale / Flickr.com.)
Рибосома движется по матричной РНК в поисках точки, с которой ей предстоит начать синтез белка.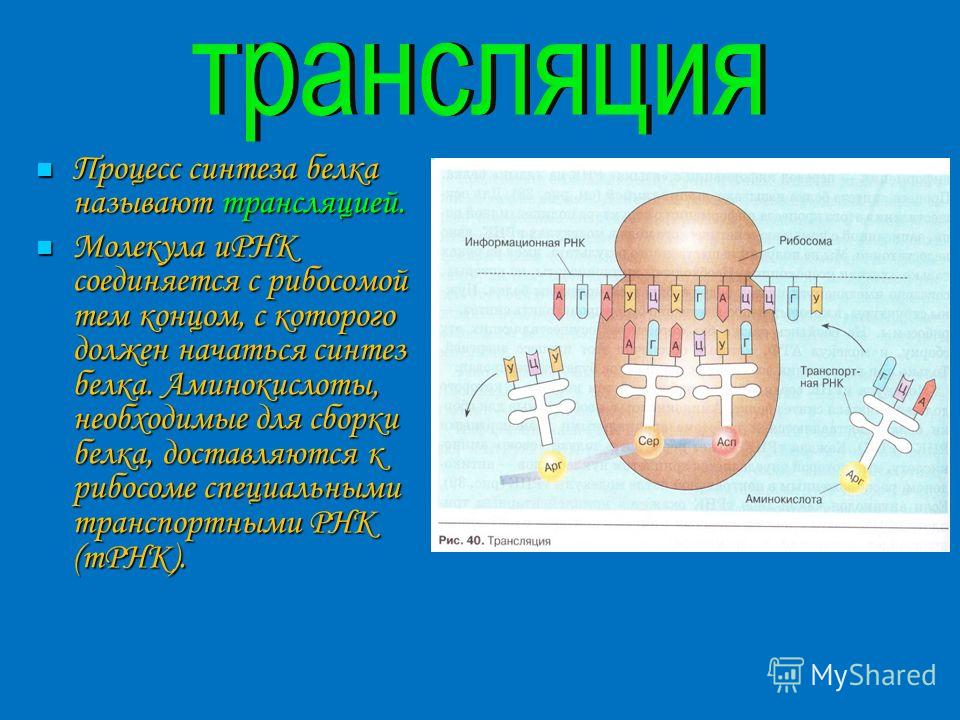 (Иллюстрация Сергей Дмитриев / НИИ физико-химической биологии имени А.Н. Белозерского, МГУ)
(Иллюстрация Сергей Дмитриев / НИИ физико-химической биологии имени А.Н. Белозерского, МГУ)
Рибосомы, синтезирующие белковые молекулы на ленте матричной РНК. (Фото Dr. Donald Fawcett & Kiseleva / Visuals Unlimited / Corbis.)
Схематическое изображение большой и малой рибосомных субчастиц. (Фото Cecilia Stevens / Flickr.com.)
‹
›
Если клетке нужен какой-то белок, она сначала делает копию с того участка в ДНК, в которой требуемый белок записан – на ДНК синтезируется молекула матричной, или информационной, РНК с необходимым куском генетического «текста». Говоря на языке молекулярной биологии, происходит транскрипция, и суть её, грубо говоря, в том, чтобы с ДНК сделать РНК-ксерокс.
А вот потом наступает черёд собственно синтеза белка, или трансляции: к ленте РНК прикрепляется большой и сложный агрегат под названием рибосома. Так называют надмолекулярный комплекс, образованный несколькими молекулами специальных РНК и целой кучей связанных с этими РНК белков. Работу рибосом можно сравнить с машиной, которая в соответствии с генетической инструкцией собирает из мономеров-аминокислот полимерную белковую молекулу. Но, как и во всяком деле, тут нужно знать, с чего начать и чем закончить.
Работу рибосом можно сравнить с машиной, которая в соответствии с генетической инструкцией собирает из мономеров-аминокислот полимерную белковую молекулу. Но, как и во всяком деле, тут нужно знать, с чего начать и чем закончить.
Логично было бы предположить, что, раз у ленты информационной РНК есть начало и конец, то прямо с начального её конца и нужно включать белковый синтез. Но в силу разных причин те информационные РНК, которые синтезируются в эукариотических клетках (а люди, животные, растения относятся к эукариотам), имеют в своём начале небольшой запуск, последовательность, в которой никакой белковой информации нет. То есть представьте, например, что вы держите в руках лист бумаги с плотным текстом, набранным без пробелов и знаков препинания, и, чтобы что-то из него понять, его следует читать со слова «старт». Но «старт» стоит не в самом начале, а чуть позже, и его нужно ещё увидеть. Вот именно такую задачу и решает рибосома перед тем, как начать синтез белка.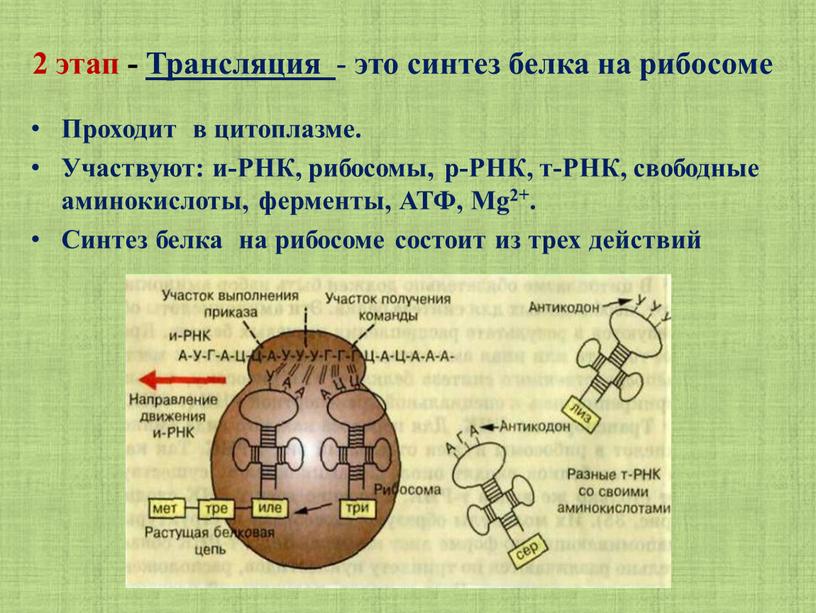
Как всё происходит? Здесь необходимы новые молекулярные детали: рибосома на самом деле состоит из двух модулей-субчастиц, большой и малой, которые перед тем, как сесть на ленту РНК, разделяются. Первой на РНК приземляется малая субчастица, и она же потом начинает искать точку старта. В этом ей помогает целая компания специальных белков, называемых факторами инициации трансляции, или, иными словами, белковыми молекулами, обслуживающими начало синтеза белка. Их довольно много, и для большей наглядности их можно сравнить с аппаратами-лоцманами, которые в каком-нибудь фантастическом фильме подводят огромный, идущий на посадку космический корабль к правильной посадочной площадке – с той разницей, что теперь этот корабль ещё куда-то поедет по земле, и лоцманам придётся вести его и дальше.
Сев на РНК, малая субчастица рибосомы начинает сканировать её в поисках специальной последовательности генетических букв, обозначающих «старт» (и заодно, кстати, кодирующих первую аминокислоту будущей белковой молекулы). Однако таких «стартов» на пути едущей по РНК малой рибосомной субчастицы может быть не один и не два, а вот правильный среди них – только один. Считается, что правильный «старт» – он более «привлекательный», наткнувшись на него, сканирующая молекулярная машинерия слегка задерживается.
Однако таких «стартов» на пути едущей по РНК малой рибосомной субчастицы может быть не один и не два, а вот правильный среди них – только один. Считается, что правильный «старт» – он более «привлекательный», наткнувшись на него, сканирующая молекулярная машинерия слегка задерживается.
И вот нужное стартовое слово узнано, и что происходит дальше? Один из белков-лоцманов (то бишь факторов инициации) держит при себе молекулу ГТФ (гуанозинтрифосфат), которая очень часто используется в самых разных молекулярных реакциях в качестве сигнала. Когда приходит время, от ГТФ отсоединяется один остаток фосфорной кислоты. Распад ГТФ заставляет блоки белковых молекул сдвигаться друг относительно друга – молекулярная машина перестраивается и становится готовой к выполнению следующих задач. В целом, в известной степени огрубляя, ГТФ можно сравнить с сигнальной ракетой.
Вернёмся к рибосоме (точнее, к её малой субчастице), которая узнала на матричной РНК точку старта.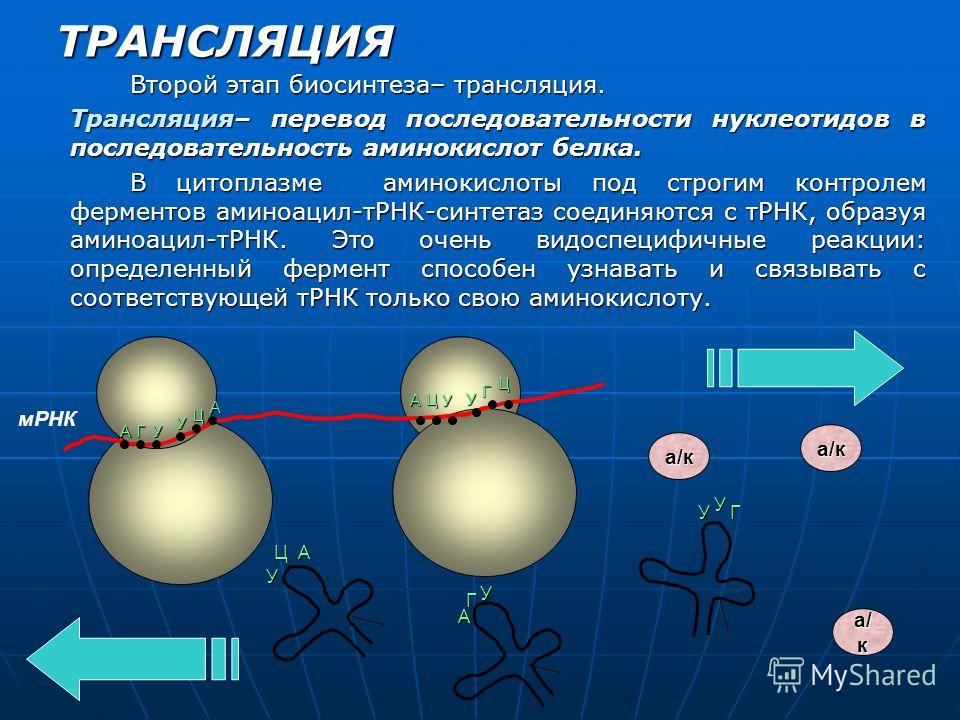 Считается, что последовательность событий тут такая: распознавание стартового «слова» вызывает распад ГТФ (то есть «запуск сигнальной ракеты»), после чего белки-лоцманы, висящие на малой субчастице, разбегаются, чтобы к ней могла пристыковаться большая субчастица. (Стыковка происходит опять же с помощью дополнительных обслуживающих белков и опять же с распадом ещё одной молекулы ГТФ.) И вот теперь полная рибосома, образованная большим и малым «модулями», начинает читать генетический текст и собирать в соответствии с ним белковую молекулу.
Считается, что последовательность событий тут такая: распознавание стартового «слова» вызывает распад ГТФ (то есть «запуск сигнальной ракеты»), после чего белки-лоцманы, висящие на малой субчастице, разбегаются, чтобы к ней могла пристыковаться большая субчастица. (Стыковка происходит опять же с помощью дополнительных обслуживающих белков и опять же с распадом ещё одной молекулы ГТФ.) И вот теперь полная рибосома, образованная большим и малым «модулями», начинает читать генетический текст и собирать в соответствии с ним белковую молекулу.
Однако результаты сотрудников лаборатории Ивана Николаевича Шатского из Института НИИ физико-химической биологии имени А.Н. Белозерского, опубликованные в Nucleic Acids Research, заставляют описанную картину несколько пересмотреть. Не будем углубляться в тонкости методов, которые исследователи использовали в работе. Сразу перейдём к выводам: по новым данным, распад ГТФ, который, как считалось, удостоверяет узнавание места старта, на самом деле происходит до этого. То есть весь молекулярный агрегат, наткнувшись на участок в РНК, который с очень большой вероятностью является настоящим стартом, обращается с ГТФ – а точнее, к тем белкам, которые отвечают за её распад. Если ГТФ гидролизовалась, то начнётся синтез белка, если нет, то пусть тут будет хоть трижды «старт», рибосомный малый модуль проедет дальше.
То есть весь молекулярный агрегат, наткнувшись на участок в РНК, который с очень большой вероятностью является настоящим стартом, обращается с ГТФ – а точнее, к тем белкам, которые отвечают за её распад. Если ГТФ гидролизовалась, то начнётся синтез белка, если нет, то пусть тут будет хоть трижды «старт», рибосомный малый модуль проедет дальше.
Но о чём тогда сигнализирует «сигнальная ракета»? Здесь нужно вспомнить ещё раз про факторы инициации белки-лоцманы. Распад, гидролиз ГТФ зависит от присутствия сразу двух белков, и, если какого-то из них не хватает, не будет никакой «сигнальной ракеты». Иными словами, здесь происходит проверка на присутствие всех факторов инициации, и, если все они есть в достаточном количестве, значит, можно плотно сесть на точку старта, присоединить большую субчастицу и т. д.
Если доискиваться глобального биологического смысла, то тут мы имеем дело с дополнительной проверкой, дополнительным пунктом контроля, дополнительным cheсkpoint’ом в крайне важном и крайне сложном молекулярно-клеточном процессе.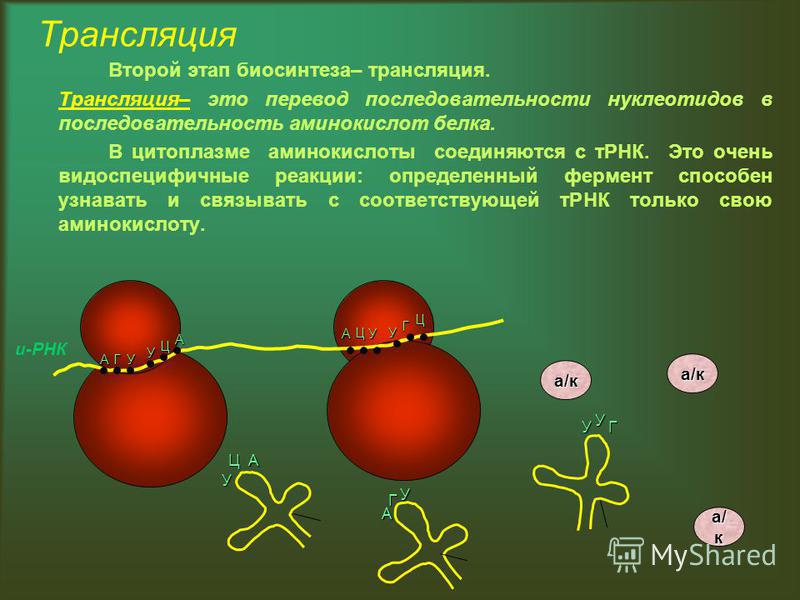 (Известно, что чем сложнее процедура, тем лучше лишний раз перестраховатся и лишний раз проверить, всё ли идёт как надо.)
(Известно, что чем сложнее процедура, тем лучше лишний раз перестраховатся и лишний раз проверить, всё ли идёт как надо.)
Вообще, инициация – то есть начало – трансляции у эукариот очень зарегулирована, на этих самых белках-лоцманах и на рибосомах сходятся множество сигнальных цепочек: прежде, чем начать синтез белка, клетка должна ясно понять, что за белок и в каком количестве он нужен. Ну, а важность новых данных, проясняющих картину трансляции, легко себе представить, если вспомнить, что многие онкологические процессы начинаются как раз с неполадок в синтезе белка, когда, к примеру, какой-то молекулы, понуждающей клетку к делению, вдруг становится в клетке слишком много.
По материалам МГУ .
Биологи МГУ узнали, как в живой клетке начинается синтез белка — Наука
Без гидролиза сборка белковой молекулы невозможна. Этот процесс ученые назвали «слайдингом», сообщает пресс-служба МГУ им М.В. Ломоносова. Исследование биологов под руководством Сергея Дмитриева опубликовано в журнале Nucleic Acids Research.
Существенная доля нашей генетической информации, закодированной в ДНК, реализуется в живой клетке в виде белков. Для того чтобы синтезировать нужный белок, эту информацию нужно перевести из последовательности нуклеотидов на язык аминокислот. В этой стадии преобразования участвует матричная РНК — «временный носитель», на котором находится копия одного конкретного гена. Специальная молекулярная машина — рибосома — движется по матричной РНК и считывает тройки нуклеотидов, каждая из которых кодирует ту или иную аминокислоту.
Таким образом, рибосома должна определить, с какого места ей необходимо начинать считывание. Если же первая тройка нуклеотидов будет выбрана неверно, рибосома начнет синтезировать неправильный белок, который окажется бесполезным или даже токсичным для клетки.
Для решения этой проблемы существует специальный механизм — рибосомное сканирование. Сначала малая субчастица рибосомы, нагруженная специальными белками, связывается с концом матричной РНК, которая играет роль «инструкции» по сборке белковой молекулы. Затем рибосома начинает перемещаться по мРНК, «просматривая» один за другим все встречающиеся ей тройки нуклеотидов. Как правило, в качестве точки старта используется тройка нуклеотидов AUG. Когда рибосома находит его, она останавливается и начинает синтез белка. Ранее считалось, что обнаружение AUG — единственное и важнейшее событие, приводящее к началу синтеза с нужной точки.
Затем рибосома начинает перемещаться по мРНК, «просматривая» один за другим все встречающиеся ей тройки нуклеотидов. Как правило, в качестве точки старта используется тройка нуклеотидов AUG. Когда рибосома находит его, она останавливается и начинает синтез белка. Ранее считалось, что обнаружение AUG — единственное и важнейшее событие, приводящее к началу синтеза с нужной точки.
Когда малая субчастица встречает тройку нуклеотидов AUG, она может начать сборку белковой молекулы (инициировать трансляцию), а может и не начать. Это зависит от того, какой набор белков-помощников будет в ее распоряжении. Эти специальные белки так и называются — факторы инициации трансляции (сокращенно — eIF). Они имеют номера: так, у эукариот (организмов с ядром в клетке, к которым также относится человек) один из самых важных факторов — второй (eIF2). Он вместе с транспортной РНК привозит первый «кирпичик» белка — аминокислоту метионин. В конце к малой субчастице рибосомы должна присоединиться еще и большая.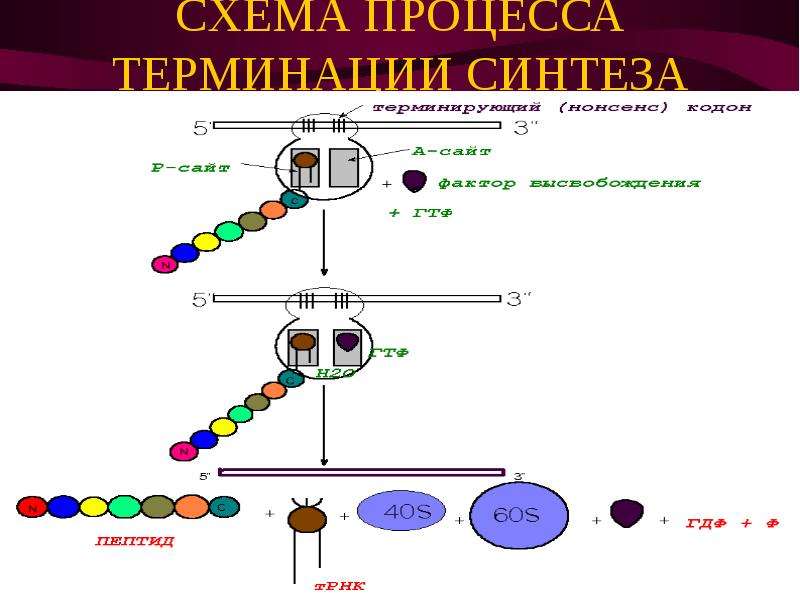 Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
«Как оказалось, если гидролиза не произойдет, то малая субчастица проигнорирует стартовый кодон AUG и проскользнет дальше, как ни в чем не бывало. Мы назвали это слайдингом», – говорит Сергей Дмитриев.
Открытие слайдинга опровергает устоявшееся мнение о том, что процесс выбора точки начала трансляции заканчивается на моменте распознавания точки старта синтеза. Решающим событием является не узнавание AUG, а гидролиз ГТФ.
Синтез белков контролируется молекулярным таймером
Еще одна важная функция: нетранслируемые участки мРНК регулируют синтез белка. Известно множество примеров, когда с нетранслируемыми областями мРНК связываются регуляторные белки (или короткие РНК), которые или подавляют, или стимулируют синтез белка.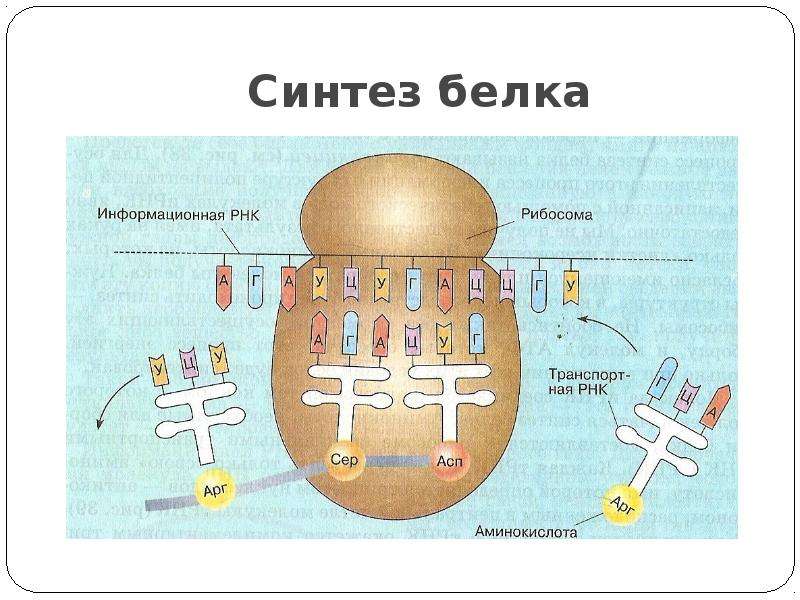 Это позволяет клетке быстро «включать» или «выключать» синтез определенных белков. Это важно, так как в зависимости от окружающих условий клетке необходим строго определенный набор белков. Нарушение регуляции синтеза может привести к бесконтрольному производству белков. Например, дерегуляция белков, отвечающих за клеточное деление, создает опасность для начала неконтролируемого роста числа клеток — одной из главных особенностей раковых клеток.
Это позволяет клетке быстро «включать» или «выключать» синтез определенных белков. Это важно, так как в зависимости от окружающих условий клетке необходим строго определенный набор белков. Нарушение регуляции синтеза может привести к бесконтрольному производству белков. Например, дерегуляция белков, отвечающих за клеточное деление, создает опасность для начала неконтролируемого роста числа клеток — одной из главных особенностей раковых клеток.
Изучая регуляцию трансляции мРНК фермента Amd1, ключевого на пути биосинтеза полиаминов (полимеров, содержащих аминогруппы), ученые из Университетского колледжа Корка, Медицинской школы Гарварда, МГУ имени М.В. Ломоносова и Департамента генетики человека Университета Юты обнаружили новый механизм регуляции синтеза белка.
«Давно известно, что рибосома плохо умеет синтезировать последовательности некоторых триплетов, — говорит Дмитрий Андреев, старший научный сотрудник НИИ физико-химической биологии имени А.Н. Белозерского МГУ, — поэтому, когда такая последовательность ей попадается, рибосома может прочно застрять на мРНК. Из-за этого все рибосомы, едущие вслед за ней, тоже моментально застрянут, поскольку не могут «перепрыгнуть» застрявшего товарища, и тогда продукция белка прекратится. Исследуя регуляцию Amd1, мы обнаружили такой сигнал застревания. Но интересно оказалось то, что этот сигнал расположен после стоп кодона рамки считывания Amd1. Зачем же он там нужен?»
Из-за этого все рибосомы, едущие вслед за ней, тоже моментально застрянут, поскольку не могут «перепрыгнуть» застрявшего товарища, и тогда продукция белка прекратится. Исследуя регуляцию Amd1, мы обнаружили такой сигнал застревания. Но интересно оказалось то, что этот сигнал расположен после стоп кодона рамки считывания Amd1. Зачем же он там нужен?»
Дело в том, что трансляционный аппарат не должен допускать ошибки в синтезе белков, поскольку неправильные белки могут навредить клетке. Его точность имеет свои границы. Так, рибосома, дошедшая до стоп-кодона, может по ошибке прочитать его как аминокислоту и двинуться дальше, синтезируя более длинный белок. Вероятность такого события достаточно мала: по словам ученых, обычно она не превышает доли процента. Но именно прочтение стоп-кодона оказалось ключевым к пониманию нового механизма регуляции Amd1.
Ученые определили, что примерно 1 из 60 рибосом проезжает стоп-кодон Amd1, но через некоторое расстояние она очень прочно застревает на «плохой» последовательности.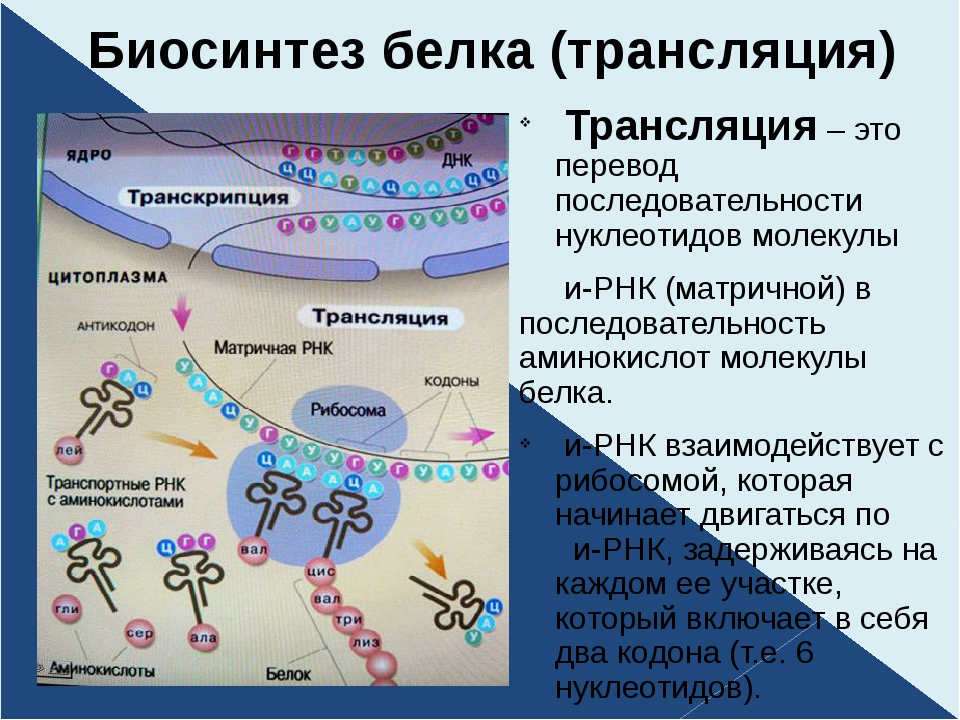 При этом ничего страшного не происходит, но следующая проехавшая стоп-кодон рибосома застревает в очереди за первой. И так до тех пор, пока «очередь» из застрявших рибосом не доберется до стоп кодона. Как только это произойдет, продукция белка сразу же прекратится.
При этом ничего страшного не происходит, но следующая проехавшая стоп-кодон рибосома застревает в очереди за первой. И так до тех пор, пока «очередь» из застрявших рибосом не доберется до стоп кодона. Как только это произойдет, продукция белка сразу же прекратится.
«Мы назвали такой механизм регуляции синтеза белка молекулярным таймером, — рассказывает Андреев, — ведь в молекуле такой мРНК, по сути, «зашит» механизм, позволяющий точно контролировать, сколько молекул белка будет синтезировано. Даже если рибосомы начнут усиленно «садиться» на такую мРНК, прочитывание стоп-кодона с последующим застреванием — молекулярный таймер — позаботится о том, чтобы выключить синтез белка через определенное число циклов».
Стоит отметить, что Amd1 обладает онкогенными свойствами, ранее было показано, что его усиленная продукция в клетке может приводить к появлению чрезвычайно агрессивных метастазирующих опухолей. Если научиться «включать» таймер, регулирующий его синтез (например, усиливая прочтение стоп-кодона), с помощью лекарственных препаратов, то такой подход может найти применение в медицине. Сегодня уже разрабатываются препараты, действие которых основано на усилении прочтения стоп-кодонов – один из таких препаратов уже одобрен в Европе для лечения дистрофии Дюшена.
Сегодня уже разрабатываются препараты, действие которых основано на усилении прочтения стоп-кодонов – один из таких препаратов уже одобрен в Европе для лечения дистрофии Дюшена.
Пресс-релизы о научных исследованиях, информацию о последних вышедших научных статьях и анонсы конференций, а также данные о выигранных грантах и премиях присылайте на адрес [email protected].
Пищевой белок и основы синтеза мышечного белка
Любая дискуссия о соответствии сывороточного белка функции поддержки здоровой мышечной ткани должна начинаться с определения самого главного: что представляет из себя сам белок?
Профессор Люк ван Лун, Медицинский центр Маастрихтского университета
Пищевой белок и основы синтеза мышечного белка
Объясняя основы белкового обмена и его значение для мышечной ткани, я хотел бы подчеркнуть, что все наши ткани, включая скелетные мышцы (которые являются основным объектом исследований моей лаборатории) постоянно синтезируются и снова разрушаются, будучи частью циклического процесса. Это означает, что мышца может быть полностью восстановлена всего за два месяца ─ это процесс, который включает как новые, так и переработанные аминокислоты.
Это означает, что мышца может быть полностью восстановлена всего за два месяца ─ это процесс, который включает как новые, так и переработанные аминокислоты.
С внешней точки зрения этот цикл обновления постоянно индуцируется двумя основными анаболическими (стимулирующими мышцы) стимулами: приемом пищи и физической активностью. Под потреблением пищи я подразумеваю незаменимые аминокислоты, полученные из пищевого белка. Как только вы едите или пьете что-то, содержащее белки, аминокислоты попадают в вашу систему кровообращения, стимулируя синтез белка скелетных мышц. Некоторые из этих аминокислот, такие как лейцин, особенно сильны в управлении этим анаболическим ответом на прием пищи.
Влияние на синтез мышц
Как же мы можем модулировать этот ответ? Каким образом мы можем повлиять на стимуляцию синтеза мышечного белка после приема пищи? Одним из способов, естественно, является изменение количества и типа потребляемого пищевого белка. Второй заключается в изменении другого основного анаболического стимула: количества физической активности, которая предшествует и/или следует за приемом белка. Это влияет на то, что происходит с белками, которые вы недавно употребили в пищу, а также с белками, которые вы перевариваете после выполнения упражнений. Поэтому, если вы будете тренироваться сегодня, реакция вашего тела на завтрак следующего дня тоже будет выше. Было показано, что это постпрандиальное увеличение скорости синтеза мышечного белка (после приема пищи) еще больше возрастает, когда физическая активность выполняется в день (дни), предшествующий приему пищи.
Это влияет на то, что происходит с белками, которые вы недавно употребили в пищу, а также с белками, которые вы перевариваете после выполнения упражнений. Поэтому, если вы будете тренироваться сегодня, реакция вашего тела на завтрак следующего дня тоже будет выше. Было показано, что это постпрандиальное увеличение скорости синтеза мышечного белка (после приема пищи) еще больше возрастает, когда физическая активность выполняется в день (дни), предшествующий приему пищи.
Популярное утверждение «вы – то, что вы едите» начинает приобретать гораздо больший смысл, как только вы понимаете эти основные принципы. Всего через два часа после ужина большая часть белка из еды будет превращена в нового Вас!
Какие белки?
В наших попытках усилить и контролировать синтез мышц посредством приема пищи мы можем изменять как тип, так и количество потребляемого белка. При интенсивных физических упражнениях увеличение количества белка, вероятно, необходимо для стимулирования большего синтеза: либо для поддержания мышечной массы, либо для ее увеличения. Возможно, более интересным вопросом в контексте этого поста является выбор белка. До настоящего времени исследования показали, что употребление 20 граммов высококачественного белка после тренировки достаточно для максимизации скорости синтеза мышечного белка в течение нескольких часов после восстановления у здоровых молодых спортсменов.
Возможно, более интересным вопросом в контексте этого поста является выбор белка. До настоящего времени исследования показали, что употребление 20 граммов высококачественного белка после тренировки достаточно для максимизации скорости синтеза мышечного белка в течение нескольких часов после восстановления у здоровых молодых спортсменов.
Также, вероятно, существуют различия в анаболических свойствах различных источников белка. Способность пищевого белка стимулировать синтез мышечного белка, по-видимому, зависит как от его усвояемости, так и от аминокислотного состава. Белки с высоким содержанием незаменимых аминокислот, которые быстро перевариваются и имеют высокое содержание лейцина, имеют тенденцию к большей синтетической реакции мышечного белка. Это объясняет, почему сывороточный белок часто стимулирует синтез мышечного белка в большей степени, чем другие белки.
Эффективное питание
Ключом к пониманию пригодности сывороточного белка, например, для спортивного питания является тот факт, что относительно небольшое количество сывороточного белка может вызывать относительно сильный анаболический ответ. Таким образом, атлеты могут принимать относительно небольшое количество сывороточного протеина и при этом максимально увеличить восстановление после тренировки. Эта компактная функциональность может быть полезна для всех нас, любителей спорта, а также для групп пациентов с более клинически выраженными нарушениями.
Таким образом, атлеты могут принимать относительно небольшое количество сывороточного протеина и при этом максимально увеличить восстановление после тренировки. Эта компактная функциональность может быть полезна для всех нас, любителей спорта, а также для групп пациентов с более клинически выраженными нарушениями.
Конечно, изучение синтеза мышечного белка и влияние пищевого белка на него является гораздо более широкой областью. Исследования синтеза белка в базальных мышцах продолжают раскрывать эту информацию, но суть уже ясна: хотя потребление белка можно считать важным первым шагом в стимулировании синтеза мышечного белка, поддержание сбалансированного цикла распада и синтеза мышц зависит от сочетания достаточного, соответствующего пищевого белка и более, чем достаточной, привычной физической активности, особенно в пожилом возрасте.
Автор статьи: Лук Ван Лун, профессор физиологии упражнений и руководитель исследовательского подразделения M3 на кафедре биологии человека и наук о движении в Медицинском центре Маастрихтского Университета
Источник:Arla Foods Ingredients.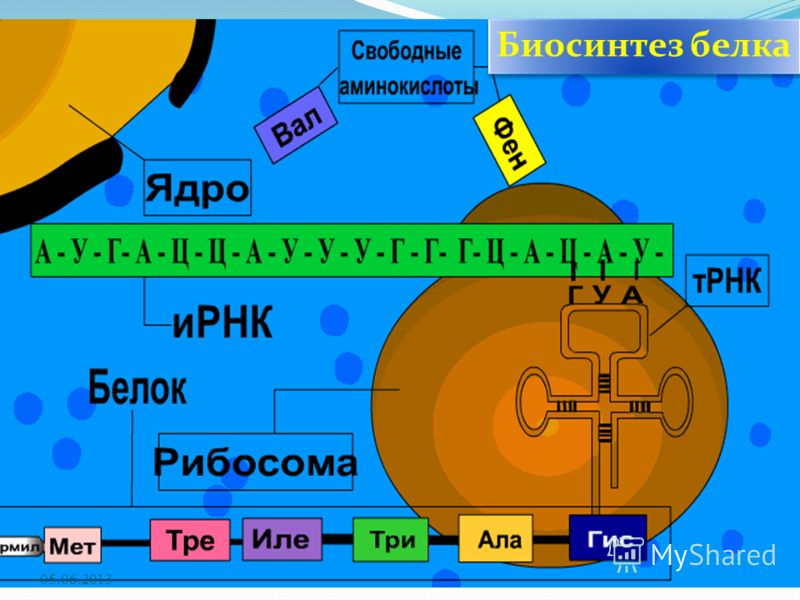
Сколько белков нужно вашему организму и откуда их лучше брать
- Джессика Браун
- BBC Future
Автор фото, iStock
Некоторые эксперты заявляют, что покупать продукты с повышенным содержанием белков (и по повышенной цене) — это все равно, что спускать деньги в унитаз. Правы ли они?
Сколько белков нам на самом деле нужно? Помогают ли они избавиться от лишнего веса? И кому они вообще помогают?
В начале ХХ века канадский исследователь Арктики, этнограф и писатель Вильялмур Стефанссон принял решение в течение пяти лет есть только мясо. Соответственно, его рацион в те годы состоял примерно на 80% из жиров и на 20% из белков.
Двадцать лет спустя, в 1928 году, он повторил эксперимент под наблюдением специалистов из знаменитой нью-йоркской больницы Бельвью, но ограничился одним годом.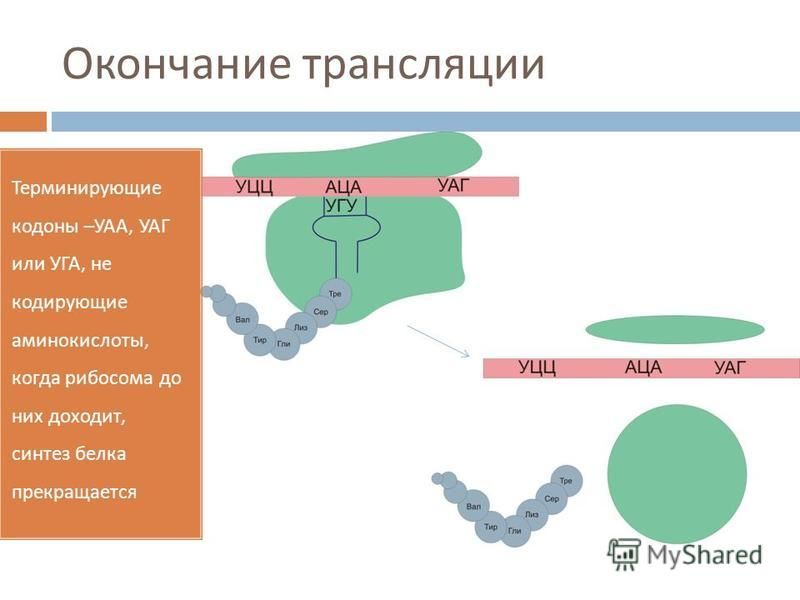
Стефанссон хотел опровергнуть мнение, что на одном мясе человек не выживет.
Но в ходе обоих экспериментов ему быстро становилось плохо, если он какое-то время потреблял только нежирное мясо.
У него развивалось так называемое белковое отравление, которое прозвали «истощением от крольчатины».
Симптомы исчезали, когда он изменял рацион — начинал есть меньше белков и больше жиров.
После тех экспериментов, живя в Нью-Йорке и потребляя типичный американский рацион со средним содержанием белков, Стефанссон начал жаловаться на ухудшение здоровья.
Он вернулся к своей диете — с ограничением углеводов и высоким содержанием жиров и белков — и прожил на ней до 83 лет.
Так или иначе, его первые эксперименты — одни из немногих формальных научных доказательств того, что высокобелковая диета может быть очень вредной.
Автор фото, Getty Images
Подпись к фото,Производители протеиновых добавок советуют выпивать после тренировки протеиновый коктейль, чтобы мышечные ткани восстанавливались и росли
Несмотря на большую популярность протеиновых пищевых добавок, многие из нас до сих пор точно не знают, сколько белков нам нужно, как именно их потреблять и чем грозит их дефицит или избыток в организме.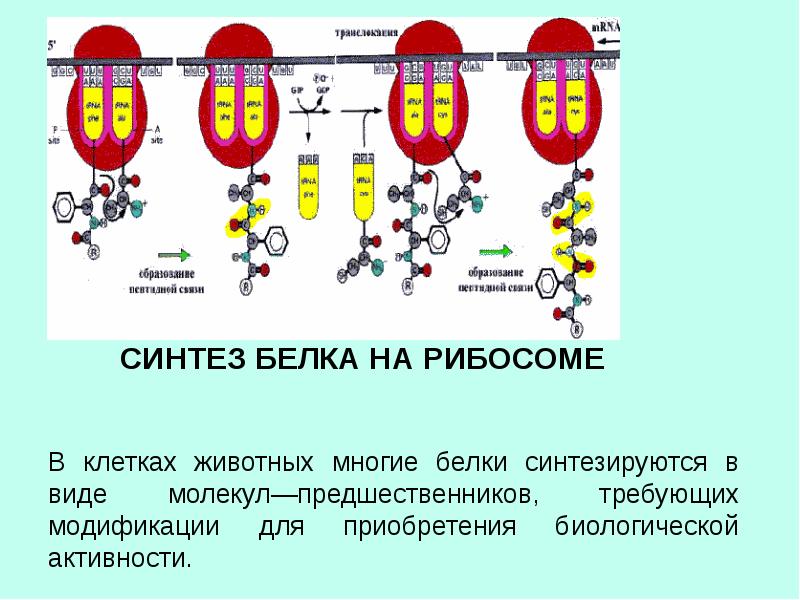
Белки на авансцене
За последние двадцать лет уровень ожирения среди британцев повысился вдвое, и многие начинают более сознательно подходить к питанию. Мы заменяем белый хлеб черным и цельнозерновым, а обычное молоко — обезжиренным.
В маркетинговом шоу о здоровом образе жизни белки исполняют главную роль: полки супермаркетов пестрят протеиновыми батончиками, протеиновыми шариками и повседневными продуктами, обогащенными белками — от зерновых хлопьев до супов.
В 2016 году объем глобального рынка протеиновых пищевых добавок составлял примерно 12,4 млрд долларов. Очевидно, нас убедили, что чем больше белков — тем лучше.
А сколько их надо?
Впрочем, некоторые эксперты сейчас заявляют, что покупать продукты с повышенным содержанием белков (и по повышенной цене) — это выбрасывать деньги на ветер.
Давайте разберемся. Белки необходимы для роста и восстановления клеток тела. Белковая пища — мясо, рыба, яйца, молочные продукты и бобовые — в желудке расщепляется на аминокислоты и поглощается тонким кишечником; потом печень решает, какие из аминокислот нужны организму. Остальные вымываются с мочой.
Белковая пища — мясо, рыба, яйца, молочные продукты и бобовые — в желудке расщепляется на аминокислоты и поглощается тонким кишечником; потом печень решает, какие из аминокислот нужны организму. Остальные вымываются с мочой.
Автор фото, iStock
Подпись к фото,Покупаете белковые добавки? Рискуете выбросить деньги на ветер
Взрослым, чей образ жизни не особо активен, советуют ежедневно потреблять примерно 0,75 г белков на килограмм массы тела.
В среднем это 55 г для мужчин и 45 г для женщин. Их можно получить из двух порций (размером в ладонь) таких продуктов как мясо, рыба, тофу, орехи или бобовые.
Если белков недостаточно, у человека могут выпадать волосы, появляться сыпь на коже или снижаться вес из-за потери мышечной массы.
Но такие побочные эффекты встречаются очень редко, в основном у тех, кто страдает от пищевых расстройств.
Белки для шварценеггеров
Для большинства из нас белки ассоциируются с бодибилдингом. Так и есть.
Так и есть.
Силовые упражнения приводят к расщеплению белков в мышцах. Чтобы мышцы крепли, белки должны возобновляться.
Особенно важную роль в запуске процессов синтеза белков играет аминокислота под названием лейцин.
Автор фото, Getty Images
Подпись к фото,Многие потребляют продукты спортивного питания, например, протеиновые батончики и коктейли
Некоторые специалисты даже считают, что, если не поесть после тренировки богатой белками пищи или специальных добавок, мышцы не вырастут.
Производители добавок советуют выпивать после тренировки протеиновый коктейль — обычно на основе богатого лейцином сывороточного белка, побочного продукта производства сыра.
Потребители, судя по всему, соглашаются. Согласно отчету, опубликованному в 2017 году исследовательской компанией Mintel, 27% британцев потребляют продукты спортивного питания — такие как протеиновые батончики и коктейли.
Эта цифра возрастает до 39% среди тех, кто тренируется чаще одного раза в неделю.
Но более половины (63%) из тех, кто потребляет упомянутые продукты, не могут точно сказать, есть ли от них польза.
Так помогают или нет?
Исследования того, насколько протеиновые добавки помогают нарастить мышцы, показывают неоднозначные результаты.
В частности, в 2014 году ученые проанализировали 36 научных статей на эту тему и пришли к выводу: протеиновые добавки не влияют на нежировую массу тела и силу мышц в течение первых нескольких недель силовых тренировок у людей, которые ранее не занимались спортом.
Со временем, когда тренировки становятся интенсивнее, добавки действительно могут способствовать наращиванию мышц. Однако авторы отмечают, что такие изменения не исследовались в долгосрочной перспективе.
Другое исследование за 2012 год говорит, что протеин «улучшает результативность тренировок, способствует восстановлению и увеличивает нежировую массу тела», но в нем отмечается: для лучших результатов белки следует потреблять вместе с быстрыми углеводами.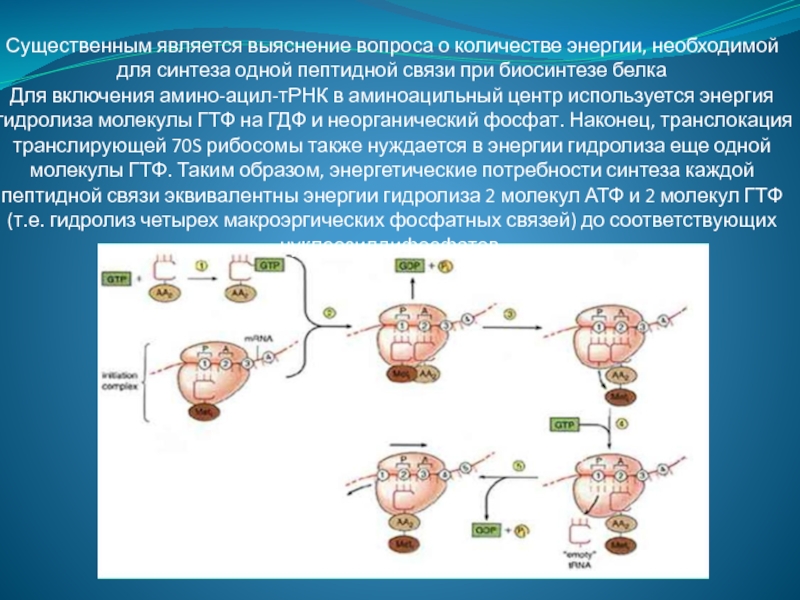
Обычные сладкие батончики?
И — внимание! — если спортсменам и посетителям тренажерных залов полезно быстрое «вливание» белков в организм сразу после тренировки, это не значит, что обязательно употреблять добавки и коктейли.
Большинство людей и так получает основную часть рекомендованного дневного количества белков из обычной пищи, говорит Кевин Типтон, преподаватель физической культуры из Университета Стерлинга.
«В добавках нет необходимости. Это удобный способ получить протеин, но в них нет ничего такого, чего не получишь из обычной еды. Протеиновые батончики — это обычные сладкие батончики с несколько большим содержанием белков».
Автор фото, Getty Images
Подпись к фото,В 2016 году объем всемирного рынка протеиновых пищевых добавок составлял 12,4 млрд долларов
Типтон добавляет, что даже для культуристов сывороточный белок и другие подобные вещества не столь важны, как это нам пытаются подать.
«Внимание слишком смещено на то, какие добавки употреблять, но на самом деле важнее идти в зал и тренироваться. Важное значение для результата имеют и другие переменные, такие как сон, диета и уровень стресса», — подчеркивает он.
Большинство экспертов согласно с Типтоном: белки лучше получать из пищи, а не из добавок. Но есть определенные исключения — в частности, спортсмены, которым трудно достигать ежедневной цели в потреблении белков, отмечает Грэм Клоуз, профессор физиологии Ливерпульского университета имени Джона Мурса.
«По моему мнению, потребности большинства из них превышают рекомендованную дневную норму, и этому есть доказательства», — говорит он. В таком случае коктейль может быть полезным.
Кому еще необходимы белки?
Какой еще демографической группе не помешают дополнительные белки? Пожилым людям. Потому что с возрастом мы нуждаемся в большем количестве белков для поддержания той же мышечной массы.
В то же время пожилые люди склонны потреблять меньше белков, потому что их вкусы часто сдвигаются в сторону расположения к сладкому.
Автор фото, Getty Images
Подпись к фото,Мы как правило получаем большую часть рекомендованного дневного количества белка из своего обычного рациона
Эмма Стивенсон, профессор физической культуры с Ньюкаслского университета, пытается договориться с производителями продуктов питания о повышении содержания белков в изделиях, которые часто покупают пожилые люди, например, в печенье.
«С возрастом нам нужно особенно тщательно сохранять свою мышечную массу, ведь мы становимся слабыми и менее активными», — говорит она.
Клоуз утверждает, что пожилые люди должны повысить потребление белков до 1,2 г на килограмм массы тела.
Можно ли их переесть?
К счастью, употребить слишком много белков очень сложно. Хотя верхний лимит существует, его «практически невозможно» достичь, считает Типтон.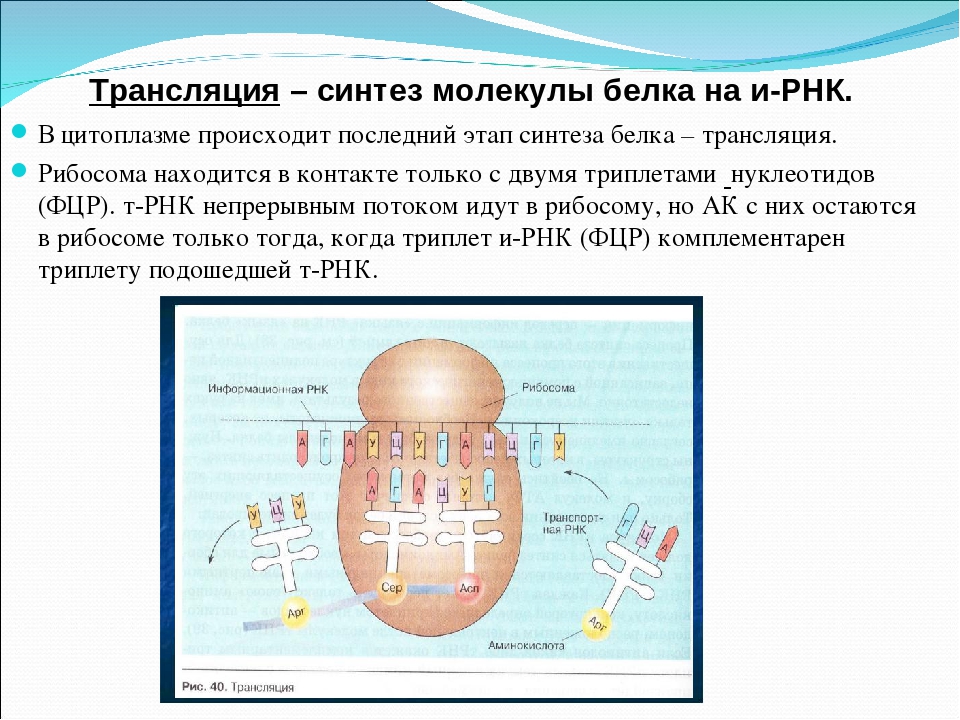
«Некоторые диетологи обеспокоены, что высокобелковая диета может навредить почкам и костям, но доказательств тому очень мало, если речь идет о вполне здоровых людях».
«Возможно, проблемы и возникнут, если человек с больными почками будет есть большое количество белков; но любые плохие последствия очень маловероятны».
Впрочем, хотя белки сами по себе не вредны, белковые добавки часто содержат значительное количество углеводов из группы FODMAP, а те в свою очередь вызывают расстройства пищеварения: вздутие живота, метеоризм, боль в желудке.
Стивенсон советует внимательно читать информацию на этикетках пищевых добавок, батончиков и шариков.
«Часто они очень калорийны и содержат огромное количество углеводов, нередко в форме сахара. Не следует думать, что «высокое содержание протеина» автоматически означает здоровую пищу», — говорит она.
Помогают ли они похудеть?
Белки давно связывают с похудением; высокобелковые и низкоуглеводные диеты (например, палеодиета или диета Аткинса) обещают продлить ощущение сытости.
Людям часто не удается похудеть, потому что они чувствуют голод и едят. Как показали исследования с использованием МРТ, высокобелковый завтрак способствует уменьшению аппетита в течение дня.
Есть достаточно доказательств того, что белки хорошо утоляют голод, говорит Алекс Джонстоун с Абердинского университета. Если вы пытаетесь похудеть, то важнее есть высокобелковые завтраки (например, тост с фасолью или молочный коктейль), чем принимать добавки.
Но она не защищает диету Аткинса и обнаружила в своем исследовании, что исключение из рациона углеводов негативно сказывается на здоровье кишечника (а мы знаем, что здоровый кишечник критически важен для многих аспектов нашего здоровья и благополучия).
Автор фото, Getty Images
Подпись к фото,Протеиновые шарики часто высококалорийны и содержат огромное количество углеводов
Джонстоун рекомендует людям с избыточным весом поддерживать рацион, богатый белками и умеренно богатый углеводами: 30% белков, 40% углеводов и 30% жиров.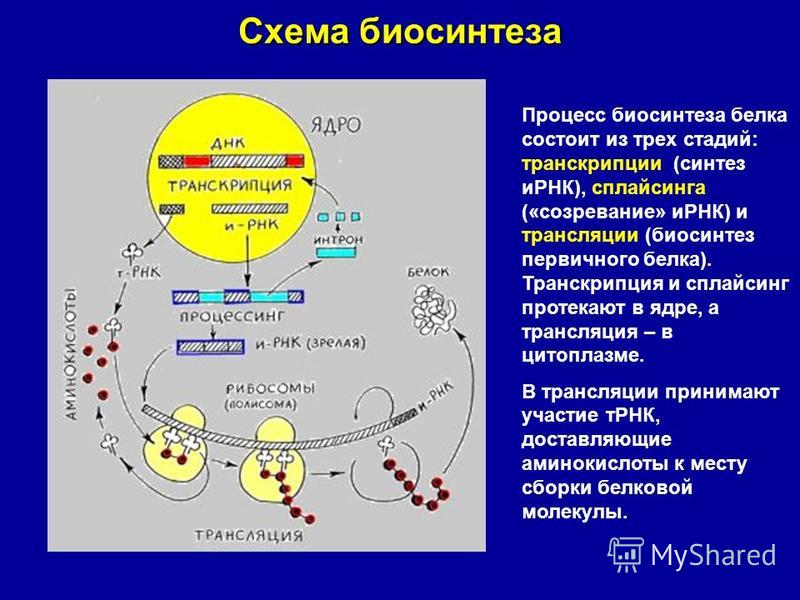
Для сравнения: людям без лишнего веса рекомендуют потреблять в среднем 15% белков, 55% углеводов и 30% жиров.
Конечно же, вы не похудеете, если только увеличите потребление белков. Важный ключ к успеху — есть курятину, другое нежирное мясо или рыбу.
Есть ли риски и как их избежать?
Исследования также показывают, что потребление большого количества животных белков способствует набору веса, а красное мясо повышает риск рака и сердечных заболеваний.
Однако существуют полезные белки не мясного происхождения, например, микопротеин — грибной белок.
На его основе в Британии выпустили заменитель мяса под маркой Quorn — в нем много не только белков, но и клетчатки. Сейчас исследователи изучают, как эта уникальная комбинация влияет на ощущение сытости и уровень инсулина, связанный с диабетом второго типа.
Автор фото, iStock
Подпись к фото,Употребить слишком много белков трудно. Но нужно ли это вам вообще?
Но нужно ли это вам вообще?
Одна исследовательская группа сравнила микопротеиновую диету с диетой на основе курятины и установила: у тех, кто ел Quorn, контроль над содержанием сахара был такой же, но при этом от поджелудочной железы требовалось производить меньше инсулина.
Риск употребить избыточное количество белков небольшой. Но лучше не обольщаться эффективностью продуктов с завышенной ценой, в которых предлагается больше белков, чем нам нужно.
«Некоторые продукты, обозначенные как «высокобелковые», на самом деле таковыми не являются, но стоят довольно дорого», — говорит Джонстоун.
«Как бы там ни было, потреблять больше белков, чем вам нужно, — это расточительство. Это все равно, что спускать деньги в унитаз».
Прочитать оригинал этой статьи на английском языке можно на сайте BBC Future.
Этапы биосинтеза белка
☰
Под этапами биосинтеза белка могут понимать как 1) совокупность процессов транскрипции, трансляции и посттрансляционные модификации, так и 2) только этапы трансляции, так как именно в процессе трансляции происходит непосредственный синтез молекулы полипептида (будущего белка или его составной части).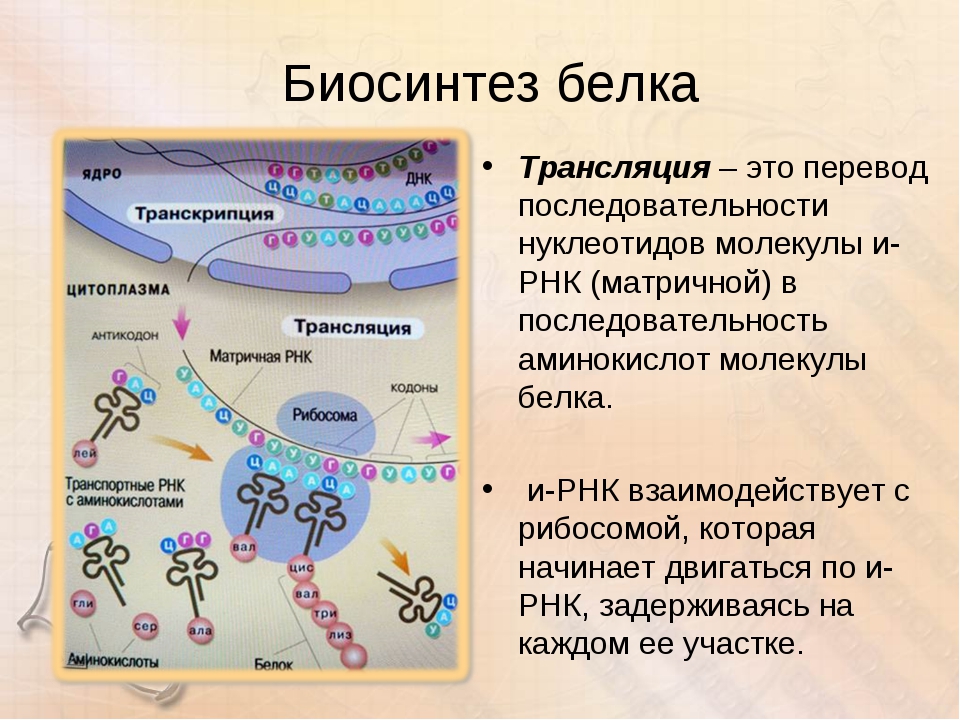
В первом случае рассматриваются три этапа:
- Транскрипция — синтез молекулы мРНК на участке ДНК
- Трансляция — синтез белка (полипептидной цепочки) на рибосомах.
- Приобретение белком своей функциональной третичной структуры (или четверичной).
Во втором случае, говоря об этапах биосинтеза белка, подробно рассматривают, как протекает трансляция, выделяя в ней ряд своих этапов. Остановимся на этом случае.
Трансляция — это процесс биосинтеза белка из аминокислот, который протекает на рибосомах при участии мРНК, тРНК, ферментов (факторов) и включает этапы активации аминокислот, инициацию трансляции, ее элонгацию и терминацию.
Активация аминокислот непосредственно не связана с биосинтезом белка. Аминокислоты плавают в цитоплазме, с помощью специальных ферментов специфичных для каждой кислоты переходят в активную форму и связываются со своими молекулами тРНК. В итоге образуются комплексы аминоацил-тРНК (аа-тРНК) – тРНК, несущие свои аминокислоты.
На этапе инициации трансляции происходит присоединение матричной РНК (мРНК) к малой субъединице рибосомы. Факторы инициации распознают начальный (5′) конец мРНК по кэпу и специальным нуклеотидным последовательностям. При этом стартовый кодон (АУГ) оказывается в недостроенном P-участке рибосомы. После этого присоединяется большая субъединица рибосомы и активные участки достраиваются.
К кодону АУГ комплементарна тРНК с антикодоном УАЦ, которая переносит аминокислоту метионин. Именно эта тРНК и данная аминокислота (у эукариот) всегда начинают синтез полипептида.
На этапе элонгации происходит последовательное присоединение одной аминокислоты за другой, т. е. происходит биосинтез белка. После этапа инициации в P-участке рибосомы находится тРНК, связанная с метионином. В A-участок рибосомы заходит следующая тРНК. Ее антикодон комплементарен находящемуся здесь кодону мРНК (он следующий за стартовым), и несет эта тРНК соответствующую этому кодону аминокислоту.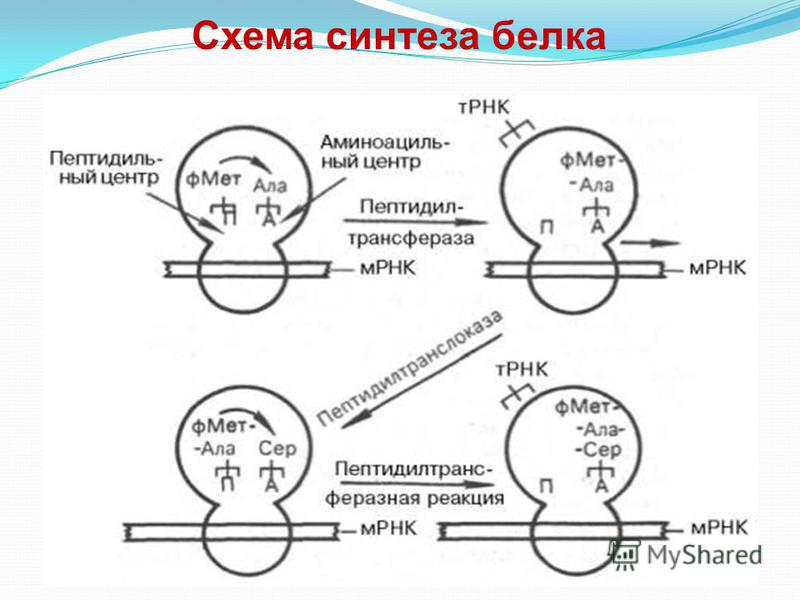
Итак, в P-участке находится один комплекс аа-тРНК, в A-участке – другой. Рибосома располагает тРНК, их аминокислоты и факторы элонгации так, что между аминокислотами протекает химическая реакция, в результате которой образуется пептидная связь. Две аминокислоты оказываются связанными друг с другом.
Рибосома смещается по мРНК на один триплет вперед. При этом та тРНК, что была в P-участке покидает рибосому. Та тРНК, что была в A-участке, оказывается в P-участке. С этой тРНК остается соединенным синтезированный дипептид (состоит из двух аминокислот, первая из которых метионин). A-участок освобождается.
На следующем цикле элонгации в A-участок рибосомы заходит следующий комплекс аа-тРНК. (Антикодон этой тРНК комплементарен находящемуся здесь кодону мРНК. В зависимости от своего антикодона тРНК связывается только с определенной аминокислотой.)
Далее происходит реакция между дипептидом и третьей аминокислотой, образуется трипептид. Рибосома смещается, трипептид связанный с тРНК оказывается в P-участке. Рибосома готова для принятия четвертого комплекса аа-тРНК.
Рибосома смещается, трипептид связанный с тРНК оказывается в P-участке. Рибосома готова для принятия четвертого комплекса аа-тРНК.
Этап элонгации биосинтеза белка (т. е. последовательное присоединение аминокислот к полипептидной цепочки) продолжается до тех пор, пока на мРНК не встретится один из трех стоп-кодонов. Это УАА, УАГ, УГА. Для них не существует своих тРНК, но зато есть специальные факторы терминации, при присоединении которых к рибосоме происходит высвобождение синтезированного полипептида, субъединицы рибосомы расходятся, мРНК также высвобождается. Все это происходит на этапе терминации.
Первый метионин, соответствующий стартовому кодону, вырезается из белка. Внутри полипептида могут находится метионины, их также кодировал кодон АУГ, но поскольку перед этими кодонами не было кэпа и определенных последовательностей нуклеотидов, они не воспринимались системой биосинтеза белка как стартовые.
Часто по одной мРНК «ползут» несколько рибосом (друг за другом), каждая из которых синтезирует свою полипептидную цепь (но идентичные по последовательности аминокислот в готовом продукте).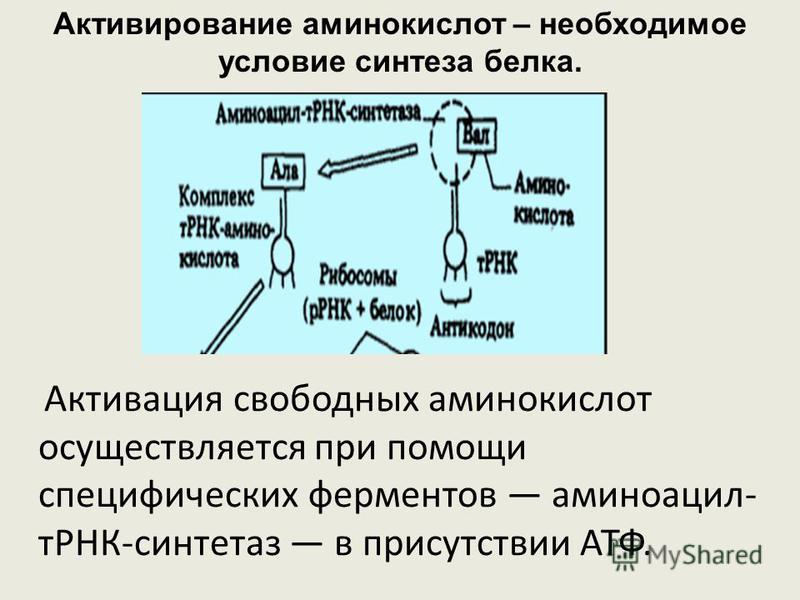 Такую совокупность рибосом называют полирибосомой, или полисомой.
Такую совокупность рибосом называют полирибосомой, или полисомой.
Итак, если под биосинтезом белка понимать только процесс трансляции, то он будет включать три основных этапа: инициацию, элонгацию и терминацию.
Синтез белка
Синтез мРНК с использованием цепи ДНК в качестве матрицы .
Нуклеотиды цепей ДНК считываются группами по три штуки. Каждый триплет называется кодоном . Таким образом, кодон может быть CGA, или TTA, или GCT, или любой другой комбинацией четырех оснований, в зависимости от их последовательности в цепи ДНК. Молекула мРНК состоит из серии кодонов, полученных из генетического сообщения в ДНК.
Как только стоп-кодон достигнут, молекула мРНК покидает молекулу ДНК, и молекула ДНК перематывается, образуя двойную спираль.Между тем, молекула мРНК проходит через клеточную цитоплазму к рибосомам.
Перевод. Трансляция — это процесс, в котором генетический код будет «транслироваться» в аминокислотную последовательность в белке. Процесс начинается с прибытия молекулы мРНК к рибосомам. Пока мРНК синтезировалась, молекулы тРНК объединялись со своими специфическими аминокислотами в соответствии с активностью определенных ферментов. Затем молекулы тРНК начали транспортировать свои аминокислоты к рибосомам, чтобы встретиться с молекулой мРНК.
Процесс начинается с прибытия молекулы мРНК к рибосомам. Пока мРНК синтезировалась, молекулы тРНК объединялись со своими специфическими аминокислотами в соответствии с активностью определенных ферментов. Затем молекулы тРНК начали транспортировать свои аминокислоты к рибосомам, чтобы встретиться с молекулой мРНК.
После того, как молекула мРНК попадает в рибосомы, она раскрывает свои основания в виде наборов из трех кодонов. Каждый кодон имеет дополнительный кодон, называемый антикодоном на молекуле тРНК. Когда кодон молекулы мРНК дополняет антикодон на молекуле тРНК, последняя помещает конкретную аминокислоту в это положение. Затем экспонируется следующий кодон мРНК, и с ним совпадает дополнительный антикодон молекулы тРНК. Аминокислота, переносимая второй молекулой тРНК, таким образом, располагается рядом с первой аминокислотой, и обе они связаны.В этот момент молекулы тРНК высвобождают свои аминокислоты и возвращаются в цитоплазму, чтобы соединиться с новыми молекулами аминокислот.
Затем рибосома движется дальше вниз по молекуле мРНК и обнажает другой кодон, который привлекает другую молекулу тРНК своим антикодоном. На место ставится другая аминокислота. Таким образом, аминокислоты продолжают добавляться в растущую цепь до тех пор, пока рибосома не переместится вниз к концу молекулы мРНК. Таким образом, последовательность кодонов в молекуле мРНК определяет последовательность аминокислот в конструируемом белке (рисунок 2).
Этапы синтеза белка, начиная с генетического кода в ДНК и заканчивая готовой полипептидной цепью .
После того, как белок был полностью синтезирован, он удаляется из рибосомы для дальнейшей обработки. Например, белок может храниться в теле Гольджи эукариотической клетки перед высвобождением, или бактерия может выделять его в виде токсина. Молекула мРНК разрушается, и нуклеотиды возвращаются в ядро. Молекулы тРНК возвращаются в цитоплазму, чтобы объединиться со свежими молекулами аминокислот, и рибосома ожидает прибытия новой молекулы мРНК.
Генный контроль. Процесс синтеза белка не происходит в клетке постоянно, а скорее с интервалами, за которыми следуют периоды генетического «молчания». Таким образом, процесс экспрессии генов регулируется и контролируется клеткой.
Контроль экспрессии генов может происходить на нескольких уровнях клетки. Например, гены редко работают во время митоза. Другие уровни генного контроля могут происходить при транскрипции, когда определенные сегменты ДНК увеличивают и ускоряют активность соседних генов.После транскрипции молекула мРНК может быть изменена для регулирования активности гена. Например, было обнаружено, что мРНК эукариот содержит много бесполезных битов РНК, которые удаляются при производстве конечной молекулы мРНК. Эти бесполезные кусочки нуклеиновой кислоты называются интронами. Остальные части мРНК, называемые экзонами , затем сплайсируются для образования конечной молекулы мРНК. Бактериальная мРНК лишена интронов.
Концепция генного контроля была тщательно исследована на бактериях.У этих микроорганизмов гены были идентифицированы как структурные гены, гены-регуляторы и контрольные области. Эти три блока образуют функциональную единицу, называемую опероном .
Оперон был детально исследован у некоторых бактерий. Было обнаружено, что определенные углеводы могут вызывать присутствие ферментов, необходимых для переваривания этих углеводов. Например, когда присутствует лактоза, бактерии синтезируют ферменты, необходимые для ее расщепления. Лактоза действует как молекула-индуктор следующим образом: в отсутствие лактозы регуляторный ген продуцирует репрессорный белок, который связывается с контрольной областью, называемой участком оператора . Это связывание не позволяет структурным генам кодировать фермент переваривания лактозы. Однако, когда присутствует лактоза, она связывается с репрессорным белком и тем самым удаляет репрессор на участке оператора. Когда сайт оператора свободен, структурные гены высвобождаются для производства фермента, переваривающего лактозу.
Когда сайт оператора свободен, структурные гены высвобождаются для производства фермента, переваривающего лактозу.
Protein Synthesis — The Definitive Guide
Definition
Синтез белка — это процесс, в котором полипептидные цепи образуются из кодированных комбинаций отдельных аминокислот внутри клетки.Синтез новых полипептидов требует кодируемой последовательности, ферментов и мессенджеров, рибосомных и переносящих рибонуклеиновых кислот (РНК). Синтез белка происходит в ядре и рибосомах клетки и регулируется ДНК и РНК.
Синтез белкаЭтапы синтеза белка
Этапы синтеза белка имеют двоякий характер. Во-первых, код белка (цепочка аминокислот в определенном порядке) должен быть скопирован из генетической информации, содержащейся в ДНК клетки. Этот начальный этап синтеза белка известен как транскрипция.
Транскрипция производит точную копию участка ДНК. Эта копия известна как информационная РНК (мРНК), которую затем необходимо транспортировать за пределы ядра клетки, прежде чем можно будет начать следующий этап синтеза белка.
. Второй этап синтеза белка — это трансляция. Трансляция происходит внутри клеточной органеллы, называемой рибосомой. Информационная РНК проникает в рибосому и соединяется с ней под влиянием рибосомальной РНК и ферментов.Трансферная РНК (тРНК) — это молекула, которая несет одну аминокислоту и кодированную последовательность, которая действует как ключ. Этот ключ вписывается в определенную последовательность из трех кодов мРНК, обеспечивая правильную аминокислоту. Каждый набор из трех азотистых оснований мРНК называется кодоном.
Перевод и транскрипция будут объяснены более подробно далее. Чтобы синтез белка был простым, нам сначала нужно знать основы.
Полипептиды и белки
Результатом синтеза белка является цепочка аминокислот, которые были присоединены, звено за звеном, в определенном порядке.Эта цепь называется полимером или полипептидом и построена в соответствии с кодом на основе ДНК. Вы можете представить полипептидную цепь как нить из бусинок, каждая из которых играет роль аминокислоты. Порядок, в котором нанизываются бусинки, скопирован из инструкций в нашей ДНК.
Вы можете представить полипептидную цепь как нить из бусинок, каждая из которых играет роль аминокислоты. Порядок, в котором нанизываются бусинки, скопирован из инструкций в нашей ДНК.
Говоря о синтезе белков, важно различать полипептидные цепи и белки. Все белки являются полипептидами, но не все полипептиды являются белками; однако и белки, и полипептиды состоят из мономеров аминокислот.
Разница между белком и полипептидом заключается в форме. Меньшие цепи аминокислот — обычно менее сорока — остаются одноцепочечными цепями и называются полипептидами. Более крупные цепи должны упаковываться более плотно; они складываются в фиксированные структуры — вторичные, третичные и четвертичные. Когда полипептидная цепь складывается, это называется белком.
Полипептидные цепи образуются в процессе трансляции синтеза белка. Эти полипептиды могут складываться или не складываться в белки на более поздней стадии.Однако термин «синтез белка» используется даже в научном сообществе и не является неправильным.
Понять синтез белка легко, если представить нашу ДНК как книгу рецептов. В этой книге перечислены инструкции, которые показывают клетке, как создавать каждую крошечную часть каждой системы, органа и ткани в нашем теле. Все эти отдельные части представляют собой полипептиды. От кератина в волосах и ногтях до гормонов, которые проходят через кровоток, полипептиды и белки являются краеугольными камнями любой структуры.Наша ДНК не кодирует липиды или углеводы — она кодирует только полипептиды.
Фермент РНК-полимераза открывает книгу рецептов ДНК, которая находится внутри ядра клетки. Он использует определенные фрагменты кода в качестве закладок для поиска нужной страницы. Эта книга рецептов написана на иностранном языке — мРНК копирует написанное, не понимая этого. Рецепты переведены на язык, который другие молекулы могут расшифровать на более позднем этапе. Трансляторы — рибосомы и тРНК. Они читают рецепт и могут собрать нужные ингредиенты и в правильном порядке сделать готовый полипептидный продукт.
Последовательностей ДНК
В ядре две цепи ДНК удерживаются вместе азотистыми основаниями (также называемыми азотистыми основаниями или основаниями). Четыре основания — цитозин, гуанин, аденин и тимин — образуют буквы слов в книге рецептов ДНК.
Одна нить ДНК содержит исходный код. Если внимательно следовать инструкциям этого кода, конкретный правильный полипептид может быть собран вне ядра. Вторая цепь ДНК — цепочка-матрица — является зеркальным отображением исходной цепи.Это должно быть зеркальное отображение, поскольку азотистые основания могут присоединяться только к комплементарным партнерам. Например, цитозин соединяется только с гуанином, а тимин — только с аденином.
Соответствующие пары азотистых оснований Вы, вероятно, встречали такие коды, как CTA, ATA, TAA и CCC в различных учебниках биологии. Если это кодоны (наборы из трех оснований) исходной цепи ДНК, цепочка-матрица будет прикрепляться к ним с помощью своих партнеров. Таким образом, используя приведенные примеры, матричная ДНК будет прикрепляться к исходной цепи ДНК с использованием GAT, TAT, ATT и GGG.
Таким образом, используя приведенные примеры, матричная ДНК будет прикрепляться к исходной цепи ДНК с использованием GAT, TAT, ATT и GGG.
Информационная РНК затем копирует цепь матрицы. Это означает, что в результате создается точная копия исходной пряди. Единственная разница в том, что мРНК заменяет тимин основанием, называемым урацилом. Копия мРНК цепи матрицы с использованием данных примеров будет читаться как CUA, AUA, UAA и CCC.
Основания в ДНК и РНКЭти коды могут быть прочитаны путем переноса РНК вне ядра; рецепт можно понять по молекуле, которая не полностью понимает язык, использованный в оригинале (она не понимает тимин, только урацил).Трансферная РНК помогает доставить нужные части на конвейер рибосомы. Здесь строится белковая цепь, которая соответствует инструкциям в исходной цепи ДНК.
Участники синтеза белка
Для создания скопированного участка кода (транскрипции) нам нужны ферменты, называемые РНК-полимеразами. Эти ферменты собирают свободно плавающие молекулы информационной РНК (мРНК) внутри ядра и собирают их, чтобы сформировать буквы кода. Каждая буква кода ДНК имеет свой собственный ключ, и каждая новая буква, образованная мРНК, несет в себе замок, соответствующий этому ключу, немного похожий на тРНК.
Каждая буква кода ДНК имеет свой собственный ключ, и каждая новая буква, образованная мРНК, несет в себе замок, соответствующий этому ключу, немного похожий на тРНК.
Обратите внимание, что мы говорим о письмах. Это важно. Внутри ядра код ДНК не понимается, его просто копируют — транскрибируют. Понимание кода путем написания слов, образованных этими буквами, — перевод — происходит на более позднем этапе.
Копирование деталей без их понимания — транскрипция РНК-полимеразадолжна найти и перенести соответствующую молекулу мРНК для каждого азотистого основания на цепи матрицы. Выбранные молекулы мРНК соединяются вместе, образуя цепочку букв.В конце концов, эти буквы составят эквивалент фразы. Каждая фраза представляет собой конкретный (полипептидный) продукт. Если рецепт не соблюдается в точности, конечный продукт может быть совершенно другим или работать не так, как должен.
РНК-мессенджер теперь стала кодом. Он переходит к следующей группе важных участников, которые работают на производственных предприятиях. Рибосомы находятся вне ядра клетки, либо в цитоплазме клетки, либо прикреплены к грубому эндоплазматическому ретикулуму; именно рибосомы делают эндоплазматический ретикулум «грубым».
Рибосомы находятся вне ядра клетки, либо в цитоплазме клетки, либо прикреплены к грубому эндоплазматическому ретикулуму; именно рибосомы делают эндоплазматический ретикулум «грубым».
Рибосома разделена на две части, и нить мРНК проходит через нее, как лента в старомодной пишущей машинке. Рибосома распознает и соединяется со специальным кодом в начале переведенной фразы — стартовым кодоном. Молекулы переносящей РНК попадают в рибосому, неся с собой отдельные ингредиенты. Как и во всех этих процессах, для соединения необходимы ферменты.
Старые пишущие машинки помогают нам понять, как работает перевод. Если каждый кодон мРНК имеет замок, тРНК владеет ключами.Ключ тРНК для кодона мРНК называется антикодоном. Когда молекула тРНК содержит ключ, соответствующий трехосновному коду, она может открыть дверь, сбросить свою нагрузку (аминокислоту) и покинуть фабрику рибосом, чтобы собрать еще одну аминокислотную нагрузку. Это всегда будет аминокислота того же типа, что и антикодон.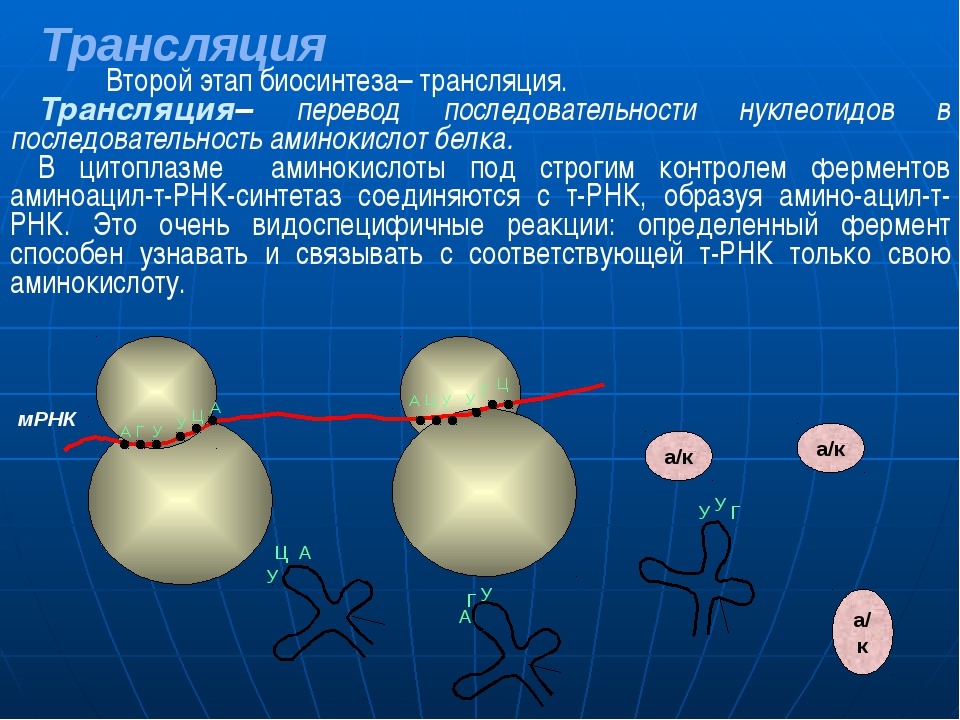
РНК-мессенджер перемещается по рибосоме, как по конвейерной ленте. В следующем кодоне другая молекула тРНК (с правильным ключом) приносит следующую аминокислоту. Эта аминокислота связывается с предыдущей.Начинает формироваться цепочка связанных аминокислот — полипептидная цепь. После завершения эта полипептидная цепь представляет собой точный конечный продукт, произведенный в соответствии с инструкциями в книге рецептов ДНК. Не пирог или пирог, а полипептидная цепочка.
Готовый продукт, готовый к использованиюОб окончании процесса трансляции кода мРНК сигнализирует стоп-кодон. Стартовый и стоп-кодоны не кодируют аминокислоты, но сообщают тРНК и рибосоме, где полипептидная цепь должна начинаться и заканчиваться.
Готовый продукт — вновь синтезированный полипептид — попадает в цитоплазму.Оттуда он может отправиться туда, где это необходимо.
Сайт синтеза белка
Сайт синтеза белка двоякий. Транскрипция (копирование кода) происходит в ядре клетки, где расположена ДНК. Как только мРНК-копия небольшого участка ДНК создана, она проходит через ядерные поры в цитоплазму клетки. В цитоплазме нить мРНК будет двигаться к свободной рибосоме или к рибосоме, прикрепленной к грубому эндоплазматическому ретикулуму. Затем можно начинать следующий этап синтеза белка — трансляцию.
Как только мРНК-копия небольшого участка ДНК создана, она проходит через ядерные поры в цитоплазму клетки. В цитоплазме нить мРНК будет двигаться к свободной рибосоме или к рибосоме, прикрепленной к грубому эндоплазматическому ретикулуму. Затем можно начинать следующий этап синтеза белка — трансляцию.
Новые роли рибосом
Средняя клетка млекопитающего содержит более десяти миллионов рибосом. Раковые клетки могут производить до 7500 рибосомных субъединиц (малых и больших) каждую минуту. Как фабрика по производству полипептидов, существование, развитие и функции каждого живого организма зависят от рибосомы.
Функция рибосомы Ранее считалось, что эукариотические рибосомы играют только эффекторные роли в синтезе белка (вызывают эффект — новый белок).Однако недавние исследования теперь показывают, что рибосомы также регулируют процесс трансляции. Они играют роль в принятии решения о том, какие белки производятся и в каких количествах. Успех и результаты трансляции зависят не только от наличия свободных аминокислот и ферментов — они также зависят от качества рибосом.
Транскрипция в синтезе белка
Процесс транскрипции является первым этапом синтеза белка. На этом этапе генетическая информация от ДНК переносится на рибосомы цитоплазмы или грубого эндоплазматического ретикулума.Транскрипция делится на три фазы: инициирование, удлинение и завершение.
Транскрипция в ядре, трансляция без инициацииДля инициации требуются две специальные группы белков. Первая группа — это факторы транскрипции — они распознают промоторные последовательности в ДНК. Последовательность промотора — это участок кода, находящийся в начале одного гена, который показывает, где должен начинаться процесс копирования и в каком направлении этот код должен читаться. Промотор работает примерно так же, как стартовый кодон на мРНК.
Вторая группа белков, необходимая для инициации транскрипции, состоит из ДНК-зависимых РНК-полимераз (РНКП). Молекула РНК-полимеразы связывается с промотором. Как только это соединение установлено, двухцепочечная ДНК раскручивается и раскрывается (расстегивается).
Соединенные основания удерживают две цепи ДНК в форме двойной спирали. Когда две нити расстегиваются, отдельные и теперь не связанные базы остаются открытыми. Процесс распаковки повторяется вдоль участка ДНК с помощью РНКП до тех пор, пока не будет достигнута точка остановки транскрипции или терминатор.Таким образом, инициация включает распознавание промоторной последовательности и разархивирование участка ДНК под влиянием факторов транскрипции и РНК-полимераз.
РНК-полимераза разделяет основания ДНКЭлонгация
Следующая фаза в процессе транскрипции — элонгация. Когда кодированная последовательность открыта, RNAP могут считывать каждое отдельное основание аденина, гуанина, цитозина или тимина на цепи-шаблоне и соединять с ним правильное основание-партнер. Важно помнить, что РНК не может реплицировать тимин и заменяет его азотистым основанием, известным как урацил.
Если, например, короткая последовательность ДНК на матричной цепи представлена CAGTTA или цитозин-аденин-гуанин-тимин-тимин-аденином, RNAP будет связывать правильные партнерские основания, полученные из популяций свободно плавающих оснований в ядре.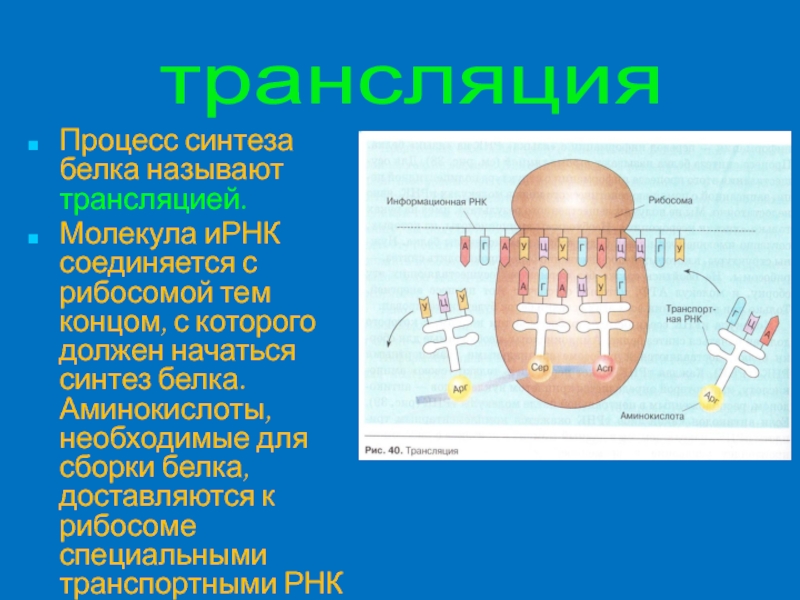 . В этом примере РНК-полимераза будет присоединять гуаниновое основание к цитозину, урацил к аденину, цитозин к гуанину и аденин к тимину с образованием цепи матричной РНК с кодированной азотистой последовательностью оснований G-U-C-A-A-U. Этот процесс повторяется до тех пор, пока фермент RNAP не обнаружит завершающую его последовательность генетического кода — терминатор.
. В этом примере РНК-полимераза будет присоединять гуаниновое основание к цитозину, урацил к аденину, цитозин к гуанину и аденин к тимину с образованием цепи матричной РНК с кодированной азотистой последовательностью оснований G-U-C-A-A-U. Этот процесс повторяется до тех пор, пока фермент RNAP не обнаружит завершающую его последовательность генетического кода — терминатор.
Терминация
Когда RNAP обнаруживают терминаторную последовательность, происходит финальная фаза транскрипции — терминация. Цепочка РНКП отсоединяется от ДНК, и в результате получается цепочка информационной РНК. Эта мРНК несет в себе код, который в конечном итоге укажет тРНК, какие аминокислоты передать рибосоме.
Информационная РНК покидает ядро через ядерные поры в основном за счет диффузии, но иногда требуется помощь ферментов-переносчиков и АТФ, чтобы добраться до места назначения.
Процесс трансляции в синтезе белка
В процессе трансляции малые и большие субъединицы рибосомы замыкаются на цепи мРНК, свободно захватывая ее внутри.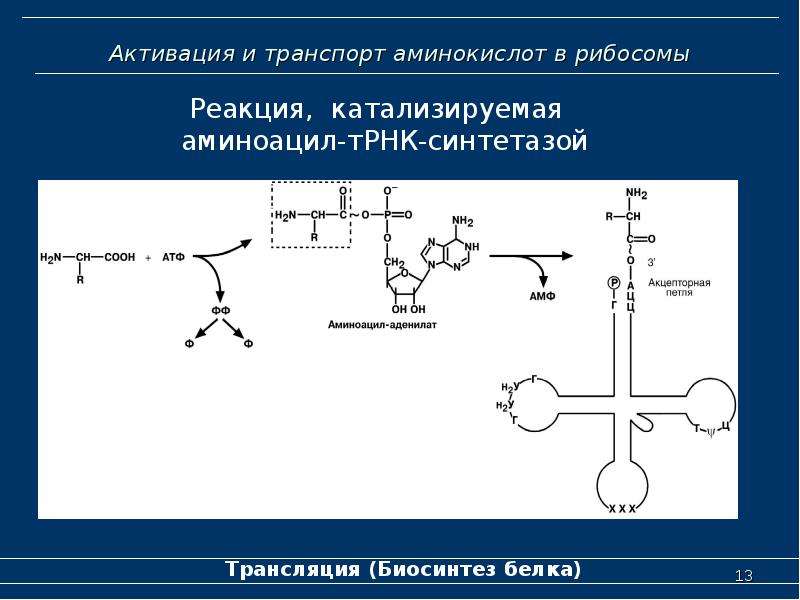 Рибосомы организуют цепь в кодоны или наборы из трех азотистых основных букв. Это связано с тем, что код отдельной аминокислоты — самой основной формы белка — представляет собой трехбуквенный код азотистых оснований.
Рибосомы организуют цепь в кодоны или наборы из трех азотистых основных букв. Это связано с тем, что код отдельной аминокислоты — самой основной формы белка — представляет собой трехбуквенный код азотистых оснований.
Поскольку рибосомы распознают части кода, мы можем сказать, что они его понимают. Беспорядок скопированных букв, созданный на этапе транскрипции, можно прочитать и понять на этапе перевода.
Код можно понять только во время трансляции.Например, код GGU, GGC, GGA и GGG для аминокислоты, известной как глицин. Большинство аминокислот имеют несколько кодов, так как это снижает вероятность ошибок — если РНК-полимераза случайно связывает аденин вместо цитозина с GG, это не имеет значения. И GGC, и GGA кодируют одну и ту же аминокислоту. Вы можете увидеть список кодонов мРНК для двадцати заменимых аминокислот здесь.
Есть только один стартовый кодонный код — AUG. Три кодона — TAA, TAG и TGA — представляют собой стоп-кодоны.Ни стартовый, ни стоп-кодоны не соответствуют коду аминокислоты; они не кодируют. На этом круге кодонов четко обозначены одиночный стартовый и три стоповых кодона.
На этом круге кодонов четко обозначены одиночный стартовый и три стоповых кодона.
Когда кодон становится видимым — после того, как предыдущий кодон был связан с аминокислотой — часть молекулы транспортной РНК помещается в кодон мРНК. Этот «ключ» называется антикодоном. РНК-переносчик выполняет две функции: прикрепляться к аминокислоте за пределами рибосомы и размещать эту аминокислоту в нужное время и в нужном положении на цепи мРНК внутри рибосомы.
От десятков до тысяч молекул транспортной РНК образуются полипептидные цепи. Титин или коннектин — самая большая молекула белка и содержит около 33 000 аминокислот. Самый маленький функциональный полипептид — глутатион — всего три аминокислоты. Чтобы произвести глутатион, сначала рибосома и тРНК должны прочитать стартовый кодон (три основания), затем прочитать первый кодон, кодирующий белок (три основания), второй (три основания), третий (три основания) и стоп-кодон. (три базы). Рецепты (последовательности) кодирующей ДНК и мРНК для глутатиона содержат девять оснований.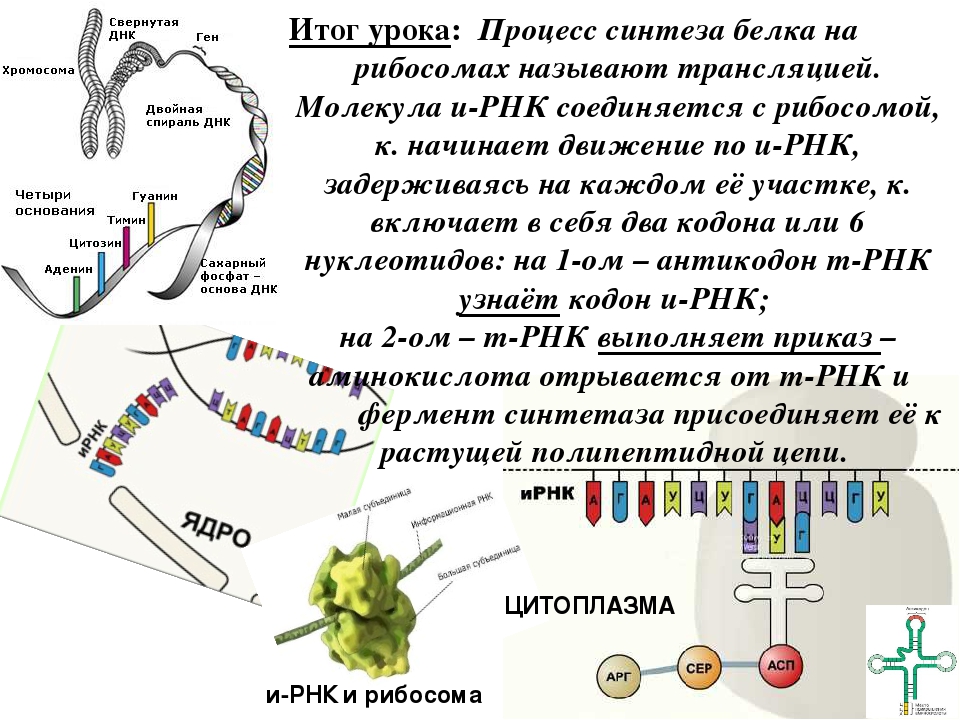 В этом рецепте могут быть или не быть дополнительных участков некодирующей ДНК. Некодирующие последовательности не производят аминокислот.
В этом рецепте могут быть или не быть дополнительных участков некодирующей ДНК. Некодирующие последовательности не производят аминокислот.
Как и в случае с процессом транскрипции, трансляция внутри рибосомы также разделяется на три стадии: инициации, элонгации и терминации.
Пора разобраться в кодеИнициирование включает распознавание рибосомой стартового кодона мРНК. Элонгация относится к процессу, при котором рибосома перемещается по транскрипту мРНК, распознавая и обнажая отдельные кодоны, так что тРНК может доставить нужные аминокислоты.Антикодоновое плечо тРНК прикрепляется к соответствующему кодону мРНК под влиянием рибосомных ферментов.
Наконец, терминация происходит, когда рибосома распознает стоп-кодон мРНК; завершенная полипептидная цепь затем высвобождается в цитоплазму. Он отправляется туда, где это необходимо — внутрь клетки или в другие ткани, покидая клеточную мембрану посредством экзоцитоза.
Многие полипептиды покидают клетку в результате экзоцитозаТест
Библиография
Показать / Скрыть
- Barna M.
 (2013). Рибосомы берут на себя управление. Proceedings of the National Academy of Sciences of the United States of America , 110 (1), 9–10. https://doi.org/10.1073/pnas.1218764110
(2013). Рибосомы берут на себя управление. Proceedings of the National Academy of Sciences of the United States of America , 110 (1), 9–10. https://doi.org/10.1073/pnas.1218764110 - Hatfield DL, Lee JL, Pirtle RM (Ed). (2018). Трансферная РНК в синтезе белков, Бока-Ратон (Флорида), CRC Press.
- Rodwell, VW, Bender DA, Botham KM, Kennelly PJ, Weil PA. (2018). Harper’s Illustrated Biochemistry, тридцать первое издание. Нью-Йорк, McGraw Hill Professional.
- Vargas DY, Raj A, Marras SAE, Kramer FR, Tyagi S.(2005). Механизм транспорта мРНК в ядре. Труды Национальной академии наук . Ноя 2005, 102 (47) 17008-17013; DOI: 10.1073 / pnas.0505580102
6.4: Синтез белков — биология LibreTexts
Центральная догма биологии
Ваша ДНК , или дезоксирибонуклеиновая кислота, содержит гены, которые определяют вас. Как эта органическая молекула может влиять на ваши характеристики? ДНК содержит инструкции для всех белков, которые вырабатывает ваше тело. Белки , в свою очередь, определяют структуру и функции всех ваших клеток. Что определяет структуру белка ? Он начинается с последовательности из аминокислот , составляющих белок. Инструкции по созданию белков с правильной последовательностью аминокислот закодированы в ДНК.
Белки , в свою очередь, определяют структуру и функции всех ваших клеток. Что определяет структуру белка ? Он начинается с последовательности из аминокислот , составляющих белок. Инструкции по созданию белков с правильной последовательностью аминокислот закодированы в ДНК.
обнаружена в хромосомах.В эукариотических клетках хромосомы всегда остаются в ядре, но белки образуются на рибосомах в цитоплазме или на шероховатом эндоплазматическом ретикулуме (RER). Как инструкции в ДНК попадают в место синтеза белка вне ядра? За это отвечает другой тип нуклеиновой кислоты. Эта нуклеиновая кислота представляет собой РНК или рибонуклеиновую кислоту. РНК — это небольшая молекула, которая может протискиваться через поры ядерной мембраны.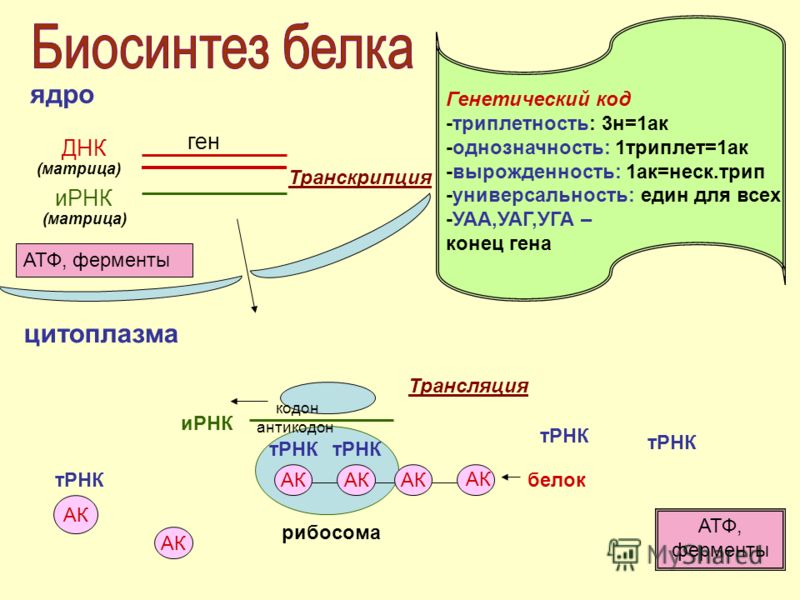 Он передает информацию от ДНК в ядре к рибосоме в цитоплазме, а затем помогает собрать белок.Вкратце:
Он передает информацию от ДНК в ядре к рибосоме в цитоплазме, а затем помогает собрать белок.Вкратце:
ДНК → РНК → Белок
Обнаружение этой последовательности событий стало важной вехой в молекулярной биологии. Это называется центральной догмой биологии . В центральной догме участвуют два процесса: транскрипция и перевод.
Рисунок \ (\ PageIndex {2} \): Обзор транскрипции и перевода (CC BY 4.0; Thomas Shafee через Wikimedia Commons)Транскрипция
Транскрипция — первая часть центральной догмы молекулярной биологии: ДНК → РНК .Это передача генетических инструкций ДНК в мРНК. Транскрипция происходит в ядре клетки. Во время транскрипции создается цепь мРНК, которая комплементарна цепи ДНК, называемой геном. Ген можно легко идентифицировать по последовательности ДНК. Ген содержит три основных участка: промотор, кодирующую последовательность и терминатор. Есть и другие части гена, которые показаны на рисунке \ (\ PageIndex {3} \).
Ген содержит три основных участка: промотор, кодирующую последовательность и терминатор. Есть и другие части гена, которые показаны на рисунке \ (\ PageIndex {3} \).
Шаги транскрипции
Транскрипция происходит в три этапа, называемых инициацией, удлинением и окончанием. Шаги показаны на рисунке ниже.
- Инициация — это начало транскрипции. Это происходит, когда фермент РНК-полимераза связывается с участком гена, который называется промотором . Это дает сигнал ДНК раскручиваться, чтобы фермент мог «читать» основания в одной из цепей ДНК.Фермент готов к созданию цепи мРНК с комплементарной последовательностью оснований. Промотор не является частью полученной мРНК
- Элонгация — это добавление нуклеотидов к цепи мРНК.
- Окончание — это окончание транскрипции.
 Когда РНК-полимераза расшифровывает терминатор, он отделяется от ДНК. После этого шага цепь мРНК завершена.
Рисунок \ (\ PageIndex {4} \): Транскрипция происходит в три этапа — инициирование, удлинение и завершение — показанных здесь.(Общественное достояние; Calibuon через Wikimedia.org)
Когда РНК-полимераза расшифровывает терминатор, он отделяется от ДНК. После этого шага цепь мРНК завершена.
Рисунок \ (\ PageIndex {4} \): Транскрипция происходит в три этапа — инициирование, удлинение и завершение — показанных здесь.(Общественное достояние; Calibuon через Wikimedia.org)
Обработка мРНК
У эукариот новая мРНК еще не готова к трансляции. На этом этапе она называется пре-мРНК и должна пройти дополнительную обработку, прежде чем покинет ядро в виде зрелой мРНК. Обработка может включать добавление 5 ‘крышки, сращивание, редактирование и 3’ хвоста полиаденилирования. Эти процессы по-разному модифицируют мРНК. Такие модификации позволяют использовать один ген для производства более чем одного белка.
- 5′-кэп защищает мРНК в цитоплазме и помогает прикреплять мРНК к рибосоме для трансляции.
- Сплайсинг удаляет интроны из кодирующей белок последовательности мРНК, как показано на схеме ниже. Интроны — это области, которые не кодируют белок.
 Оставшаяся мРНК состоит только из областей, называемых экзонов , которые кодируют белок. Рибонуклеопротеины на диаграмме — это небольшие белки в ядре, которые содержат РНК и необходимы для процесса сплайсинга.
Оставшаяся мРНК состоит только из областей, называемых экзонов , которые кодируют белок. Рибонуклеопротеины на диаграмме — это небольшие белки в ядре, которые содержат РНК и необходимы для процесса сплайсинга. - Редактирование изменяет некоторые нуклеотиды в мРНК. Например, человеческий белок APOB, который помогает транспортировать липиды в крови, имеет две различные формы из-за редактирования. Одна форма меньше другой, потому что редактирование добавляет более ранний стоп-сигнал в мРНК.
- Полиаденилирование добавляет «хвост» к мРНК. Хвост состоит из цепочки As (адениновых оснований). Он сигнализирует об окончании мРНК. Он также участвует в экспорте мРНК из ядра и защищает мРНК от ферментов, которые могут ее разрушить.
Перевод
Перевод является второй частью центральной догмы молекулярной биологии: РНК -> Белок . Это процесс, в котором генетический код мРНК считывается для создания белка. Перевод проиллюстрирован на схемах ниже. После того, как мРНК покидает ядро, она перемещается на рибосому (см. Ниже), которая состоит из рРНК и белков.Трансляция происходит на рибосомах, плавающих в цитозоле, или на рибосомах, прикрепленных к грубому эндоплазматическому ретикулуму. Рибосома считывает последовательность кодонов в мРНК, а молекулы тРНК переносят аминокислоты на рибосому в правильной последовательности. Как и в случае синтеза мРНК, синтез белка можно разделить на три фазы: инициация, удлинение и завершение. Помимо матрицы мРНК и рибосом, многие другие молекулы участвуют в процессе трансляции, такие как тРНК (см. Ниже) и различные ферментативные факторы
Это процесс, в котором генетический код мРНК считывается для создания белка. Перевод проиллюстрирован на схемах ниже. После того, как мРНК покидает ядро, она перемещается на рибосому (см. Ниже), которая состоит из рРНК и белков.Трансляция происходит на рибосомах, плавающих в цитозоле, или на рибосомах, прикрепленных к грубому эндоплазматическому ретикулуму. Рибосома считывает последовательность кодонов в мРНК, а молекулы тРНК переносят аминокислоты на рибосому в правильной последовательности. Как и в случае синтеза мРНК, синтез белка можно разделить на три фазы: инициация, удлинение и завершение. Помимо матрицы мРНК и рибосом, многие другие молекулы участвуют в процессе трансляции, такие как тРНК (см. Ниже) и различные ферментативные факторы
Чтобы понять роль тРНК, вам нужно больше узнать о ее структуре.Каждая молекула тРНК имеет антикодон для содержащейся в ней аминокислоты. Антикодон комплементарен кодону аминокислоты. Например, аминокислота лизин имеет кодон AAG, поэтому антикодоном является UUC. Следовательно, лизин будет переноситься молекулой тРНК с антикодоном UUC. Где бы ни появлялся кодон AAG в мРНК, временно связывается антикодон UUC тРНК. Будучи связанной с мРНК, тРНК отдает свою аминокислоту. С помощью рРНК между аминокислотами образуются связи, по мере того как они одна за другой переносятся на рибосому, образуя полипептидную цепь.Цепочка аминокислот продолжает расти, пока не будет достигнут стоп-кодон.
Следовательно, лизин будет переноситься молекулой тРНК с антикодоном UUC. Где бы ни появлялся кодон AAG в мРНК, временно связывается антикодон UUC тРНК. Будучи связанной с мРНК, тРНК отдает свою аминокислоту. С помощью рРНК между аминокислотами образуются связи, по мере того как они одна за другой переносятся на рибосому, образуя полипептидную цепь.Цепочка аминокислот продолжает расти, пока не будет достигнут стоп-кодон.
Рибосомы (см. Выше), которые только что состоят из рРНК (рибосомной РНК) и белка, были классифицированы как рибозимы, потому что рРНК обладает ферментативной активностью. РРНК важна для активности пептидилтрансферазы, связывающей аминокислоты. Рибосомы состоят из двух субъединиц — рРНК и белка. Большая субъединица имеет три активных сайта, называемых сайтами E, P и A. Эти сайты важны для каталитической активности рибосом.
Так же, как и синтез мРНК, синтез белка можно разделить на три фазы: инициация, элонгация и терминация. Помимо матрицы мРНК, в процесс трансляции вносят вклад многие другие молекулы, такие как рибосомы, тРНК и различные ферментные факторы
Инициирование трансляции: Маленькая субъединица связывается с сайтом выше (на 5′-стороне) начала мРНК.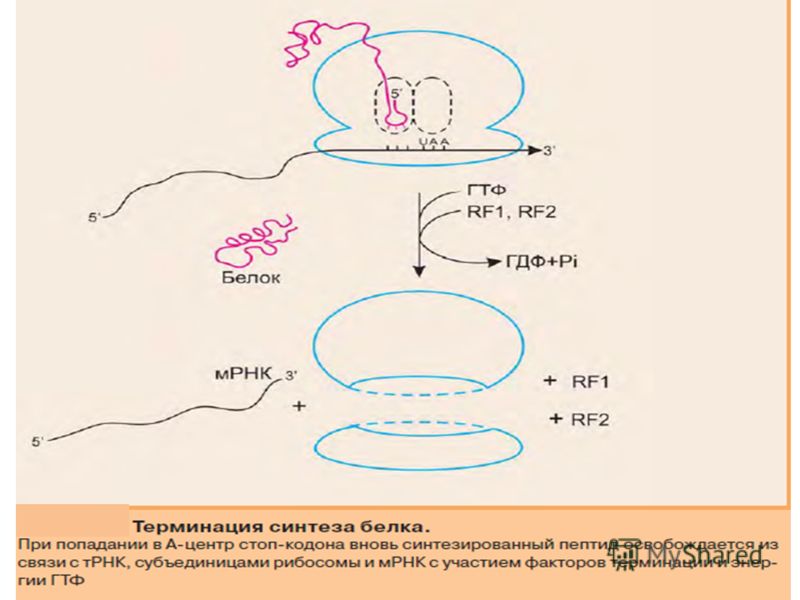 Он продолжает сканировать мРНК в направлении 5 ‘-> 3’, пока не встретит кодон START (AUG).Прикрепляется большая субъединица, и тРНК инициатора, несущая метионин (Met), связывается с сайтом P на рибосоме.
Он продолжает сканировать мРНК в направлении 5 ‘-> 3’, пока не встретит кодон START (AUG).Прикрепляется большая субъединица, и тРНК инициатора, несущая метионин (Met), связывается с сайтом P на рибосоме.
Удлинение трансляции: Рибосома сдвигает один кодон за раз, катализируя каждый процесс, который происходит в трех сайтах. На каждом этапе заряженная тРНК входит в комплекс, полипептид становится на одну аминокислоту длиннее, а незаряженная тРНК уходит. Энергия каждой связи между аминокислотами происходит от GTP, молекулы, подобной АТФ (рисунок).Вкратце, рибосомы взаимодействуют с другими молекулами РНК, образуя цепи аминокислот, называемые полипептидными цепями, из-за пептидной связи, которая образуется между отдельными аминокислотами. Внутри рибосомы в процессе трансляции участвуют три сайта: A, P и E. Удивительно, но аппарату трансляции E. coli требуется всего 0,05 секунды для добавления каждой аминокислоты, а это означает, что полипептид из 200 аминокислот может быть транслирован всего за 10 секунд.
Прекращение трансляции : Прекращение трансляции происходит при обнаружении стоп-кодона (UAA, UAG или UGA).Когда рибосома встречает стоп-кодон, растущий полипептид высвобождается с помощью различных рилизинг-факторов (см. Рисунок ниже), а субъединицы рибосомы диссоциируют и покидают мРНК. После того, как многие рибосомы завершили трансляцию, мРНК деградирует, поэтому нуклеотиды можно повторно использовать в другой реакции транскрипции.
требований к переводу | Биология для неосновных I
Результаты обучения
- Опишите компоненты, необходимые для перевода
Рисунок 1.Пептидная связь связывает карбоксильный конец одной аминокислоты с амино-концом другой, вытесняя одну молекулу воды. Для простоты на этом изображении показаны только функциональные группы, участвующие в пептидной связи. Обозначения R и R ‘относятся к остальной части каждой аминокислотной структуры.
Процесс трансляции или синтеза белка включает декодирование сообщения мРНК в полипептидный продукт. Аминокислоты ковалентно связаны между собой пептидными связями. Каждая отдельная аминокислота имеет аминогруппу (NH 2 ) и карбоксильную (COOH) группу.Полипептиды образуются, когда аминогруппа одной аминокислоты образует амидную (т.е. пептидную) связь с карбоксильной группой другой аминокислоты (рис. 1).
Аминокислоты ковалентно связаны между собой пептидными связями. Каждая отдельная аминокислота имеет аминогруппу (NH 2 ) и карбоксильную (COOH) группу.Полипептиды образуются, когда аминогруппа одной аминокислоты образует амидную (т.е. пептидную) связь с карбоксильной группой другой аминокислоты (рис. 1).
Эта реакция катализируется рибосомами и генерирует одну молекулу воды.
Оборудование для синтеза белка
Помимо матрицы мРНК, многие молекулы и макромолекулы участвуют в процессе трансляции. Трансляция требует ввода шаблона мРНК , рибосом , тРНК и различных ферментативных факторов.
Просмотрите этапы этого интерактивного PBS, чтобы увидеть синтез белка в действии.Рибосомы
Рибосома — это сложная макромолекула, состоящая из структурных и каталитических рРНК и множества различных полипептидов. Рибосомы существуют в цитоплазме прокариот и в цитоплазме и шероховатом эндоплазматическом ретикулуме у эукариот. Рибосомы состоят из двух субъединиц. В E. coli малая субъединица описывается как 30S, а большая субъединица — как 50S, всего 70S.Рибосомы млекопитающих имеют небольшую субъединицу 40S и большую субъединицу 60S, всего 80S. Малая субъединица отвечает за связывание матрицы мРНК, тогда как большая субъединица последовательно связывает тРНК.
Рибосомы состоят из двух субъединиц. В E. coli малая субъединица описывается как 30S, а большая субъединица — как 50S, всего 70S.Рибосомы млекопитающих имеют небольшую субъединицу 40S и большую субъединицу 60S, всего 80S. Малая субъединица отвечает за связывание матрицы мРНК, тогда как большая субъединица последовательно связывает тРНК.
тРНК
ТРНК представляют собой структурные молекулы РНК, которые были транскрибированы из генов с помощью РНК-полимеразы III. Выступая в качестве адаптеров, специфические тРНК связываются с последовательностями на матрице мРНК и добавляют соответствующую аминокислоту к полипептидной цепи. Следовательно, тРНК — это молекулы, которые фактически «переводят» язык РНК на язык белков.
Рисунок 2. ТРНК фенилаланина
Из 64 возможных кодонов мРНК — или триплетных комбинаций A, U, G и C — три определяют завершение синтеза белка, а 61 указывают добавление аминокислот к полипептидной цепи. Из них 61 один кодон (AUG), также известный как «стартовый кодон», кодирует начало трансляции. Каждый антикодон тРНК может образовывать пару оснований с одним из кодонов мРНК и добавлять аминокислоту или завершать трансляцию в соответствии с генетическим кодом. Например, если последовательность CUA встречается на матрице мРНК в надлежащей рамке считывания, она будет связывать тРНК, экспрессирующую комплементарную последовательность GAU, которая будет связана с аминокислотой лейцином.
Каждый антикодон тРНК может образовывать пару оснований с одним из кодонов мРНК и добавлять аминокислоту или завершать трансляцию в соответствии с генетическим кодом. Например, если последовательность CUA встречается на матрице мРНК в надлежащей рамке считывания, она будет связывать тРНК, экспрессирующую комплементарную последовательность GAU, которая будет связана с аминокислотой лейцином.
принимают трехмерную структуру за счет внутримолекулярных водородных связей, чтобы позиционировать сайт связывания аминокислоты на одном конце и антикодон на другом конце (рисунок 2). Антикодон представляет собой трехнуклеотидную последовательность в тРНК, которая взаимодействует с кодоном мРНК посредством комплементарного спаривания оснований.
тРНК должны взаимодействовать с тремя факторами:
- Они должны распознаваться правильной аминоацилсинтетазой.
- Они должны распознаваться рибосомами.
- Они должны связываться с правильной последовательностью в мРНК.

Аминоацил тРНК-синтетазы
В процессе «зарядки» тРНК каждая молекула тРНК связана со своей правильной аминокислотой с помощью группы ферментов, называемых аминоацил тРНК синтетаз. По крайней мере, один тип аминоацил тРНК синтетазы существует для каждой из 20 аминокислот.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Нужны ли углеводы для дальнейшего стимулирования синтеза / гипертрофии мышечного белка после упражнений с отягощениями? | Журнал Международного общества спортивного питания
За последнее десятилетие был достигнут значительный прогресс в раскрытии механизмов, регулирующих сложные пути, которые связывают экспрессию генов с синтезом белка.В результате этих исследований было выявлено влияние аминокислот, в основном лейцина, на синтез белка. Лейцин, помимо того, что является необходимой аминокислотой в синтезе белка, также усиливает активность ключевых киназ, регулирующих инициацию трансляции.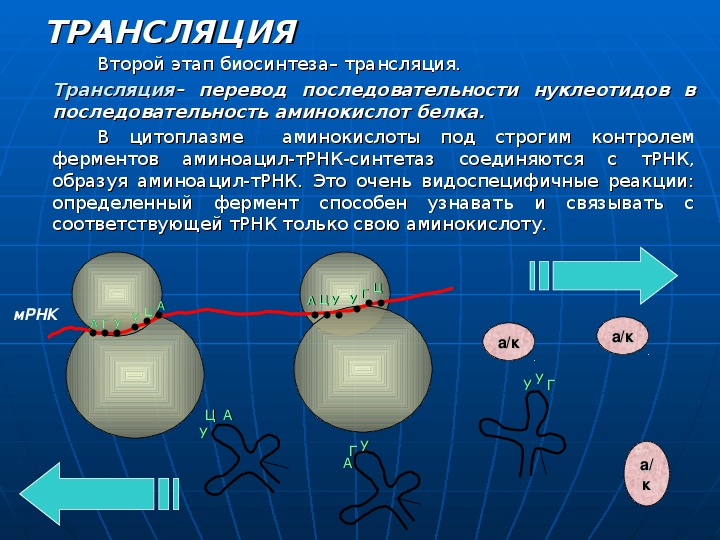 Лейцин — далеко не единственный фактор, определяющий синтез белка, но вместе с тем, энергетический статус, механочувствительные, ионные и гормональные медиаторы сходятся, чтобы определять скорость синтеза белка. Инсулин также играет важную роль в синтезе белка, являясь мощным стимулятором оси PI-3K / Akt / mTOR, связывая рост с доступностью питательных веществ.
Лейцин — далеко не единственный фактор, определяющий синтез белка, но вместе с тем, энергетический статус, механочувствительные, ионные и гормональные медиаторы сходятся, чтобы определять скорость синтеза белка. Инсулин также играет важную роль в синтезе белка, являясь мощным стимулятором оси PI-3K / Akt / mTOR, связывая рост с доступностью питательных веществ.
В недавнем обзоре Stark et al. [1], опубликованном в журнале Международного общества спортивного питания , было указано, что быстродействующие углеводы (например, глюкоза или мальтодекстрин) следует потреблять вместе с белками после упражнений с отягощениями, чтобы способствовать гипертрофии мышц. Две основные причины, приведенные в пользу необходимости добавления углеводов к еде / добавкам после тренировки: 1) резко проявляется синергетический эффект инсулина и лейцина на синтез белка; и, 2) хронически добавление углеводов к протеиновым добавкам увеличивало бы безжировую массу тела (LBM) в большей степени, чем при потреблении только протеина.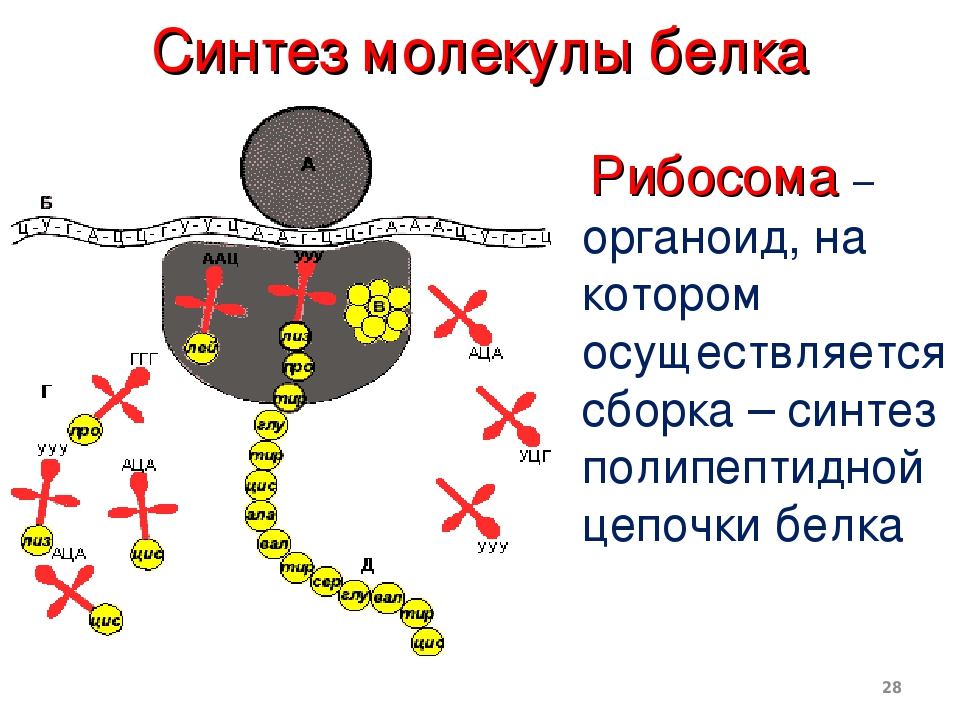 Эти предположения требуют тщательного анализа, учитывая почти полное отсутствие клинических данных и сделанные неподтвержденные утверждения.
Эти предположения требуют тщательного анализа, учитывая почти полное отсутствие клинических данных и сделанные неподтвержденные утверждения.
Требуется ли лейцин инсулин для стимуляции синтеза белка?
С физиологической точки зрения уместно утверждать, что «лейцин не может столь же эффективно модулировать синтез белка без присутствия инсулина», как это было у Stark et al. [1] утверждал. Однако приведенные подтверждающие данные [2, 3] являются моделями клеточных культур in vitro, где можно полностью исключить инсулин из условий лечения.Таким образом, результаты исследований клеточных культур не обязательно могут быть перенесены в условия in vivo без учета различий. В одном из этих исследований клетки лишали сыворотки в течение ночи (12+ часов) до стимуляции инсулином [2]. В обоих исследованиях [2, 3] сравнивали клетки, обработанные инсулином, с необработанными клетками. Это контрастирует с физиологическим состоянием, при котором даже краткосрочные (ночные) голодания имеют низкие, но измеримые уровни циркулирующего инсулина (~ 5 мЕд / л).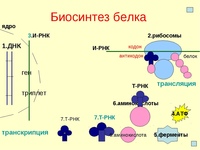 На этих низких уровнях синтез белка может быть вызван аминокислотами [4]. Что еще более важно, повышение уровня инсулина более чем в 30 раз по сравнению с уровнем натощак не оказывает дальнейшего влияния на синтез белка, даже если аминоацидемия сохраняется на высоком уровне [4]. Таким образом, технически верно, что инсулин необходим для увеличения синтеза белка при увеличении доставки аминокислот, однако даже очень низкие уровни инсулина способны действовать совместно с лейцином, обеспечивая синтез белка. Более того, следует отметить, что прием лейцина имеет способность стимулировать секрецию инсулина [5, 6] и что большинство исследований белковых добавок сообщают о заметном повышении концентрации циркулирующего инсулина, как минимум в 2–3 раза превышающих значения натощак [7 , 8].
На этих низких уровнях синтез белка может быть вызван аминокислотами [4]. Что еще более важно, повышение уровня инсулина более чем в 30 раз по сравнению с уровнем натощак не оказывает дальнейшего влияния на синтез белка, даже если аминоацидемия сохраняется на высоком уровне [4]. Таким образом, технически верно, что инсулин необходим для увеличения синтеза белка при увеличении доставки аминокислот, однако даже очень низкие уровни инсулина способны действовать совместно с лейцином, обеспечивая синтез белка. Более того, следует отметить, что прием лейцина имеет способность стимулировать секрецию инсулина [5, 6] и что большинство исследований белковых добавок сообщают о заметном повышении концентрации циркулирующего инсулина, как минимум в 2–3 раза превышающих значения натощак [7 , 8].
Инсулин препятствует распаду белка?
Учитывая, что при физиологических концентрациях повышенный уровень инсулина вряд ли приведет к увеличению синтеза белка in vivo , также необходимо рассмотреть, применимо ли это также к деградации белка. Действительно, Børsheim et al. [9] продемонстрировали, что добавление только углеводов (100 г) после упражнений с отягощениями способно улучшить баланс чистого мышечного белка за счет снижения скорости разложения белка, а не за счет увеличения синтеза белка.Однако результирующего небольшого увеличения инсулинемии из-за приема только белка также достаточно, чтобы подавить повышенное расщепление белка, измеренное после упражнений с отягощениями [10].
Действительно, Børsheim et al. [9] продемонстрировали, что добавление только углеводов (100 г) после упражнений с отягощениями способно улучшить баланс чистого мышечного белка за счет снижения скорости разложения белка, а не за счет увеличения синтеза белка.Однако результирующего небольшого увеличения инсулинемии из-за приема только белка также достаточно, чтобы подавить повышенное расщепление белка, измеренное после упражнений с отягощениями [10].
Отсутствие клинических данных по приросту мышечной массы
Далее было указано Stark et al. [1], что «(…) исследования с использованием источников белка с источником углеводов имели тенденцию увеличивать LBM больше, чем только источник белка» (цитируется здесь как ссылки 11, 12, 13, 14, 15, 16). Это не может адекватно отразить данные в упомянутых исследованиях.В большинстве этих исследований сравнивали одновременный прием белка и углеводов с одним только углеводом [11, 12] или с другим источником белка при сохранении аналогичного количества углеводов [13-15]. Более того, последнее процитированное исследование [16] анализировало влияние времени приема добавок, а не их состава. На сегодняшний день нет клинических исследований, сравнивающих влияние одновременного приема углеводно-белковой добавки с простой белковой добавкой на LBM. Интересно, что Wilkinson et al.[14] и Hartman et al. [13] сравнили разные источники белка (молоко и соя), которые также содержали заметные уровни углеводов. Оба напитка имели одинаковое количество углеводов, но гликемический индекс (GI) отличался: группа сои содержала мальтродекстрин, а группа молока — лактозу (как и ожидалось). И все же именно добавка с низким ГИ (молоко) дала наибольший чистый прирост безжировой массы [13] и более высокую скорость фракционного синтеза [14]. По крайней мере, в этих исследованиях GI не имел положительной связи с увеличением мышечной массы.
Более того, последнее процитированное исследование [16] анализировало влияние времени приема добавок, а не их состава. На сегодняшний день нет клинических исследований, сравнивающих влияние одновременного приема углеводно-белковой добавки с простой белковой добавкой на LBM. Интересно, что Wilkinson et al.[14] и Hartman et al. [13] сравнили разные источники белка (молоко и соя), которые также содержали заметные уровни углеводов. Оба напитка имели одинаковое количество углеводов, но гликемический индекс (GI) отличался: группа сои содержала мальтродекстрин, а группа молока — лактозу (как и ожидалось). И все же именно добавка с низким ГИ (молоко) дала наибольший чистый прирост безжировой массы [13] и более высокую скорость фракционного синтеза [14]. По крайней мере, в этих исследованиях GI не имел положительной связи с увеличением мышечной массы.
На сегодняшний день только три исследования [10, 17, 18] изучали влияние комбинации углеводов с белками / аминокислотами по сравнению с белками / аминокислотами только на острый синтез белка у молодых людей.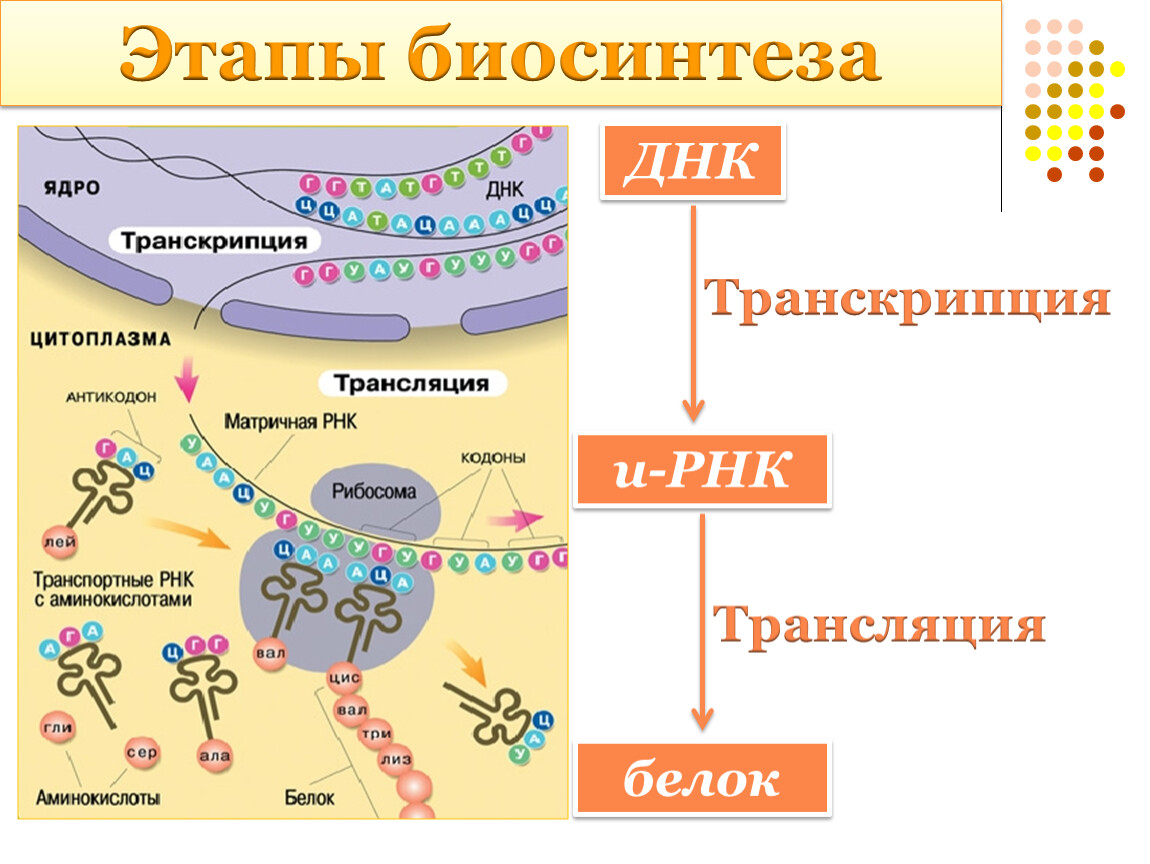 Эти исследования показывают, что добавление углеводов к дозе протеина, которая, как известно, максимально стимулирует синтез протеина (20-25 г высококачественного протеина, богатого лейцином), не оказывает дополнительного или синергетического эффекта на синтез и распад мышечного протеина. Тот же результат недавно был продемонстрирован и у пожилых людей [19].В соответствии с этими данными, добавление 30 или 90 г углеводов к 20 г незаменимых аминокислот оказывает одинаковый эффект на синтез и расщепление белков, несмотря на большую разницу в инсулинемии в обеих группах [20]. Инсулин, кажется, еще больше увеличивает синтез белка в фармакологических дозах [21], что означает, что это недостижимо с помощью углеводных добавок.
Эти исследования показывают, что добавление углеводов к дозе протеина, которая, как известно, максимально стимулирует синтез протеина (20-25 г высококачественного протеина, богатого лейцином), не оказывает дополнительного или синергетического эффекта на синтез и распад мышечного протеина. Тот же результат недавно был продемонстрирован и у пожилых людей [19].В соответствии с этими данными, добавление 30 или 90 г углеводов к 20 г незаменимых аминокислот оказывает одинаковый эффект на синтез и расщепление белков, несмотря на большую разницу в инсулинемии в обеих группах [20]. Инсулин, кажется, еще больше увеличивает синтез белка в фармакологических дозах [21], что означает, что это недостижимо с помощью углеводных добавок.
Остались веские причины для включения углеводов в белковые добавки, которые следует употреблять после упражнений с отягощениями.Они включали максимальное восстановление гликогена, особенно когда период времени между тренировками короткий [22]. Однако, основываясь на доступных клинических данных, нет никаких доказательств того, что добавление углеводов к протеиновой добавке резко увеличивает синтез мышечного протеина и, в хроническом порядке, LBM в большей степени, чем один протеин, что противоречит утверждениям. Старка и его коллег [1].
Старка и его коллег [1].
Белковая фабрика
Август в нашем календаре PDBe на 2020 год вдохновлен механизмами клеточного производства белка, называемыми рибосомами.Рибосомы — это очень сложные и важные структуры в клетке, которые выполняют жизненно важную роль в синтезе белка.
Белковая фабрика клетки
Каждая клетка нашего тела содержит около 10 миллиардов белков, которые позволяют нам думать, двигаться, есть, играть и делать многое другое. Их эффективное создание — работа этих макромолекулярных машин, называемых рибосомами, которые обнаружены во всех живых клетках всех видов, от бактерий до людей.
Структура рибосомного комплекса
Глядя на рибосому, кажется, что это запутанная смесь белков и молекул РНК, однако на самом деле она сшита вместе с безупречной точностью.
Две субъединицы рибосомы, собранные вместе с малой и большой субъединицами, показанными как ленты серого и бирюзового цветов соответственно (запись PDB 6KE0)
Крио-электронная микроскопия и рентгеновская кристаллография показали, что рибосома состоит из двух субъединиц: малой и большой субъединиц. Каждая из этих субъединиц образует сложную сеть из нескольких молекул РНК с десятками различных белков. В 2000 году структурные биологи Венкатраман Рамакришнан, Томас А. Стейтц и Ада Э.Йонат разрешил первые кристаллические структуры рибосомы с атомным разрешением. В 2009 году этим трем исследователям была присуждена Нобелевская премия по химии за их исследования структуры и функции рибосомы, что свидетельствует о важности рибосомы.
Каждая из этих субъединиц образует сложную сеть из нескольких молекул РНК с десятками различных белков. В 2000 году структурные биологи Венкатраман Рамакришнан, Томас А. Стейтц и Ада Э.Йонат разрешил первые кристаллические структуры рибосомы с атомным разрешением. В 2009 году этим трем исследователям была присуждена Нобелевская премия по химии за их исследования структуры и функции рибосомы, что свидетельствует о важности рибосомы.
Синтез белка
Синтез новых белков начинается в ядре, где рибосомы получают команду начать процесс. Участки ДНК (гены), кодирующие определенный белок, копируются на нити информационной РНК (мРНК) в процессе, называемом транскрипцией.
После завершения транскрипции ДНК в мРНК следующим процессом является трансляция, при которой эти мРНК считываются для образования белков. Каждая мРНК определяет порядок, в котором аминокислоты должны быть добавлены к белковой цепи по мере ее синтеза. Если ДНК является планом, то рибосомы являются масонами — они строят белок, используя аминокислоты в качестве «кирпичиков».
Для создания белков две рибосомные субъединицы, маленькая и большая, собираются вместе, образуя полную рибосому.Он имеет сайты связывания для молекул мРНК и транспортной РНК (тРНК). Большая субъединица находится поверх маленькой субъединицы, а матрица мРНК расположена между ними. После полной сборки рибосома начинает процесс производства белка.
Производство белка
Двигаясь вдоль мРНК, рибосома считывает набор трехнуклеотидных последовательностей на мРНК, называемых кодоном, который кодирует определенную аминокислоту. ТРНК доставляет эти аминокислоты, строительные блоки белка, к рибосоме.Каждая молекула тРНК имеет два разных конца или сайта, один для связывания с определенной аминокислотой, а другой для связывания с соответствующим кодоном мРНК. Во время трансляции эти тРНК переносят аминокислоты на рибосому и присоединяются к своим комплементарным кодонам на мРНК. Впоследствии они переводятся в правильные аминокислоты в новой белковой цепи.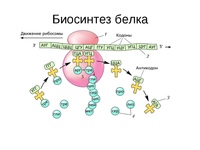
Собранные аминокислоты сшиваются вместе с помощью молекул рРНК (рибосомной РНК), которые направляют процесс создания новой белковой цепи.Повторяя этот процесс для каждой аминокислоты, весь белок строится в процессе, называемом удлинением. Растущая белковая цепь останавливается только тогда, когда она встречает стоп-кодон на мРНК. Это сигнализирует о конце полипептидной цепи во время трансляции. Как только аминокислоты сформированы правильно, вновь синтезированная белковая цепь транспортируется либо в цитоплазму, либо в аппарат Гольджи у прокариот или эукариот соответственно.
Ниже приведено видео с сайта YourGenome, объясняющее этот процесс.
Больше, чем протеиновый завод
Точный и быстрый перевод генетической информации критически важен для производства функциональных белков, обеспечивающих жизнеспособность клеток.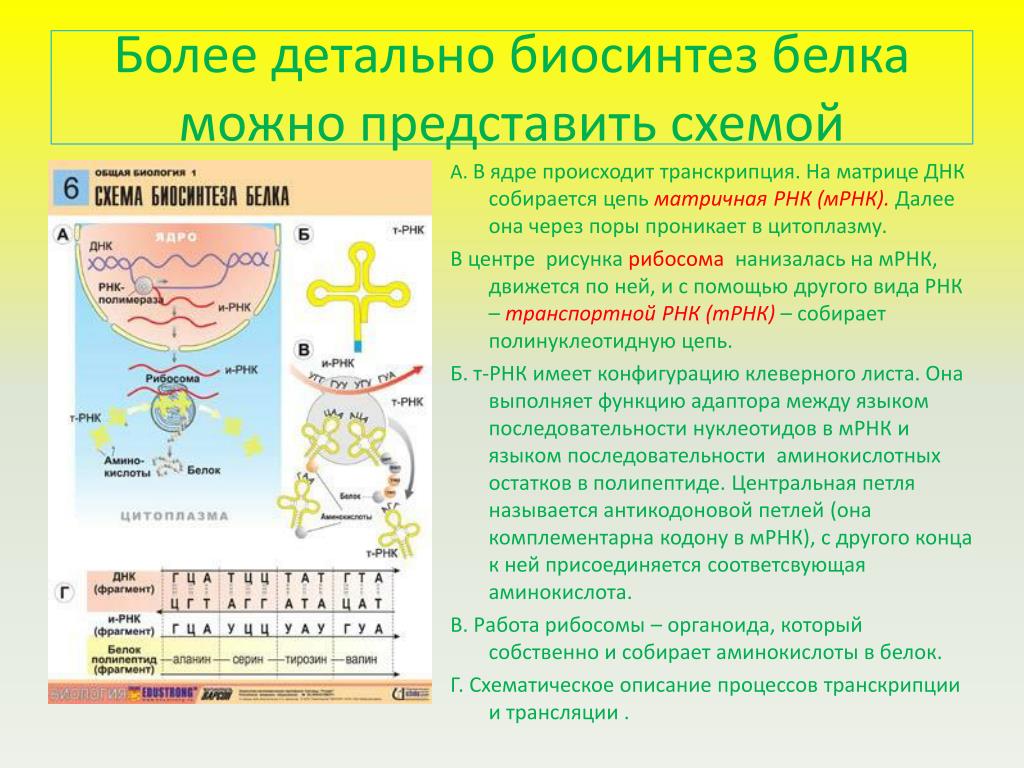 Скорость производства белка должна быть быстрой и очень точной, чтобы своевременно реагировать на изменения в окружающей среде. Поразительная точность рибосомного оборудования имеет коэффициент ошибки 1 на 1000–10 000 аминокислот. Одна рибосома в эукариотической клетке может добавлять 2 аминокислоты к белковой цепи каждую секунду, однако у прокариот рибосомы могут работать даже быстрее, добавляя около 20 аминокислот к полипептиду каждую секунду. Рибосомы потребляют большое количество энергии для синтеза белков и составляют значительную часть клеточной массы, при этом значительная часть метаболизма клетки направляется на производство рибосомных белков и РНК.
Скорость производства белка должна быть быстрой и очень точной, чтобы своевременно реагировать на изменения в окружающей среде. Поразительная точность рибосомного оборудования имеет коэффициент ошибки 1 на 1000–10 000 аминокислот. Одна рибосома в эукариотической клетке может добавлять 2 аминокислоты к белковой цепи каждую секунду, однако у прокариот рибосомы могут работать даже быстрее, добавляя около 20 аминокислот к полипептиду каждую секунду. Рибосомы потребляют большое количество энергии для синтеза белков и составляют значительную часть клеточной массы, при этом значительная часть метаболизма клетки направляется на производство рибосомных белков и РНК.
Нацелены на бактериальные рибосомы
Рибосомы встречаются во всех формах жизни и необходимы для синтеза белка, что делает их желательной мишенью для лекарств. Большинство клинически используемых антибиотиков нацелены на рибосомы и ингибируют процесс синтеза белка, вмешиваясь в трансляцию мРНК или блокируя образование пептидных связей.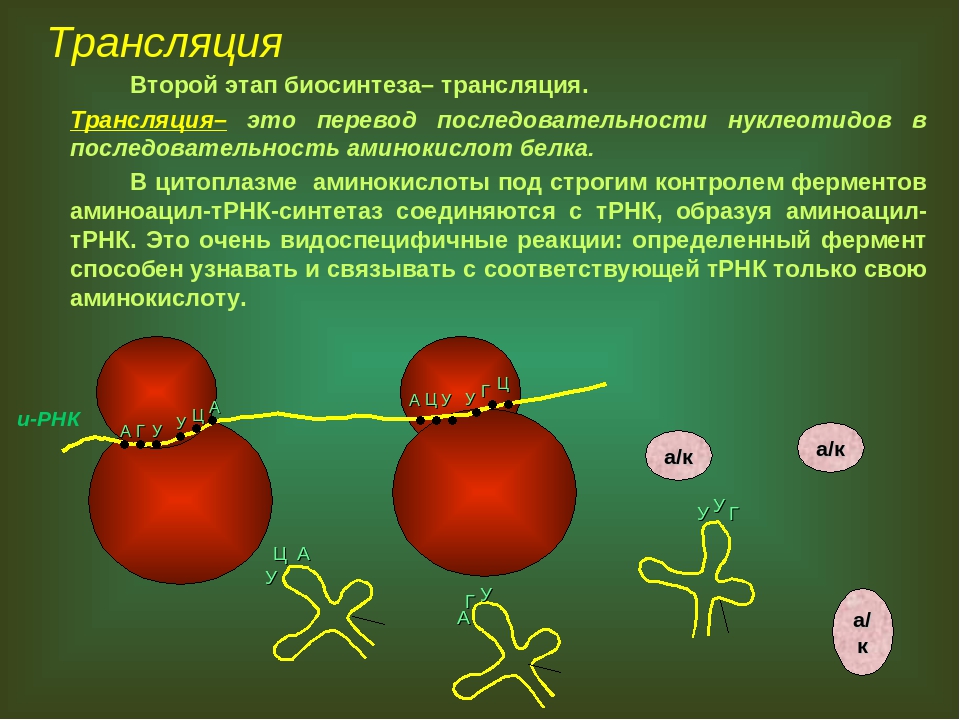
Бактериальные рибосомы — одна из основных мишеней для антибиотиков. Эти антибиотики не дают бактериям синтезировать собственные белки из-за ингибирования их рибосомы, которая в конечном итоге убивает бактерии.Разработка таких антибиотиков стала возможной из-за различий между бактериальными и эукариотическими рибосомами. Они различаются не только по размеру, но и по последовательности и структуре, что позволяет антибиотикам убивать только бактерии, ингибируя их рибосомы, не затрагивая человеческие рибосомы.
В PDB доступны структуры многих антибиотиков в комплексе с рибосомами. Эти структуры с разрешением на атомарном уровне позволяют нам лучше понять механизм их действия.
Антибиотики, спасающие жизнь
Антибиотики, такие как неомицин, гентамицин и стрептомицин, относятся к группе аминогликозидов, которые широко используются для лечения тяжелых инфекций брюшной полости и мочевыводящих путей. Они ингибируют малую субъединицу рибосомы, включая тетрациклины, которые блокируют связывание тРНК.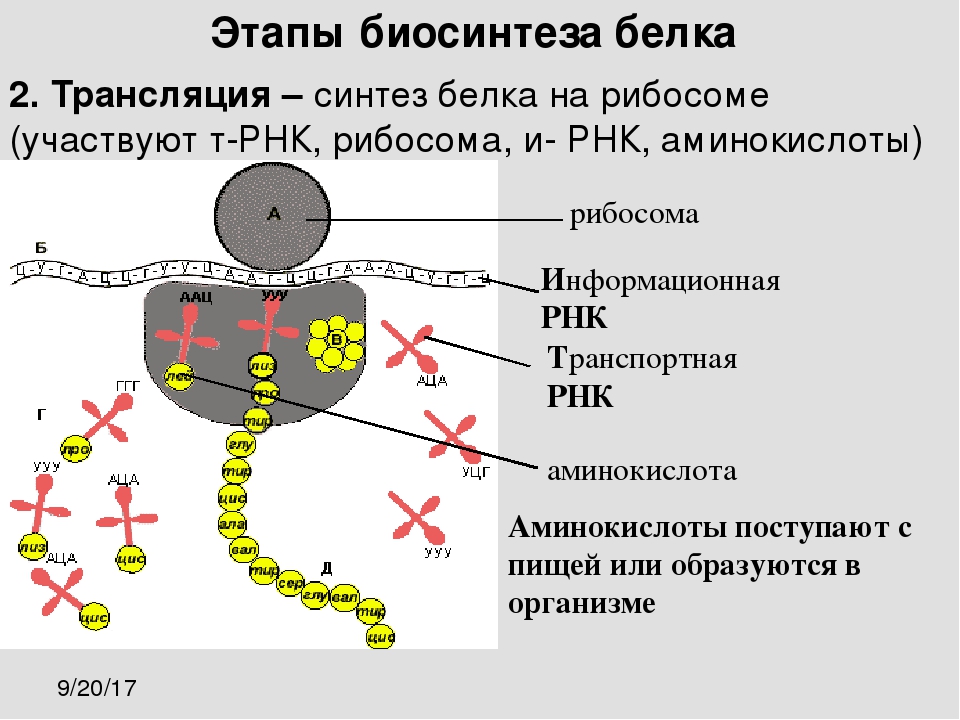
Другой широко назначаемый антибиотик, эритромицин, относится к классу натуральных продуктов. Он оказывает два эффекта на трансляцию: во-первых, предотвращая удлинение полипептидной цепи, а во-вторых, ингибируя образование большой рибосомной субъединицы.
На рисунке ниже показан ряд антибиотиков, которые нацелены на бактериальную рибосому в разных участках большой (голубовато-серый) и малой (желтый) субъединицы рибосомы.
Это изображение взято из статьи «Бактериальная рибосома как мишень для антибиотиков». Nat Rev Microbiol 3, 870–881 (2005). https://doi.org/10.1038/nrmicro1265
Ингибирование рибосомы эукариот
Некоторые антибиотики, такие как генетицин, также называемый G418, ингибируют стадию элонгации как в прокариотических, так и в эукариотических рибосомах.Рицин, лектин (белок, связывающий углеводы), вырабатываемый семенами клещевины, является очень сильнодействующим токсином. Всего несколько крупинок очищенного порошка рицина могут убить взрослого человека. Он подавляет удлинение путем ферментативной модификации рРНК большой рибосомной субъединицы эукариот. Другим известным ингибитором трансляции эукариот является циклогексимид, который обычно используется в лабораториях для подавления синтеза белка.
Всего несколько крупинок очищенного порошка рицина могут убить взрослого человека. Он подавляет удлинение путем ферментативной модификации рРНК большой рибосомной субъединицы эукариот. Другим известным ингибитором трансляции эукариот является циклогексимид, который обычно используется в лабораториях для подавления синтеза белка.
Противораковые препараты
Биогенез рибосом, процесс создания рибосом, недавно стал эффективной мишенью в терапии рака.Несколько соединений, ингибирующих продукцию или функцию рибосом, предпочтительно убивающих раковые клетки, прошли клинические испытания. Недавние исследования показывают, что клетки экспрессируют гетерогенные популяции рибосом и что состав рибосом может играть ключевую роль в онкогенезе, открывая новые терапевтические возможности.
Об образе
Два произведения искусства, керамическая скульптура (слева) и кусок шелкового батика (справа), были созданы Шином Галаутом и Мари Бишофс, 13-летними учениками Школы Персе и Колледжа Импингтон Вилладж, соответственно.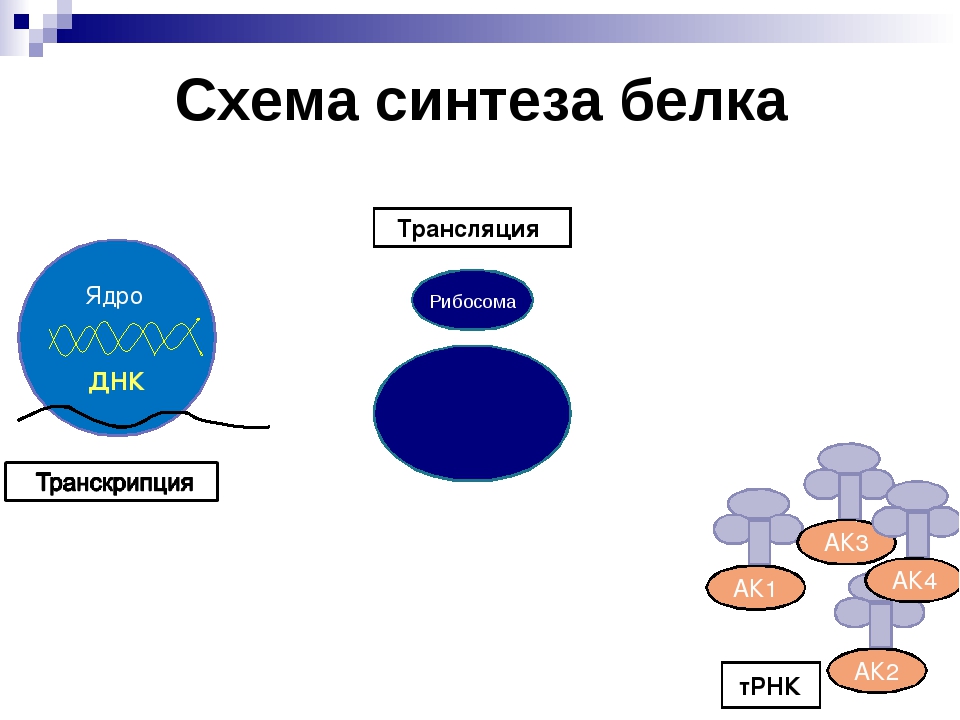 Оба художника черпали вдохновение из комплексов белков и нуклеиновых кислот в базе данных PDB, а их работы основывались на процессе синтеза белка и рибосомах.
Оба художника черпали вдохновение из комплексов белков и нуклеиновых кислот в базе данных PDB, а их работы основывались на процессе синтеза белка и рибосомах.
Дипти Гупта
Синтез белка
Примечание : Теперь мы знаем, что, хотя транскрибируется 80% генома человека, только 1% кодирует белки. Если да, то что делает остальная транскрибированная РНК? Мы знаем, что, хотя каждая клетка содержит полную копию ДНК человека, одни и те же последовательности ДНК не экспрессируются в каждой клетке.Клетки сердца отличаются от клеток печени, которые отличаются от клеток мозга и клеток почек. Мы считаем, что РНК участвует в регуляции экспрессии ДНК. Если РНК определяет, какие последовательности ДНК экспрессируются, и устанавливает время и продолжительность экспрессии гена, это может помочь объяснить, почему каждый вид клетки выполняет определенную работу, несмотря на то, что все они содержат полную последовательность ДНК. Исследования стволовых клеток, которые способны дифференцироваться в любые клетки организма, открывают большие перспективы для будущего лечения множества генетических заболеваний, включая рак.
| неполярный | полярный | базовый | кислая | (стоп-кодон) |
3. От аминокислоты к белку : после того, как каждая новая аминокислота выходит с конвейера, она присоединяется к концу растущей пептидной цепи. Помните, что хотя базовая единица каждой аминокислоты идентична, присоединенная группа R придает каждой аминокислоте уникальные физические свойства.Хороший способ представить это — представить цепочку, состоящую из бусинок разных типов.
Вот анимация, которая показывает, как работает весь процесс. Трехмерная структура : Представьте, что каждая цепочка аминокислот, пептид, подобна длинной нити. «Первичная структура» белка — это состав самих нитей. «Вторичная структура» белка — это способ, которым эти пряди сплетаются вместе, когда пряди волос сплетаются вместе в косу или когда волокна переплетаются в лист ткани. «Третичная структура» белка — это способ, которым эти заплетенные нити скручиваются и складываются, образуя сложную трехмерную структуру. Например, подумайте, как из пряжи связать шапку, носок или варежку; каждый имеет уникальную трехмерную форму.
«Третичная структура» белка — это способ, которым эти заплетенные нити скручиваются и складываются, образуя сложную трехмерную структуру. Например, подумайте, как из пряжи связать шапку, носок или варежку; каждый имеет уникальную трехмерную форму.
Мутация : Теперь, когда вы понимаете, как читать ДНК, давайте подумаем о том, что происходит, когда происходит мутация. Мутация — это изменение ДНК. Изменения могут произойти при возникновении ошибки копирования или при повреждении ДНК радиацией или химическими токсинами.Когда происходят изменения, обычно это плохо, но, в зависимости от типа изменения, они могут быть незначительными или очень серьезными. Вот несколько возможностей: одна буква в последовательности ДНК может быть заменена на другую. Буква (или последовательность букв) может быть вставлена или удалена . Последовательность букв может быть перевернутой (вырезана, перевернута и вставлена заново). Последовательность букв может быть дублирована один или несколько раз. Представьте, что вместо C, G, As и Ts ДНК мы используем предложение, в котором каждое слово является кодоном.Вот как это предложение может выглядеть после каждого вида мутации:
Представьте, что вместо C, G, As и Ts ДНК мы используем предложение, в котором каждое слово является кодоном.Вот как это предложение может выглядеть после каждого вида мутации:
Оригинал : Быстрая коричневая лиса перепрыгнула через ленивую собаку.
Замена : Быстрый коричневый fo g перепрыгнул через ленивую собаку. (Буква x превратилась в g. Предложение осталось понятным, но значение немного изменилось. Это также иногда называют «точечной мутацией», потому что она затрагивает только одну точку в последовательности ДНК.)
Вставка : Быстрая коричневая лиса gjumpe dove rth elaz ydog.(Одна буква g , вставленная после x, сдвигает буквы вправо, изменяя разрывы между кодонами слов и делая все после вставки бессмысленным. Однако мы случайно создали слово «голубь», которое было непреднамеренно, но имеет значение . Может быть, это полезная мутация?
Удаление : Быстрый коричневый foj umpedo vert hel azyd og.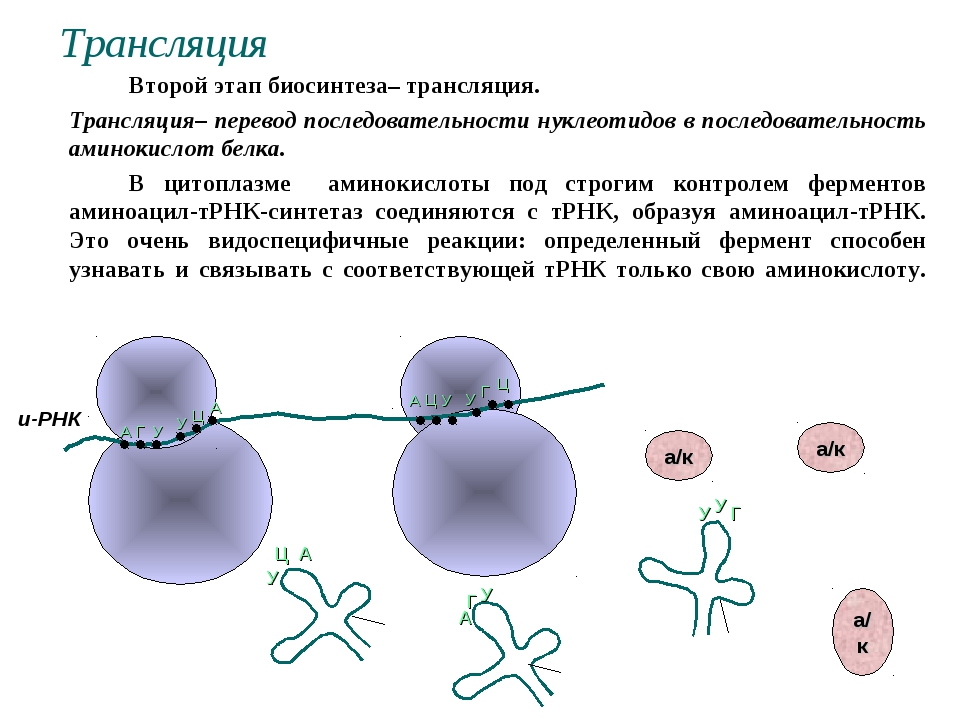 (После удаления одной буквы x каждая буква сдвигается на одну позицию влево.Предложение имеет смысл до момента мутации, но затем становится зашифрованным.)
(После удаления одной буквы x каждая буква сдвигается на одну позицию влево.Предложение имеет смысл до момента мутации, но затем становится зашифрованным.)
Удаление нескольких букв : Быстрая лиса перепрыгнула через ленивую собаку. (Если удаляется весь кодон, сдвига влево или вправо не происходит. Предложение остается понятным, но значение может измениться. Однако, если удаление не происходит точно в месте разрыва кодона, это будет больше похоже на два предыдущих примера.)
Inversion : быстрый muj xof nworb ped поверх ленивой собаки.(Перевернутая часть не имеет смысла, но остальные слова остаются без изменений.)
Дублирование : Быстрая коричневая лисица, коричневая лисица, коричневая лисица перепрыгнула через ленивую собаку. (Дублирование brown fox делает предложение немного сложнее для понимания, но, поскольку были продублированы полные кодоны, оно остается понятным. Если дублирование произошло между кодонами, это могло бы быть гораздо большим беспорядком.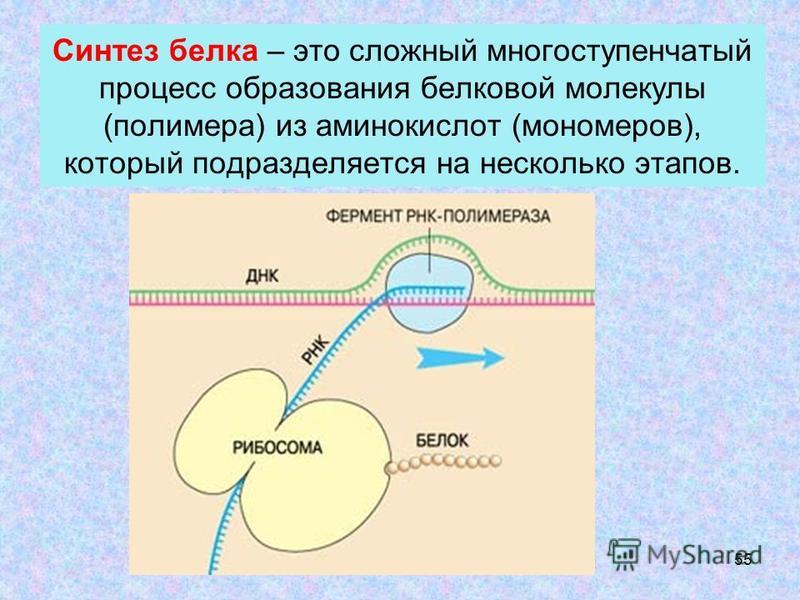

 (2013). Рибосомы берут на себя управление. Proceedings of the National Academy of Sciences of the United States of America , 110 (1), 9–10. https://doi.org/10.1073/pnas.1218764110
(2013). Рибосомы берут на себя управление. Proceedings of the National Academy of Sciences of the United States of America , 110 (1), 9–10. https://doi.org/10.1073/pnas.1218764110 Когда РНК-полимераза расшифровывает терминатор, он отделяется от ДНК. После этого шага цепь мРНК завершена.
Рисунок \ (\ PageIndex {4} \): Транскрипция происходит в три этапа — инициирование, удлинение и завершение — показанных здесь.(Общественное достояние; Calibuon через Wikimedia.org)
Когда РНК-полимераза расшифровывает терминатор, он отделяется от ДНК. После этого шага цепь мРНК завершена.
Рисунок \ (\ PageIndex {4} \): Транскрипция происходит в три этапа — инициирование, удлинение и завершение — показанных здесь.(Общественное достояние; Calibuon через Wikimedia.org)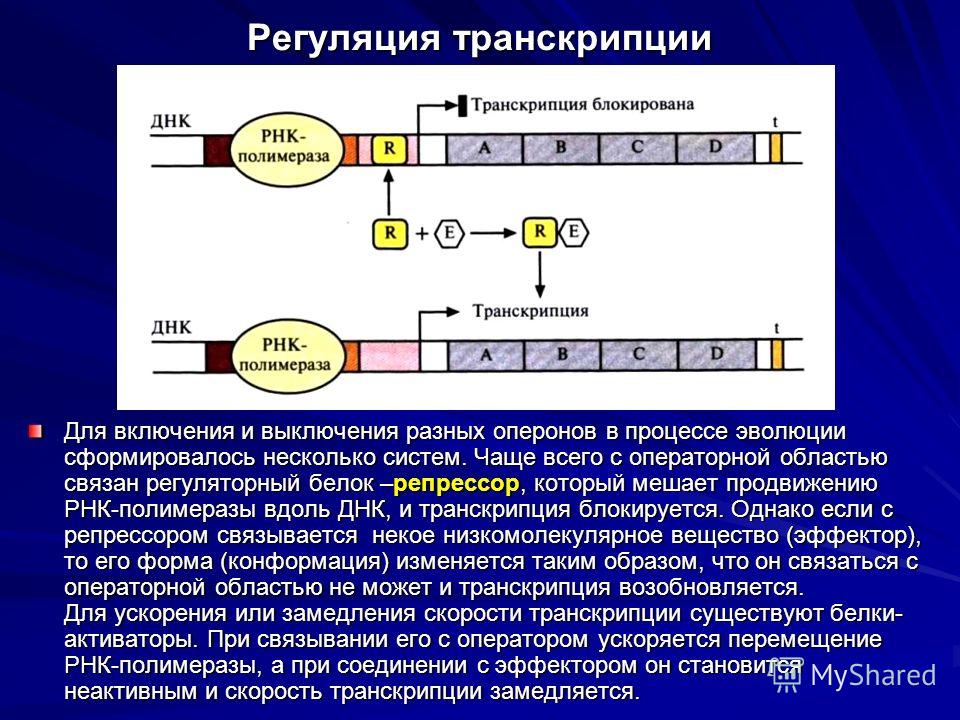 Оставшаяся мРНК состоит только из областей, называемых экзонов , которые кодируют белок. Рибонуклеопротеины на диаграмме — это небольшие белки в ядре, которые содержат РНК и необходимы для процесса сплайсинга.
Оставшаяся мРНК состоит только из областей, называемых экзонов , которые кодируют белок. Рибонуклеопротеины на диаграмме — это небольшие белки в ядре, которые содержат РНК и необходимы для процесса сплайсинга.