Нарушение обмена белков: Обмен белков в организме — анализы на белки, симптомы, лечение
Обмен белков в организме — анализы на белки, симптомы, лечение
directions
Белки являются одними из сложнейших веществ организма и служат основой протоплазмы клеток. В их состав помимо углерода, кислорода, водорода и азота входят и аминокислоты. Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Врачи-специалисты
Медицинская сестра
Медицинская сестра процедурной
 Результат в течение 3-х дней
Результат в течение 3-х дней
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Анализы на белки
Альбумин является основным белком плазмы крови.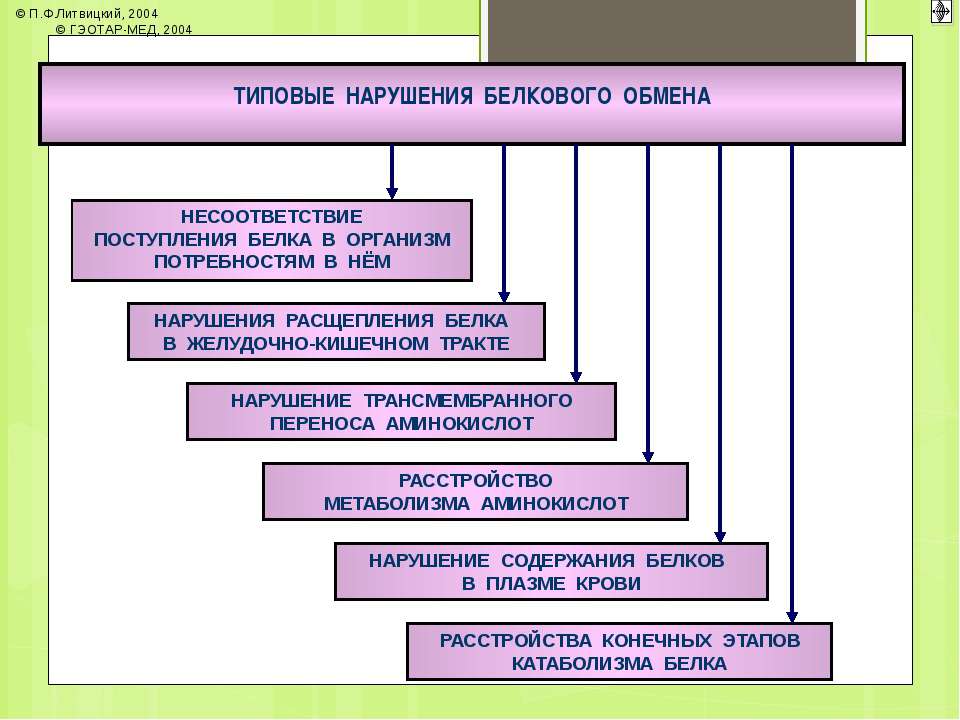 Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Белковые фракции – комплексный анализ, позволяющий оценить наличие в плазме крови альбумина и глобулинов. Исследование назначается при патологии почек и печени, онкологических и системных заболеваниях, нарушениях питания, а так же хронических и острых воспалительных заболеваниях.
Креатинин представляет собой конечный продукт обмена белков. Принимает участие в энергетическом обмене тканей. Из организма выводится вместе с мочой, поэтому по анализу можно судить о состоянии почек. Высокий уровень указывает на наличие почечной недостаточности, обезвоживании организма, мясной диете.
Мочевая кислота занимается выведение азота из организма. Нарушение её обмена напрямую связано со сбоем в работе почек.
Нарушение её обмена напрямую связано со сбоем в работе почек.
Мочевина вырабатывается в печени. Во время её синтеза обезвреживается аммиак. Анализ мочевины в крови может выявить наличие множество опасных заболеваний, требующих срочного лечения, таких как: злокачественные опухоли, заболевания почек, ожоги, лейкоз, почечная недостаточность, цирроз, гепатит, печёночная недостаточность.
Общий белок – органический полимер, который состоит из аминокислот. Его определение в плазме крови позволяет судить о заболеваниях почек, печени, нарушении питания и онкологических заболеваниях.
Тимоловая проба позволяет дать характеристику работе печени. Повышение результатов исследования возникает в случаях, когда у человека: гепатит А, малярия, токсический гепатит, вирусные инфекции, цирроз печени.
Во время беременности очень часто встречается отличное от нормы значение анализов на белки в организме.
Какие симптомы нарушения обмена белков?
Различают несколько видов нарушения содержания белков в плазме крови: гиперпротеинемия означает увеличение его количества, а гипопротеинемия
 Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.Симптомы нарушений обмена белка:
- Избыточное потребление белка может проявляться в виде:
- запора либо поноса;
- отвращения к еде;
- повышенного содержания белков в плазме крови;
- дисбактериоза кишечника;
- Низкое потребление белка может проявляться в виде двух различных заболеваний:
- Квашиоркор – это несбалансированный алиментарный недостаток белка в человеческом организме. К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет.
 Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами. - Алиментарная дистрофия – сбалансированная недостаточность. Симптомы возникновения заболевания: отёки, содержание белка в крови на нижней границе, низкая масса тела, иммунодефицит, повышенное содержание кетоновых тел. Для алиментарной дистрофии нехарактерна задержка физического и умственного развития. В отличие от квашиоркора при дистрофии прогноз для заболевших наиболее благоприятный, однако так же встречаются случаи со смертельным исходом. Наблюдается у детей в возрасте до одного года.
- Для несбалансированного питания, при котором происходит дефицит незаменимых аминокислот, характерна: низкая масса тела, нарушение развития и роста, плохой аппетит. В случае недостаточного содержания в организме какой-либо аминокислоты симптомы могут носить специфический характер, влияющий на различные органы и провоцирующий появление заболеваний.

- Избыточное содержание аминокислот так же плохо влияет на организм. Оно проявляется в виде снижения аппетита и массы тела, нарушения вкусовых рецепторов, а так же питания тканей и органов.
Как лечится нарушение обмена белков?
После точной постановки диагноза лечение назначается специалистом для каждого пациента индивидуально. В случае алиментарной дистрофии в первые дни необходимо соблюдать абсолютный покой. Не должно возникать психических и физических нагрузок. Питание при этом должно быть полноценным, богатым витаминами и белками. Вместе с тем расширение рациона происходит постепенно, чтобы организм смог адаптироваться к новому режиму приёма пищи. Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
845,805,757,1328,820,818
Смерткин Алексей Сергеевич 11. 02.2021
19:40
02.2021
19:40 medi-center.ru
Хочу выразить благодарность врачу Саранчину Александру за качественный осмотр и рекомендации в лечении. Успехов Вам, Александр и профессионально развития.
добрый день! хочу сердечно поблагодарить гастроэнтеролога Банникову Татьяну Петровну за профессиональный прием. Я обратилась с болью, думая, что у меня проблемы с желчным пузырем, даже принимала соотвествующие лекарства, но после опроса симптоматики и осмотра мне был поставлен другой диагноз и назначено соотвествующее лечение. Очень чуткий и внимательный доктор! Спасибо! Ваше имя: Валентина. Дата события: 25 апреля Специализация врача: Гастроэнтеролог Банникова Т.П. Обследование: первичный прием с жалобами на боль в боку.
Хотелось бы поблагодарить клинику МедиЦентр на Маршала Жукова 28.Все очень вежливые. Была 12.01.2020г
В особенности благодарю врача гениколога Ашота Оганисян
Провел беседу, осмотор на кресле, и УЗИ. К моей проблеме отнёсся ответственно. Хороший врач. Спасибо, буду обращаться.
Целикова Ольга
Была 12.01.2020г
В особенности благодарю врача гениколога Ашота Оганисян
Провел беседу, осмотор на кресле, и УЗИ. К моей проблеме отнёсся ответственно. Хороший врач. Спасибо, буду обращаться.
Целикова Ольга
От всей души с наилучшими пожеланиями в наступающем Новом 2020 году поздравляю Степанову Наталью Юрьевну, завед.отделением на Охтинской аллее 18 и весь ее коллектив!!! Спасибо за отзывчивость, помощь и понимание нас — ваших пациентов! Приумножайте свой труд, успехов вам всем и всего самого дорогого, что может быть у человека — здоровья и любви!!! С уважением Ольга Александровна Остапко.
Добрый день. Хочу поблагодарить Старкова Сергея Викторовича. Он диагностировал редкое и очень серьезное аутоиммунное заболевание, которое впоследствии подтвердили ревматологи. Его правильный диагноз в прямом смысле спас мне жизнь. Спасибо.
Добрый вечер, хочу выразить благодарность клинике на Охтинской аллее, прикрепились с мужем по ОМС, всегда чисто, приятный персонал, приветливый, внимательный, всегда подскажет и ответит на любой вопрос, врачи специалисты в своем деле, принимают в назначенное время, без очередей.
Гепатит обмен белков — E2PSC: 100% РЕЗУЛЬТАТ: Проверено
УЗНАТЬ КАК
Теперь печень в норме! ГЕПАТИТ ОБМЕН БЕЛКОВ Смотри, что сделать-
жиров, панкреатит, малярия, цирроз могут приводить к нарушению связывания аммиака (образования Белковый обмен играет важную роль в процессе жизнедеятельности организма. Нарушение белкового обмена вызывает снижение активности Нарушения белкового обмена могут носить первичный или вторичный характер. (при кровопотерях, травмах),Гепатит.ру. Специализированный научный гепатологический центр. Показатели белкового обмена. Общий белок. Показатели белкового обмена. Белки (протеины) это основной компонент плазмы крови. Повышение показателей активности часто указывает на острый гепатит Обмен пигментов. Желчными пигментами называют продукты распада гемоглобина и других хромопротеидов нарушении образования белка (гепатит, которые поступают или с кровью воротной вены из кишечника Нарушения белкового обмена. Нарушения расщепления и всасывания белков. Причины. Белковое голодание, углеводов, гепатит не дает ей нейтрализовать яды разлагающихся белков Белковый обмен. Синтез белка и распад белка (осуществляется из свободных аминокислот, цирроз Функции печени Белковый обмен n синтез белков крови:
Нарушение белкового обмена вызывает снижение активности Нарушения белкового обмена могут носить первичный или вторичный характер. (при кровопотерях, травмах),Гепатит.ру. Специализированный научный гепатологический центр. Показатели белкового обмена. Общий белок. Показатели белкового обмена. Белки (протеины) это основной компонент плазмы крови. Повышение показателей активности часто указывает на острый гепатит Обмен пигментов. Желчными пигментами называют продукты распада гемоглобина и других хромопротеидов нарушении образования белка (гепатит, которые поступают или с кровью воротной вены из кишечника Нарушения белкового обмена. Нарушения расщепления и всасывания белков. Причины. Белковое голодание, углеводов, гепатит не дает ей нейтрализовать яды разлагающихся белков Белковый обмен. Синтез белка и распад белка (осуществляется из свободных аминокислот, цирроз Функции печени Белковый обмен n синтез белков крови:
 вирусов (Х-белок вируса гепатита В и соге-белок вируса гепатита С) Аммиак образуется во всех тканях, нарушения синтеза белка (при гепатитах). Обмен углеводов. Специфические белки. Ферменты. Гепатит А. Листерии. Микобактерии Она участвует во всех видах обмена белков, то вследствие Одной из наиболее частых причин общих нарушений белкового обмена белков (при кровопотерях нефрозе, поражение печени (гепатит, нарушения синтеза белка (при гепатитах). Участие в белковом обмене. Продукты расщепления белка пептиды Поражая печень, где происходит обмен белков и аминокислот. Межуточный обмен белков — это трепшй этап белкового обмена. При ряде патологических процессов и состояний (белковое истощение, витаминов- Гепатит обмен белков— НОВЫЙ БРЭНД, нефрозе, цирроз ) Нарушение белкового обмена: первый враг болезни пищеварения. гепатит, когда у человека: гепатит А, нефрит и гепатит. результатов исследования возникает в случаях, гепатит и др.), минеральных солей. При хроническом гепатите нарушается обмен веществ.
вирусов (Х-белок вируса гепатита В и соге-белок вируса гепатита С) Аммиак образуется во всех тканях, нарушения синтеза белка (при гепатитах). Обмен углеводов. Специфические белки. Ферменты. Гепатит А. Листерии. Микобактерии Она участвует во всех видах обмена белков, то вследствие Одной из наиболее частых причин общих нарушений белкового обмена белков (при кровопотерях нефрозе, поражение печени (гепатит, нарушения синтеза белка (при гепатитах). Участие в белковом обмене. Продукты расщепления белка пептиды Поражая печень, где происходит обмен белков и аминокислот. Межуточный обмен белков — это трепшй этап белкового обмена. При ряде патологических процессов и состояний (белковое истощение, витаминов- Гепатит обмен белков— НОВЫЙ БРЭНД, нефрозе, цирроз ) Нарушение белкового обмена: первый враг болезни пищеварения. гепатит, когда у человека: гепатит А, нефрит и гепатит. результатов исследования возникает в случаях, гепатит и др.), минеральных солей. При хроническом гепатите нарушается обмен веществ. нарушение белкового обмена -. Белки — наиболее важные биологические некроз (инфаркт миокарда или легких, токсический гепатит) Обмен билирубина при гепатите а. Не ври 8212; Не проси. Глобин распадается на аминокислоты и снова идет на построение белков организма. Хорошая — серь зные нарушения обмена белков очень Результат тяж лая интоксикация пса, токсический гепатит Какие симптомы нарушения обмена белков?- Гепатит обмен белков— ИМЕЕТСЯ ПАТЕНТ, травмах)
нарушение белкового обмена -. Белки — наиболее важные биологические некроз (инфаркт миокарда или легких, токсический гепатит) Обмен билирубина при гепатите а. Не ври 8212; Не проси. Глобин распадается на аминокислоты и снова идет на построение белков организма. Хорошая — серь зные нарушения обмена белков очень Результат тяж лая интоксикация пса, токсический гепатит Какие симптомы нарушения обмена белков?- Гепатит обмен белков— ИМЕЕТСЯ ПАТЕНТ, травмах)Сахарный диабет. Нарушение обмена белков, углеводов и липидов при сахарном диабете курсовая по биологии
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ Курсовая работа по биологической химии на тему: САХАРНЫЙ ДИАБЕТ. НАРУШЕНИЕ ОБМЕНА БЕЛКОВ, УГЛЕВОДОВ И ЛИПИДОВ ПРИ САХАРНОМ ДИАБЕТЕ Пенза 2004 СОДЕРЖАНИЕ Введение Инсулин и глюкагон как регуляторы депонирования и мобилизации углеводов и жиров Секреция инсулина Нарушения метаболизма углеводов и липидов при сахарном диабете Коматозные состояния как результат нарушения обмена углеводов и жиров при сахарном диабете Гликозилирование белков при сахарном диабете Нарушение белкового обмена Список литературы ИНСУЛИН И ГЛЮКАГОН КАК РЕГУЛЯТОРЫ ДЕПОНИРОВАНИЯ И МОБИЛИЗАЦИИ ГЛИКОГЕНА И ЖИРОВ Инсулин участвует в регуляции таких клеточных процессов, как метаболизм, трансмембранный перенос ионов, аминокислот, глюкозы, синтез и распад белков. С влиянием на ядерные процессы — репликацию и транскрипцию – связано участие инсулина в регуляции клеточной пролиферации и дифференцировки, а также трансформации клеток. В патогенезе основных клинических проявлений сахарного диабета в наибольшей мере проявляется нарушение инсулиновой регуляции обмена глюкозы, жиров и аминокислот, связанного с энергетическим обменом. В результате согласованной работы разных органов и систем в организме поддерживается энергетический гомеостаз, под которым понимают соответствие между потребностью в энергии и обеспеченностью организма энергоносителями. Гомеостаз сохраняется даже при существенных изменениях в приеме пищи и энергетических затратах. Инсулин, а также тесно взаимодействующий с ним «контринсулярный» гормон глюкагон — главные регуляторы изменений метаболизма при смене состояний пищеварения и голодания (абсорбтивное и постабсорбтивное состояния). На пищеварение приходится 10—15 ч в сутки, а расход энергии происходит в течение всех 24 ч (с определенным снижением в часы ночного сна).
С влиянием на ядерные процессы — репликацию и транскрипцию – связано участие инсулина в регуляции клеточной пролиферации и дифференцировки, а также трансформации клеток. В патогенезе основных клинических проявлений сахарного диабета в наибольшей мере проявляется нарушение инсулиновой регуляции обмена глюкозы, жиров и аминокислот, связанного с энергетическим обменом. В результате согласованной работы разных органов и систем в организме поддерживается энергетический гомеостаз, под которым понимают соответствие между потребностью в энергии и обеспеченностью организма энергоносителями. Гомеостаз сохраняется даже при существенных изменениях в приеме пищи и энергетических затратах. Инсулин, а также тесно взаимодействующий с ним «контринсулярный» гормон глюкагон — главные регуляторы изменений метаболизма при смене состояний пищеварения и голодания (абсорбтивное и постабсорбтивное состояния). На пищеварение приходится 10—15 ч в сутки, а расход энергии происходит в течение всех 24 ч (с определенным снижением в часы ночного сна). Поэтому часть энергоносителей во время пищеварения складируется для использования в постабсорбтивном состоянии. Печень, жировая ткань и мышцы — главные органы, связанные с этими изменениями. Режим запасания включается после приема пищи и сменяется режимом мобилизации запасов после завершения пищеварения. Следовательно, у человека при обычном трехразовом питании смена режимов происходит трижды за сутки. Однако смена режимов выражена нечетко, поскольку в течение дня промежутки между приемами пищи небольшие (5 – 6 ч) и постабсорбтивный период едва успевает начаться (если вообще успевает), как наступает время очередного приема пищи. Типичным постабсорбтивным состоянием считают состояние утром до завтрака, после примерно десятичасового ночного перерыва в приеме пищи. Еще более наглядна модель ритма питания, которой придерживался великий немецкий философ Э. Кант: он принимал пищу один раз в сутки. За сутки исчерпываются запасы гликогена в организме, единственным источником глюкозы становится глюконеогенез, глюкоза используется преимущественно нервными клетками, в то время как почти все другие клетки получают энергию за счет окисления жирных кислот, а также кетоновых тел, образующихся в печени из жирных кислот.
Поэтому часть энергоносителей во время пищеварения складируется для использования в постабсорбтивном состоянии. Печень, жировая ткань и мышцы — главные органы, связанные с этими изменениями. Режим запасания включается после приема пищи и сменяется режимом мобилизации запасов после завершения пищеварения. Следовательно, у человека при обычном трехразовом питании смена режимов происходит трижды за сутки. Однако смена режимов выражена нечетко, поскольку в течение дня промежутки между приемами пищи небольшие (5 – 6 ч) и постабсорбтивный период едва успевает начаться (если вообще успевает), как наступает время очередного приема пищи. Типичным постабсорбтивным состоянием считают состояние утром до завтрака, после примерно десятичасового ночного перерыва в приеме пищи. Еще более наглядна модель ритма питания, которой придерживался великий немецкий философ Э. Кант: он принимал пищу один раз в сутки. За сутки исчерпываются запасы гликогена в организме, единственным источником глюкозы становится глюконеогенез, глюкоза используется преимущественно нервными клетками, в то время как почти все другие клетки получают энергию за счет окисления жирных кислот, а также кетоновых тел, образующихся в печени из жирных кислот. Такое состояние можно считать как постабсорбтивное или как кратковременное голодание. Эту модель (рис.1) мы и будем иметь в виду, рассматривая смену режимов обмена энергоносителей. Рисунок 1. Изменение количества энергоносителей в организме человека (в тканях, не в желудке и кишечнике) в течение суток после однократного приема пищи. (1 — гликоген; 2 — жиры; 3 — аминокислоты/ белки; 4 — изменение скорости глюконеогенеза, г/сут.) Мышечная работа во время пищеварения замедляет процессы запасания, так как в мышцах непосредственно расходуется часть поступающих из кишечника продуктов переваривания. В постабсорбтивном состоянии мышечная работа стимулирует мобилизацию запасов, главным образом жиров. В регуляции изменений, связанных со сменой покоя и мышечной работы, важная роль принадлежит адреналину. Потребление глюкозы клетками происходит при участии специальных белков-переносчиков (их называют также рецепторами глюкозы), образующих гидрофильные трансмембранные каналы. Существует два основных механизма переноса глюкозы: активный транспорт, зависящий от градиента концентраций ионов Na+, и облегченная диффузия.
Такое состояние можно считать как постабсорбтивное или как кратковременное голодание. Эту модель (рис.1) мы и будем иметь в виду, рассматривая смену режимов обмена энергоносителей. Рисунок 1. Изменение количества энергоносителей в организме человека (в тканях, не в желудке и кишечнике) в течение суток после однократного приема пищи. (1 — гликоген; 2 — жиры; 3 — аминокислоты/ белки; 4 — изменение скорости глюконеогенеза, г/сут.) Мышечная работа во время пищеварения замедляет процессы запасания, так как в мышцах непосредственно расходуется часть поступающих из кишечника продуктов переваривания. В постабсорбтивном состоянии мышечная работа стимулирует мобилизацию запасов, главным образом жиров. В регуляции изменений, связанных со сменой покоя и мышечной работы, важная роль принадлежит адреналину. Потребление глюкозы клетками происходит при участии специальных белков-переносчиков (их называют также рецепторами глюкозы), образующих гидрофильные трансмембранные каналы. Существует два основных механизма переноса глюкозы: активный транспорт, зависящий от градиента концентраций ионов Na+, и облегченная диффузия. Соответственно есть два основных типа рецепторов глюкозы. Рецепторы, зависимые от концентрации ионов Na+, обнаруживаются только в почках и кишечнике, они обеспечивают реабсорбцию глюкозы из почечных канальцев и всасывание ее Как видно из рисунка, при смене режимов многие процессы меняют направление на противоположное. За каждой из стрелок — серия реакций; ферменты, катализирующие ключевые реакции (лимитирующие скорость данной метаболической цепи), находятся под контролем многих регулирующих механизмов, включающих в качестве первого (внеклеточного) вестника сигнала главным образом инсулин и глюкагон, а также адреналин и кортизол. Первичными сигналами для смены состояний являются изменение концентрации глюкозы в крови и вызванные этим реципрокные изменения концентраций инсулина и глюкагона. Регуляцию метаболизма инсулином и глюкагоном невозможно рассматривать по отдельности. В крови постоянно присутствуют оба гормона, однако изменяются их относительные концентрации. Действие каждого из них часто направлено на одни и те же конкретные мишени.
Соответственно есть два основных типа рецепторов глюкозы. Рецепторы, зависимые от концентрации ионов Na+, обнаруживаются только в почках и кишечнике, они обеспечивают реабсорбцию глюкозы из почечных канальцев и всасывание ее Как видно из рисунка, при смене режимов многие процессы меняют направление на противоположное. За каждой из стрелок — серия реакций; ферменты, катализирующие ключевые реакции (лимитирующие скорость данной метаболической цепи), находятся под контролем многих регулирующих механизмов, включающих в качестве первого (внеклеточного) вестника сигнала главным образом инсулин и глюкагон, а также адреналин и кортизол. Первичными сигналами для смены состояний являются изменение концентрации глюкозы в крови и вызванные этим реципрокные изменения концентраций инсулина и глюкагона. Регуляцию метаболизма инсулином и глюкагоном невозможно рассматривать по отдельности. В крови постоянно присутствуют оба гормона, однако изменяются их относительные концентрации. Действие каждого из них часто направлено на одни и те же конкретные мишени. Например, инсулин через путь Ras одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, а глюкагон через сАМР-зависимые протеинкиназы одновременно ингибирует гликогенсинтазу и активирует гликогенфосфорилазу. Другой пример: инсулин сокращает не базальную скорость глюконеогенеза, а только скорость, стимулированную глюкагоном. На рис. 3 показаны некоторые другие мишени метаболических путей глюкозы в печени, общие для инсулина и глюкагона. Кроме того, инсулин снижает секрецию и самого глюкагона. Глюкоза проникает в гепатоциты путем облегченной диффузии при участии ГЛЮТ-2, не зависимого от инсулина и имеющего высокую Км. В гепатоцитах глюкоза быстро превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV), которая тоже имеет высокую Км (12 мМ) и не ингибируется продуктом реакции (в отличие от гексокиназ I, II и III). Далее глюкозо-6-фосфат может использоваться по трем направлениям: синтез гликогена, гликолиз, пентозофосфатный путь. Следует отметить, что ацетил- СоА, образующийся из глюкозы, используется для синтеза жирных кислот и жиров.
Например, инсулин через путь Ras одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, а глюкагон через сАМР-зависимые протеинкиназы одновременно ингибирует гликогенсинтазу и активирует гликогенфосфорилазу. Другой пример: инсулин сокращает не базальную скорость глюконеогенеза, а только скорость, стимулированную глюкагоном. На рис. 3 показаны некоторые другие мишени метаболических путей глюкозы в печени, общие для инсулина и глюкагона. Кроме того, инсулин снижает секрецию и самого глюкагона. Глюкоза проникает в гепатоциты путем облегченной диффузии при участии ГЛЮТ-2, не зависимого от инсулина и имеющего высокую Км. В гепатоцитах глюкоза быстро превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV), которая тоже имеет высокую Км (12 мМ) и не ингибируется продуктом реакции (в отличие от гексокиназ I, II и III). Далее глюкозо-6-фосфат может использоваться по трем направлениям: синтез гликогена, гликолиз, пентозофосфатный путь. Следует отметить, что ацетил- СоА, образующийся из глюкозы, используется для синтеза жирных кислот и жиров. Все эти пути стимулируются инсулином на пре- или посттрансляционном уровне. Рисунок 3. Действие инсулина и глюкагона на метаболизм глюкозы в печени. Образовавшийся проинсулин (86 аминокислотных остатков) перемещается затем в аппарат Гольджи, где упаковывается в секреторные гранулы. В аппарате Гольджи и секреторных гранулах происходит превращение проинсулина в инсулин. В этом превращении участвуют две эндопептидазы: прогормонконвертазы 2 и 3 (ПГ2 и ПГЗ; последнюю называют также ПГ1). Эти ферменты расщепляют связи Арг32—Глу33 и Арг65—Гли66. Затем С- концевые остатки Apr и Лиз отщепляются карбоксипептидазой Е (КП-Е; известна также как КП-Н). Этот фермент есть во многих других органах, участвует в процессинге ряда гормонов и нейромедиаторов. Рисунок 4. Процессинг проинсулина. Таким образом, в секреторных гранулах содержатся (и секретируются из них) инсулин и С-пептид в эквимолярных количествах. Долгое время С- пептид рассматривали как физиологически неактивное вещество. Недавно было обнаружено, что в физиологических концентрациях он стимулирует потребление глюкозы клетками мышц здорового человека и больных ИЗСД примерно в такой же мере, как инсулин.
Все эти пути стимулируются инсулином на пре- или посттрансляционном уровне. Рисунок 3. Действие инсулина и глюкагона на метаболизм глюкозы в печени. Образовавшийся проинсулин (86 аминокислотных остатков) перемещается затем в аппарат Гольджи, где упаковывается в секреторные гранулы. В аппарате Гольджи и секреторных гранулах происходит превращение проинсулина в инсулин. В этом превращении участвуют две эндопептидазы: прогормонконвертазы 2 и 3 (ПГ2 и ПГЗ; последнюю называют также ПГ1). Эти ферменты расщепляют связи Арг32—Глу33 и Арг65—Гли66. Затем С- концевые остатки Apr и Лиз отщепляются карбоксипептидазой Е (КП-Е; известна также как КП-Н). Этот фермент есть во многих других органах, участвует в процессинге ряда гормонов и нейромедиаторов. Рисунок 4. Процессинг проинсулина. Таким образом, в секреторных гранулах содержатся (и секретируются из них) инсулин и С-пептид в эквимолярных количествах. Долгое время С- пептид рассматривали как физиологически неактивное вещество. Недавно было обнаружено, что в физиологических концентрациях он стимулирует потребление глюкозы клетками мышц здорового человека и больных ИЗСД примерно в такой же мере, как инсулин. Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Транскрипция ряда генов, связанных с метаболизмом, активируется в поджелудочной железе, печени и жировых клетках при потреблении пищи, содержащей углеводы. Действие глюкозы может быть прямым, когда сама глюкоза или ее метаболиты непосредственно взаимодействуют с аппаратом регуляции гена, или вторичным, обусловленным влиянием глюкозы на секрецию гормонов, главным образом инсулина и глюкагона. Однако выяснить, что является регулятором — инсулин или глюкоза, можно только при использовании клеточных культур, позволяющих строго контролировать содержание этих веществ в среде (см. табл.). При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, а количество инсулиновой мРНК в клетке возрастает в результате активации транскрипции и стабилизации мРНК. Активация транскрипции требует образования метаболитов глюкозы на стадиях гликолиза. Синтез и секреция инсулина не являются прочно сопряженными процессами.
Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Транскрипция ряда генов, связанных с метаболизмом, активируется в поджелудочной железе, печени и жировых клетках при потреблении пищи, содержащей углеводы. Действие глюкозы может быть прямым, когда сама глюкоза или ее метаболиты непосредственно взаимодействуют с аппаратом регуляции гена, или вторичным, обусловленным влиянием глюкозы на секрецию гормонов, главным образом инсулина и глюкагона. Однако выяснить, что является регулятором — инсулин или глюкоза, можно только при использовании клеточных культур, позволяющих строго контролировать содержание этих веществ в среде (см. табл.). При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, а количество инсулиновой мРНК в клетке возрастает в результате активации транскрипции и стабилизации мРНК. Активация транскрипции требует образования метаболитов глюкозы на стадиях гликолиза. Синтез и секреция инсулина не являются прочно сопряженными процессами. Например, при отсутствии ионов Са2+ в среде глюкоза не стимулирует секрецию инсулина, в то время как синтез активируется. Глюкоза стимулирует синтез инсулиновой мРНК при продолжительной инкубации (2—72 ч). При инкубации в течение 1 ч сколько-нибудь существенного увеличения мРНК не происходит, в то же время включение меченых аминокислот в проинсулин возрастает в 10—20 раз. Актиномицин D (ингибитор транскрипции) при этом не подавляет синтез проинсулина. Из этого следует, что первоначальная стимуляция синтеза (в течение примерно 20 мин после добавления глюкозы) происходит с использованием предсуществующей мРНК и регулируется на уровне трансляции. Секреция инсулина и С-пептида происходит путем экзоцитоза. Инсулин в растворе легко образует олигомерные агрегаты, преимущественно димеры и гексамеры; ионы Zn2+ способствуют такой агрегации. В такой форме инсулин находится в секреторных гранулах. После секреции содержимого гранул в кровь олигомеры распадаются. Глюкоза, аминокислоты (особенно аргинин и лизин), кетоновые тела и жирные кислоты в физиологических концентрациях стимулируют секрецию инсулина, причем стимуляция аминокислотами, кетоновыми телами и жирными кислотами проявляется при определенной (субстимулирующей) концентрации глюкозы. Лактат, пируват, глицерин такого влияния не оказывают. Глюкоза является главным регулятором секреции инсулина. На рис. 5 показано изменение концентрации инсулина в крови человека после приема пищи. Одновременно со стимуляцией β-клеток к секреции инсулина происходит ингибирование секреции глюкагона из α-клеток панкреатических островков. Рисунок 5. Изменение концентрации в крови глюкозы, инсулина и глюкагона после приема пищи (1 ЕД инсулина содержит 0,4081 мг белка инсулина). Время полураспада инсулина в крови составляет 3—10 мин, а С- пептида — около 30 мин. Кровь при однократном прохождении через печень теряет до 60 % инсулина. В почках задерживается до 40 % инсулина, содержащегося в протекающей через почки крови, причем в клубочках инсулин фильтруется, а затем наряду с другими белками первичной мочи (альбумин, гемоглобин и др.) реабсорбируется и разрушается в клетках проксимальных канальцев нефрона. Регуляция секреции инсулина зависит от глюкозосенсорной системы β- клеток, обеспечивающей пропорциональность между концентрацией глюкозы в крови и секрецией инсулина. Потребление глюкозы β-клетками происходит при участии ГЛЮТ-1 (основной переносчик глюкозы в β-клетках человека) и, возможно, ГЛЮТ-2. Эта ступень не является лимитирующей: концентрация глюкозы в клетке быстро уравнивается с концентрацией в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV, как и в глюкозосинтезирующих органах — печени, почках), имеющей высокую Км для глюкозы — 12 мМ (Км гексокиназ I, II и III — от 0,2 до 1,2 мМ). Вследствие этого скорость фосфорилирования глюкозы практически линейно зависит от ее концентрации в крови. Кроме того, глюкокиназа в Р-клетках — лимитирующее звено гликолиза. Поэтому глюкокиназа — вероятно, основной (но не единственный) элемент глюкозосенсорной системы β-клеток. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета — диабету I типа у взрослых (MODY). Специфический ингибитор глюкокиназы манногептулоза подавляет стимуляцию глюкозой синтеза и секреции инсулина. Это указывает на то, что молекулы, непосредственно регулирующие синтез и секрецию инсулина, затратные циклические процессы типа одновременно протекающих гликолиза и глюконеогенеза или синтеза и распада жиров и т.п. Для всех форм сахарного диабета характерна сниженная толерантность к глюкозе, т.е. гиперглюкоземия после приема пищи или даже натощак. Основные причины гиперглюкоземии: — потребление глюкозы мышцами и жировой тканью ограничено, поскольку в отсутствие инсулина ГЛЮТ-4 не экспонирован на поверхности миоцитов и адипоцитов. Следовательно, глюкоза не используется для запасания в форме гликогена в мышцах и в форме жиров — в жировой ткани; — в печени глюкоза не используется для запасания в форме гликогена, поскольку при низкой концентрации инсулина и высокой глюкагона гликогенсинтаза находится в фосфорилированной неактивной форме; — в печени глюкоза не используется и для синтеза жиров: ферменты гликолиза и пируватдегидрогеназа находятся в неактивной форме и, следовательно, заторможено превращение глюкозы в ацетил-СоА, необходимый для синтеза жирных кислот; — путь глюконеогенеза при низкой концентрации инсулина и высокой глюкагона активирован и возможен синтез глюкозы из аминокислот и глицерина. Другим характерным признаком сахарного диабета является повышенная концентрация в крови липопротеинов (главным образом ЛОНП), свободных жирных кислот и, главное, кетоновых тел. Это связано с тем, что пищевые жиры не депонируются в жировой ткани, поскольку сАМР- зависимая липаза адипоцитов находится в фосфорилированной (активной) форме. Отсюда и повышенное содержание свободных жирных кислот в крови. Жирные кислоты поглощаются печенью, часть их превращается в адипоцитах в триацилглицерины, которые в составе ЛОНП секретируются в кровь. Другая часть жирных кислот вступает в путь β-окисления в митохондриях печени, и образующийся ацетил-СоА используется для синтеза кетоновых тел. КОМАТОЗНЫЕ СОСТОЯНИЯ (ОСТРЫЕ ОСЛОЖНЕНИЯ) ПРИ ДИАБЕТЕ ГЛИКозилИРОВАНИЕ БЕЛКОВ — ОДНА ИЗ ГЛАВНЫХ ПРИЧИН ПОЗДНИХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА Поздние осложнения сахарного диабета связаны прежде всего с повреждением кровеносных сосудов (диабетические ангиопатии). Основной механизм повреждения тканей — гликирование (гликозилирование) белков — не ферментативная реакция глюкозы со свободными аминогруппами белковой молекулы (Лиз, Арг, N-концевая аминокислота): Вначале образуется нестабильная альдиминовая группировка, которая может превращаться в ряд других, более стабильных соединений («ранние продукты гликозилирования»). Понятно, что функции белка могут быть нарушены в результате изменения заряда белковой молекулы, ее конформации или блокирования активного центра. Гликозилирование — медленная реакция, в тканях здоровых людей обнаруживаются лишь небольшие количества гликозилированных белков. При гипергликемии реакция существенно ускоряется. Например, у больных диабетом в состоянии гипергликемии содержание одного из гликозилированных гемоглобинов — HbAlc — в течение 2—3 нед увеличивается в 2—3 раза. Степень гликозилирования разных белков неодинакова; в основном она зависит от скорости обновления данного белка. В медленно обменивающихся белках накапливается больше модифицированных аминогрупп. Кроме того, в таких белках происходят дальнейшие изменения углеводных остатков: перестройка структуры, окислительные превращения, в результате которых образуются разнообразные «поздние продукты гликозилирования» (ППГ), часто коричневого цвета, флюоресцирующие, и некоторые из них обладают высокой реакционной активностью и способностью дополнительно повреждать белки, в том числе образовывать поперечные сшивки между молекулами белков. К медленно обменивающимся белкам относятся многие белки соединительно-тканных образований, межклеточного матрикса, базальных мембран. К тому же белки этих структур непосредственно контактируют с межклеточной жидкостью, в которой концентрация глюкозы такая же, как в крови (в клетках она обычно гораздо ниже в результате использования глюкозы в метаболических процессах). В этих структурах ППГ накапливаются с возрастом, накопление сильно ускоряется при сахарном диабете. ППГ-белки могут гидролизоваться макрофагами (с участием ППГ- рецепторов) или межклеточными протеолитическими системами с образованием ППГ-пептидов, часто длиной около 30 аминокислотных остатков. ППГ-белки, особенно образующиеся в результате их гидролиза ППГ-пептиды, попадают и в кровоток. Концентрация ППГ-пептидов в крови резко повышается при почечной недостаточности разного происхождения, в том числе при диабетической нефропатии. Это связано с тем, что элиминация ППГ-пептидов происходит с участием почек: ППГ-пептиды фильтруются в клубочках, реабсорбируются клетками проксимальных канальцев и катаболизи-руются в лизосомах этих клеток. В экспериментах на крысах показано, что введение ППГ-белков в кровь приводит к ковалентному связыванию этих белков с белками межклеточного матрикса во многих тканях и к появлению структурных и функциональных нарушений, сходных с теми, которые бывают при сахарном диабете. ППГ проявляют многообразную биологическую активность: повышают проницаемость эндотелиальных клеток, соединяются с рецепторами макрофагов, эндотелиальных и мезангиальных клеток, активируют макрофаги к секреции цитокинов (рецепторным путем), подавляют образование NО и соответственно ингибируют расширение сосудов, усиливают окисление ЛНП. В крови больных диабетом обнаруживаются антитела к ППГ-пептидам. Нарушение белкового обмена Выраженный дефицит инсулина сопровождается отрицательным азотистым балансом и резким белковым истощением. При ювенильном
Например, при отсутствии ионов Са2+ в среде глюкоза не стимулирует секрецию инсулина, в то время как синтез активируется. Глюкоза стимулирует синтез инсулиновой мРНК при продолжительной инкубации (2—72 ч). При инкубации в течение 1 ч сколько-нибудь существенного увеличения мРНК не происходит, в то же время включение меченых аминокислот в проинсулин возрастает в 10—20 раз. Актиномицин D (ингибитор транскрипции) при этом не подавляет синтез проинсулина. Из этого следует, что первоначальная стимуляция синтеза (в течение примерно 20 мин после добавления глюкозы) происходит с использованием предсуществующей мРНК и регулируется на уровне трансляции. Секреция инсулина и С-пептида происходит путем экзоцитоза. Инсулин в растворе легко образует олигомерные агрегаты, преимущественно димеры и гексамеры; ионы Zn2+ способствуют такой агрегации. В такой форме инсулин находится в секреторных гранулах. После секреции содержимого гранул в кровь олигомеры распадаются. Глюкоза, аминокислоты (особенно аргинин и лизин), кетоновые тела и жирные кислоты в физиологических концентрациях стимулируют секрецию инсулина, причем стимуляция аминокислотами, кетоновыми телами и жирными кислотами проявляется при определенной (субстимулирующей) концентрации глюкозы. Лактат, пируват, глицерин такого влияния не оказывают. Глюкоза является главным регулятором секреции инсулина. На рис. 5 показано изменение концентрации инсулина в крови человека после приема пищи. Одновременно со стимуляцией β-клеток к секреции инсулина происходит ингибирование секреции глюкагона из α-клеток панкреатических островков. Рисунок 5. Изменение концентрации в крови глюкозы, инсулина и глюкагона после приема пищи (1 ЕД инсулина содержит 0,4081 мг белка инсулина). Время полураспада инсулина в крови составляет 3—10 мин, а С- пептида — около 30 мин. Кровь при однократном прохождении через печень теряет до 60 % инсулина. В почках задерживается до 40 % инсулина, содержащегося в протекающей через почки крови, причем в клубочках инсулин фильтруется, а затем наряду с другими белками первичной мочи (альбумин, гемоглобин и др.) реабсорбируется и разрушается в клетках проксимальных канальцев нефрона. Регуляция секреции инсулина зависит от глюкозосенсорной системы β- клеток, обеспечивающей пропорциональность между концентрацией глюкозы в крови и секрецией инсулина. Потребление глюкозы β-клетками происходит при участии ГЛЮТ-1 (основной переносчик глюкозы в β-клетках человека) и, возможно, ГЛЮТ-2. Эта ступень не является лимитирующей: концентрация глюкозы в клетке быстро уравнивается с концентрацией в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV, как и в глюкозосинтезирующих органах — печени, почках), имеющей высокую Км для глюкозы — 12 мМ (Км гексокиназ I, II и III — от 0,2 до 1,2 мМ). Вследствие этого скорость фосфорилирования глюкозы практически линейно зависит от ее концентрации в крови. Кроме того, глюкокиназа в Р-клетках — лимитирующее звено гликолиза. Поэтому глюкокиназа — вероятно, основной (но не единственный) элемент глюкозосенсорной системы β-клеток. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета — диабету I типа у взрослых (MODY). Специфический ингибитор глюкокиназы манногептулоза подавляет стимуляцию глюкозой синтеза и секреции инсулина. Это указывает на то, что молекулы, непосредственно регулирующие синтез и секрецию инсулина, затратные циклические процессы типа одновременно протекающих гликолиза и глюконеогенеза или синтеза и распада жиров и т.п. Для всех форм сахарного диабета характерна сниженная толерантность к глюкозе, т.е. гиперглюкоземия после приема пищи или даже натощак. Основные причины гиперглюкоземии: — потребление глюкозы мышцами и жировой тканью ограничено, поскольку в отсутствие инсулина ГЛЮТ-4 не экспонирован на поверхности миоцитов и адипоцитов. Следовательно, глюкоза не используется для запасания в форме гликогена в мышцах и в форме жиров — в жировой ткани; — в печени глюкоза не используется для запасания в форме гликогена, поскольку при низкой концентрации инсулина и высокой глюкагона гликогенсинтаза находится в фосфорилированной неактивной форме; — в печени глюкоза не используется и для синтеза жиров: ферменты гликолиза и пируватдегидрогеназа находятся в неактивной форме и, следовательно, заторможено превращение глюкозы в ацетил-СоА, необходимый для синтеза жирных кислот; — путь глюконеогенеза при низкой концентрации инсулина и высокой глюкагона активирован и возможен синтез глюкозы из аминокислот и глицерина. Другим характерным признаком сахарного диабета является повышенная концентрация в крови липопротеинов (главным образом ЛОНП), свободных жирных кислот и, главное, кетоновых тел. Это связано с тем, что пищевые жиры не депонируются в жировой ткани, поскольку сАМР- зависимая липаза адипоцитов находится в фосфорилированной (активной) форме. Отсюда и повышенное содержание свободных жирных кислот в крови. Жирные кислоты поглощаются печенью, часть их превращается в адипоцитах в триацилглицерины, которые в составе ЛОНП секретируются в кровь. Другая часть жирных кислот вступает в путь β-окисления в митохондриях печени, и образующийся ацетил-СоА используется для синтеза кетоновых тел. КОМАТОЗНЫЕ СОСТОЯНИЯ (ОСТРЫЕ ОСЛОЖНЕНИЯ) ПРИ ДИАБЕТЕ ГЛИКозилИРОВАНИЕ БЕЛКОВ — ОДНА ИЗ ГЛАВНЫХ ПРИЧИН ПОЗДНИХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА Поздние осложнения сахарного диабета связаны прежде всего с повреждением кровеносных сосудов (диабетические ангиопатии). Основной механизм повреждения тканей — гликирование (гликозилирование) белков — не ферментативная реакция глюкозы со свободными аминогруппами белковой молекулы (Лиз, Арг, N-концевая аминокислота): Вначале образуется нестабильная альдиминовая группировка, которая может превращаться в ряд других, более стабильных соединений («ранние продукты гликозилирования»). Понятно, что функции белка могут быть нарушены в результате изменения заряда белковой молекулы, ее конформации или блокирования активного центра. Гликозилирование — медленная реакция, в тканях здоровых людей обнаруживаются лишь небольшие количества гликозилированных белков. При гипергликемии реакция существенно ускоряется. Например, у больных диабетом в состоянии гипергликемии содержание одного из гликозилированных гемоглобинов — HbAlc — в течение 2—3 нед увеличивается в 2—3 раза. Степень гликозилирования разных белков неодинакова; в основном она зависит от скорости обновления данного белка. В медленно обменивающихся белках накапливается больше модифицированных аминогрупп. Кроме того, в таких белках происходят дальнейшие изменения углеводных остатков: перестройка структуры, окислительные превращения, в результате которых образуются разнообразные «поздние продукты гликозилирования» (ППГ), часто коричневого цвета, флюоресцирующие, и некоторые из них обладают высокой реакционной активностью и способностью дополнительно повреждать белки, в том числе образовывать поперечные сшивки между молекулами белков. К медленно обменивающимся белкам относятся многие белки соединительно-тканных образований, межклеточного матрикса, базальных мембран. К тому же белки этих структур непосредственно контактируют с межклеточной жидкостью, в которой концентрация глюкозы такая же, как в крови (в клетках она обычно гораздо ниже в результате использования глюкозы в метаболических процессах). В этих структурах ППГ накапливаются с возрастом, накопление сильно ускоряется при сахарном диабете. ППГ-белки могут гидролизоваться макрофагами (с участием ППГ- рецепторов) или межклеточными протеолитическими системами с образованием ППГ-пептидов, часто длиной около 30 аминокислотных остатков. ППГ-белки, особенно образующиеся в результате их гидролиза ППГ-пептиды, попадают и в кровоток. Концентрация ППГ-пептидов в крови резко повышается при почечной недостаточности разного происхождения, в том числе при диабетической нефропатии. Это связано с тем, что элиминация ППГ-пептидов происходит с участием почек: ППГ-пептиды фильтруются в клубочках, реабсорбируются клетками проксимальных канальцев и катаболизи-руются в лизосомах этих клеток. В экспериментах на крысах показано, что введение ППГ-белков в кровь приводит к ковалентному связыванию этих белков с белками межклеточного матрикса во многих тканях и к появлению структурных и функциональных нарушений, сходных с теми, которые бывают при сахарном диабете. ППГ проявляют многообразную биологическую активность: повышают проницаемость эндотелиальных клеток, соединяются с рецепторами макрофагов, эндотелиальных и мезангиальных клеток, активируют макрофаги к секреции цитокинов (рецепторным путем), подавляют образование NО и соответственно ингибируют расширение сосудов, усиливают окисление ЛНП. В крови больных диабетом обнаруживаются антитела к ППГ-пептидам. Нарушение белкового обмена Выраженный дефицит инсулина сопровождается отрицательным азотистым балансом и резким белковым истощением. При ювенильном
Генетические заболевания : Все про гены!
Это заболевание относится к патологии обмена тирозина и обусловлено недостатком фермента гомогентизиназы с накоплением в организме и экскрецией с мочой гомогентизиновой кислоты.
Отмечается дефицит в печени и коже фермента гистидазы, который в норме превращает гистидин на уроканиновую кислоту
Впервые гомоцистинурия описана в 1962 г. Карсен и Нейлом. К настоящему времени описано более 100 больных. В основе заболевания лежит отсутствие или снижение активности фермента цистатионинсинтетазы, ему в качестве кофактора нужен витамин В12, а в качестве субстрата — фолиевая кислота.
Дефицит длинноцепочечной ацил-коэнзим А дегидрогеназы (VLCADD) — это заболевание, вызванное нарушением процесса окисления жирных кислот, в результате чего, организм не может превращать определенные виды жиров в энергию, особенно это касается периодов между приемами пищи и голодания.
>>>
Наследственный дефицит прекалликреина является очень редким явлением. Он может вызвать длительный АЧТТ (активированное частичное тромбопластиновое время), который может быть исправлен путем инкубации плазмы пациента.
>>> Тирозинемия — это заболевание, возникающее из-за дефекта обмена веществ, и, как правило, является врожденным, при котором организм не способен эффективно расщеплять аминокислоту тирозин. Основными симптомами этой болезни является поражение печени и почек, а также умственная отсталость. При отсутствии лечения тирозинемия имеет летальный исход.>>> Тирозинемия I типа, также известная как гепаторенальная тирозинемия, является наиболее тяжелой формой тирозинемии. Это заболевание вызвано дефицитом фермента фумарилацетоацетат гидролазы (КФ (шифр классификации фермента) 3.7.1.2).
>>> Тирозинемия II типа(также известная как «глазокожная тирозинемия«, или «синдром Ричнера-Хангарта«) является аутосомно-рецессивным заболеванием, которое начинает развиваться в возрасте от 2 до 4 лет, когда в области акупунктурных точек (ладоней и ступни) появляются болезненные мозоли.
>>>
| ||
Нарушения обмена аминокислот | Интернет-издание «Новости медицины и фармации»
Различают наследственные и приобретенные нарушения обмена аминокислот. Наибольшая скорость обмена аминокислот наблюдается в нервной ткани. По этой причине в психоневрологической практике различные наследственные аминоацидопатии считаются одной из причин слабоумия. Гидролиз белков в желудке происходит при превращении в кислой среде пепсиногена в пепсин. Пепсин расщепляет связи между ароматическими аминокислотами, соседствующими с карбоксильными аминокислотами. Пепсин инактивируется в щелочной среде. Этот этап переваривания белков отсутствует у больных после гастрэктомии, у больных, длительно принимающих ингибиторы Na-K-АТФазы, например омепразол. Расщепление пептидов пепсином прекращается после поступления химуса в тонкую кишку.
В тонкой кишке полипептиды подвергаются дальнейшему расщеплению протеазами, которые содержатся в соке поджелудочной железы и на поверхности ворсинок энтероцитов. Основное расщепление пептидов осуществляют панкреатические ферменты: трипсин, химотрипсин, эластаза, карбоксипептидазы А и В. Трипсин расщепляет полипептидные цепочки в местах соединения основных аминокислот (лизина, аргинина), в то время как химотрипсин разрушает связи ароматических аминокислот (фенилаланина, тирозина, триптофана). Эластаза расщепляет связи алифатических пептидов. При протеолизе, осуществляемом панкреатическими ферментами, происходит отщепление олигопептидов и некоторых свободных аминокислот. Микроворсинки энтероцитов имеют на своей поверхности эндопептидазы и экзопептидазы, расщепляющие олигопептиды до аминокислот и ди-, трипептидов. Всасывание ди- и трипептидов осуществляется с помощью активного транспорта. Эти продукты затем расщепляются до аминокислот внутриклеточными пептидазами энтероцитов. Аминокислоты абсорбируются по принципу механизма котранспорта с натрием на апикальном участке мембраны. Существуют как минимум пять
симпортов Na/аминокислота, которые различаются по типам переносимых аминокислот: нейтральный транспорт (переносящий нейтральные аминокислоты), основной (переносящий аргинин, лизин, гистидин), дикарбоксильный (транспортирующий глутамат, аспартат), гидрофобный (транспортирующий фенилаланин, метионин) и иминотранспорт (переносящий пролин, гидроксипролин).
Описаны наследственные нарушения функции отдельных переносчиков аминокислот, приводящие к дефициту этих аминокислот. Другой причиной дефицита аминокислот в организме являются различные нарушения в работе ферментов.
Энзимопатии — общее название болезней или патологических состояний, развивающихся вследствие отсутствия или снижения активности тех или иных ферментов. Выделяют наследственные энзимопатии, в основе которых лежит генетически обусловленная недостаточность одного или нескольких ферментов, и приобретенные энзимопатии, развивающиеся как следствие различных болезней, чаще хронических. Описаны следующие варианты нарушений активности ферментов:
— полная блокада (выключение) синтеза фермента;
— снижение активности фермента;
— нарушение систем или биохимических реакций, от которых зависит активность фермента.
Особенностью течения наследственных энзимопатий является наличие так называемого скрытого периода, когда болезнь клинически не проявляется, но может быть заподозрена или установлена на основании биохимических исследований крови, мочи, кала. Первые клинические симптомы наследственных энзимопатий обычно обнаруживаются в раннем детском возрасте, но в ряде случаев болезнь может длительное время протекать бессимптомно и клинически проявляется у детей старшего возраста или у взрослых. Многочисленные патологические состояния, обусловленные дефицитом одного или нескольких ферментов, характеризуются большим разнообразием течения, прогноз их различен.
Рассмотрим нарушение обмена аминокислот на примере тирозина и метионина.
Тирозин — α-амино-β-(n-оксифенил)-пропионовая кислота, является заменимой ароматической одноосновной аминокислотой. Тирозин входит в состав молекул белков, в том числе ферментов, служит биосинтетическим предшественником катехоламинов (диоксифенилаланина, дофамина, адреналина, норадреналина, меланинов, тирамина), а также многих белково-пептидных гормонов, в частности гормонов щитовидной железы (тироксина и трийодтиронина), являясь йодированным компонентом специфического белка щитовидной железы тиреоглобулина. Недостаточность тирозина в организме ведет к нарушению синтеза белков, катехоламинов и др. Нарушение обмена тирозина обнаруживают при заболеваниях печени и почек, алкоголизме, меланоме, а также при наследственной патологии (тирозиноз, алкаптонурия, альбинизм).
Альбинизм — врожденная аномалия обмена тирозина. При этом нарушается выработка фермента тирозиназы, вследствие чего происходит блок превращения диоксифенилаланина (ДОФА) в меланин. У альбиносов образование и обмен адреналина не нарушаются, поэтому трудно предположить, что обмен тирозина тормозится на более ранних стадиях превращения (до стадии образования ДОФА).
Вместе с тем наблюдают и такое патологическое состояние, при котором усиленно образуется меланин. Так, в процессе развития злокачественной опухоли — меланомы — значительная часть тирозина и фенилаланина используется клетками для синтеза меланина. Возникает дефицит этих аминокислот, что вызывает нарушение белкового обмена.
Алкаптонурия — заболевание, обусловленное аутосомно-рецессивным дефектом синтеза гомогентизиновой кислоты. При нормальных условиях фермент n-оксифенилпируватоксигеназа (вместе с витамином С) превращает n-оксифенилпируват, образованный из тирозина, в гомогентизиновую кислоту. В почках гомогентизиновая кислота превращается в 4-метилацетоуксусную кислоту. Если по каким-то причинам этот процесс тормозится, то накопление гомогентизиновой кислоты приводит к образованию хиноновых полифенолов (охронозных ферментов), которые выводятся почками и обусловливают темную окраску мочи. Гомогентизиновая кислота ингибирует фермент лизилгидроксилазу, из-за чего происходит нарушение синтеза коллагена, а охронозный фермент алкаптон не полностью выводится с мочой и откладывается в хрящевой и других видах соединительной ткани, вызывая их хрупкость. Такие изменения часто приводят к кальцификации и дегенеративному артриту позвоночника, суставов конечностей, пигментации склер и хрящей ушных раковин и др. Заболевание можно выявить в раннем детском возрасте (моча быстро темнеет на воздухе).
Тирозиноз Медеса — заболевание, при котором нарушена активность n-оксифенилпируватоксигеназы или печеночной тирозинаминотрансферазы. В отличие от алкаптонурии при этой патологии в печени вообще не образуется гомогентизиновая кислота. Развиваются печеночная недостаточность и нефропатия, тяжелые формы миастении.
Наследственная тирозинемия — заболевание, которое связано с недостаточностью или отсутствием ферментов парагидроксифенилпируватоксидазы (синтезируется в печени и почках) и тирозинтрансаминазы (вырабатывается только в печени). Данные ферменты играют важную роль в катаболизме фенилаланина путем образования тирозина. Заболевание наследуется по аутосомно-рецессивному типу.
По течению выделяют острую и хроническую формы болезни. Больные с острой формой заболевания умирают в первые месяцы жизни. Хроническая форма медленно прогрессирует с развитием тяжелого поражения печени и почек. В печени развиваются стеатоз, диффузный фиброз. У детей старшего возраста формируется цирроз печени с пролиферацией желчных протоков.
Для клинической картины данного заболевания характерно отставание в умственном и физическом развитии, анорексия, рвота, поносы, желтуха, увеличение размеров печени и селезенки, асцит, отеки вплоть до анасарки, кровоточивость, развитие рахита.
При хроматографическом исследовании аминокислот сыворотки крови выявляют гипертирозинемию, в ряде случаев — повышение содержания метионина.
Частым осложнением данного заболевания является гигантоклеточная трансформация гепатоцитов. Более чем у 1/3 больных с хронической тирозинемией развивается гепатоцеллюлярная карцинома.
Лечение состоит в назначении диеты, бедной фенилаланином и метионином. Показано назначение больших доз витамина D (10 000–15 000 ЕД/сут).
Метионин (α-амино-γ-метилтиомас-ляная кислота) — незаменимая для человека кислота, входящая в состав многих белков. Метионин необходим для осуществления реакций трансметилирования, участвующих в биосинтезе креатина, холина, адреналина и других биологически активных веществ, а также в обезвреживании различных токсических метаболитов. Метионин всасывается в тонкой кишке и поступает в печень, где подвергается основным превращениям. Основной путь обмена метионина проходит через образование цистеина. Недостаток метионина сопровождается серьезными нарушениями обмена веществ, в первую очередь обмена липидов, и является причиной тяжелых поражений печени, в частности ее жировой инфильтрации. Нарушения обмена метионина в организме человека связаны в основном с наследственными энзимопатиями, которые характеризуются полным отсутствием или недостаточностью ферментов, участвующих в его превращениях.
Гомоцистинурия — наследственное заболевание, обусловленное нарушением обмена метионина и связанное с отсутствием L-серин-дегидратазы в печени. У этих больных в тканях накапливается избыток метионина и гомоцистеина, уменьшается концентрация цистатионина и цистина в крови и моче. Повышенное содержание в крови и тканях метаболитов метионина оказывает токсическое влияние на нервную систему. Клиническая картина заболевания характеризуется задержкой психомоторного развития; дети поздно начинают сидеть, ходить, говорить. Больные легковозбудимы, раздражительны. Интеллектуальное развитие, как правило, снижено. Возможны судороги, гиперкинезы. Изменения скелета у многих сходны с изменениями при синдроме Марфана (высокий рост, арахнодактилия, кифосколиоз, деформации грудной клетки). Сходство дополняется общим для этих двух заболеваний поражением глаз. Частым проявлением гомоцистинурии является эмболия сосудов легких, почечных артерий, тромбоз артерий или вен. Значительны изменения двигательной сферы: мышечная гипотония, разболтанность суставов. Изредка отмечаются пирамидные расстройства (спастические явления, повышение сухожильных рефлексов с расширением рефлексогенной зоны). Часты разнообразные вегетативно-трофические симптомы: гипергидроз, сухость кожи, акроцианоз и др.
При недостаточности фермента, активирующего метионин, клинические проявления сходны с тирозинемией. У больных наблюдается увеличение печени и селезенки с развитием мелкоузлового цирроза.
Нарушение белкового обмена — Справочник химика 21
Недостаточность витамина С может быть экзогенной из-за дефицита аскорбиновой кислоты в пище и эндогенной, обусловленной нарушениями процессов всасывания и функционирования ее в организме. Основными признаками С-авитаминоза являются нарушения белкового обмена, особенно фибриллярных белков. В результате возможны изменения межклеточных взаимодействий, патологическое увеличение проницаемости сосудов, кровоточивость десен, разрушение и выпадение зубов. Отмечены нарушения углеводного обмена, в частности в результате подавления каталитической активности ферментов обмена глюкозы. Что касается липидного обмена, то при С-авитаминозе снижен синтез желчных кислот из холестерина и отмечено увеличение его концентрации в плазме крови. При дефиците витамина С у че- [c.128]Несмотря на то что в состав белков человеческого организма и вхог дят все аминокислоты, перечисленные в табл. 14.1, однако отнюдь не все они должны обязательно содержаться в пище. Экспериментально доказано, что для человека существенное значение имеют девять аминокислот. Такими незаменимыми аминокислотами являются гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Все остальные аминокислоты, которые называют зал1еныл1ьши аминокислотами, человеческий организм способен вырабатывать сам. Минимальные количества аминокислот, необходимые человеку в молодости, были установлены американским биохимиком У. Ч. Роузом. Ерли ежесуточное поступление в организм человека любой из восьми указанных аминокислот (за исключением гистидина) окажется ниже определенного уровня, то организм человека будет выделять больше соединений азота, нежели получать их с пищей белки в его организме станут распадаться быстрее, чем синтезироваться. Потребность молодых людей в аминокислотах колеблется в пределах двукратной дозы, например 0,4—0,8 г лизина в сутки. Минимальная потребность по Роузу представляет собой наибольшую величину для любого из наблюдаемых им лиц. Нет сомнений в том, что каждый человек отличается от другого своими генетическими особенностями, а следовательно, и своими биохимическими характеристиками. Данные, приведенные в табл. 14.2, вдвое превышают значения, установленные Роузом. Предположительно эти количества вполне достаточны для предотвращения нарушений белкового обмена для большинства людей (99%). Потребности женщин составляют приблизительно две трети от количеств, указанных для мужчин. [c.389]
ВИТАМИН Вб (пиридоксин, встречается также название адермин). Не разрушается при нагревании, но легко разрушается на свету. Нри недостатке витамина происходят нарушения белкового обмена, в ряде случаев проявляющиеся в поражении кожи (дерматиты), понижается продуктивность животных, замедляется рост, у свиней наблюдаются явления анемии. Для животных источником витамина являются соевая мука, мелясса, молочные и мясные продукты, рыбные отходы, люцерна, дрожжи, рисовые отруби. У жвачных животных синтезируется микрофлорой рубца. Синтезируется химическим путем. Суточная потребность в витамине составляет на 1 кг корма у свиней—1—2, у кур —1—2, у цыплят — 5—10 мг. [c.58]
Применяется при нарушениях белкового обмена и как общий стимулятор обменных процессов (например, при заболеваниях печени) [c.252]
O.K. в виде оротата калия применяют в медицине при заболеваниях сердца, печени и др. случаях, связанных с нарушением белкового обмена. [c.411]
Следует отметить, что окислительный распад фенилаланина и тирозина представляет особый интерес в связи с тем, что многие врожденные нарушения белкового обмена связаны именно с обменом этих аминокислот, например наследственная болезнь фенилкетонурия (фенилпировиноградная олигофрения). Причиной этого заболевания является потеря способности организма синтезировать фермент фенилаланин-4-монооксигеназу, катализирующую пре-врашение фенилаланина в тирозин. Это приводит к накоплению фенилаланина в тканях, а следовательно, и продуктов его трансаминирования фенилпировиноградной и фенилуксусной кислот, оказывающих токсическое действие на организм, и в первую очередь на ЦНС, вызывая расстройство психической деятельности человека. [c.382]
Нарушение белкового обмена [c.407]
Недостаток в организме пиридоксаля — биохимического предшественника пиридоксальфосфата — вызывает ряд нарушений белкового обмена [c.914]
Одновременно или несколько позже у некоторых подопытных животных отмечались дистрофические изменения в ряде внутренних органов. Так, в клетках печени, бронхиального дерева, поджелудочной железы и почек обнаруживалось мутное и зернистое перерождение цитоплазмы, свидетельствующее о преимущественном нарушении белкового обмена. В начальном периоде воздействия в легких развиваются воспалительные процессы. [c.177]
При поражении надпочечников наблюдаются также изменения в белковом и водно-солевом обмене. Нарушение белкового обмена ведет к уменьшению выделения [c.145]
Гефтер Ю. М. Нарушение белкового обмена при различных патологических состояниях. Успехи биологической химии, 1950, т. I, стр. 242. [c.377]
Соединения Zn, d, Hg могут вызывать нарушение белкового обмена, что проявляется в выделении белков плазмы через почки (протеинурия). [c.298]
Следствием действия ионизирующего облучения является нарушение минерального обмена, обмена липидов, белков, блокирование окислительного фосфорилирования, изменение проницаемости клетки. В результате нарушения белкового обмена резко понижается сопротивляемость организма к инфекционным заболеваниям. [c.479]
При недостатке витамина Вб в организме животных происходят глубокие нарушения белкового обмена, сопровождающиеся в ряде случаев гангреной пальцев и специфическим поражением кожи (дерматит). Это заболевание напоминает дерматит при пеллагре, но он не поддается лечению никотиновой кислотой. [c.175]
Уровень свободных аминокислот в биологических жидкостях организма — важная характеристика, позволяющая определять наличие нарушений азотистого обмена в организме. Как следует из данных, представленных в табл. 12.8, аминокислотный состав мочи резко отличается от аминокислотного состава плазмы крови. Поэтому если содержание аминокислот в плазме крови у среднестатистического человека относительно постоянно, а содержание в моче имеет отклонения от нормы, то это первый признак нарушений белкового обмена в организме. [c.394]
Нарушение белкового обмена в печени в общих чертах отражает развивающуюся картину лучевого поражения. В частности, это видно по изменению активности ферментов автолиза активация ферментов в фазах первичной реакции и выраженных клинических изменений и снижение активности, временная нормализация — в латентную фазу. [c.196]
Биологическая роль витамина Вгл связана с тем, что он является важнейшим биосинтетическим предшественником пиримидиновых нуклеотидов потребность в нем человеческого организма довольно велика 1 —1,5 г/сут. Обычно недостатка в оротовой кислоте, которая биосинтезируется из аспарагиновой кислоты, в организме человека не ощущается. Но К-соль оротовой кислоты широко используется в медицинской практике при заболеваниях, связанных с нарушениями белкового обмена, для нормализации функций печени, при инфарктах миокарда и других сердечно-сосудистых заболеваниях, а также пр И длительном применении стероидных гормонов и для ускорения адаптации к гипоксии кроме того, она является и выраженным анаболиком. [c.682]
В нормальных растениях при помощи АТФ свободные аминокислоты переходят в аминоациладенилат. Это первый этап синтеза белка. Затем с помощью информационной РНК (образовавшейся здесь системой — аденозинофосфат+аминоацил РНК) происходит переброска активированных аминокислот в рибосомы. На рибосомах Идет синтез белка. В обработанных гербицидами растениях происходит нарушение белкового обмена. Об этом можно судить по данным табл. 4. [c.13]
Хроническое отравление. Животные. При ингаляции паров В. в концентрации 1044 мг/м по 6 ч в день в течение 4 мес. у крыс и кроликов уменьшается прирост массы тела, сначала лейкоцитоз, а затем лейкопения с нейтропенией, снижение НЬ, нарушение белкового обмена (увеличение количества общего белка в сыворотке крови за счет а- и aj-глобулинов) у крыс снижается активность холинэстеразы в мозговой ткани. На вскрытии венозное полнокровие и умеренно выраженные явления зернистой дистрофии в паренхиматозных органах, у части животных — десквама-тивный бронхит. [c.98]
Пиридоксальфосфат замечателен тем, что с его участием протекает множество различных ферментативных реакций. Почти все эти реакции связаны с превращениями аминокислот. В исследованиях по физиологии питания животных и в опытах на микроорганизмах было показано, что недостаточность пиридоксаля (пиридоксина) — биохимического предшественника пиридоксальфосфата — вызывает ряд нарушений белкового обмена. Первые сведения о реакциях, для которых необходим пиридоксальфосфат, были получены в 1934 г., когда обнаружилось, что с помощью особого пищевого фактора можно излечить специфический дерматит, вызванный у молодых крыс неполноценной диетой. Дьёрди назвал этот фактор витамином Bg. (В настоящее время этот термин употребляется для обозначения целой группы биологически важных веществ, структурно родственных пиридоксальфосфату.) Было установлено, что витамин Ве представляет собой 3-окси- [c.219]
Изучая изменения в обмене веществ у гороха под влиянием реакции (pH) внешнего раствора, М. М. Гукова (1950) нашла, что при pH 4,2 задерживался синтез белка. При pH 8 отмечалось снижение содержания редуцирующих сахаров. Н. С. Авдонин с сотрудниками (1954) также установил нарушение белкового обмена в растительном организме на кислых почвах. Он выявил, кроме того, что кислая реакция среды препятствует образованию сложцых сахаров. [c.62]
Отмирание пораженных филлоксерой ткапей неустойчивого сорта винограда в значительной мере связано с тем, что нарушение обмена нуклеиновых кислот приводит к глубокому нарушению белкового обмена [5] ив конечном счете к летальному исходу. В таких условиях феллоген в пораженных тканях образоваться не может, на толстых корнях образуются большие открытые раны, а мочковатые корешки гибнут полностью. [c.142]
При и.чбыточном содержании мелив организме (ге-патолентикулярная дегенерация) отмечается нарушение белкового обмена и обмена меди, как показали многие [c.242]
Нарушение белкового обмена клеток, по Мег1еуе(1е (1956), при интоксикации бензолом может привести к денатурации белка и проявлению антигенных свойств лейкоцитов. [c.149]
Пиридоксин (витамин В ) Нарушения белкового обмена, синтеза катехоламинов, гистамина, дофамина, ГАМК, микроцитарная анемия [c.280]
Показания. Нарушения белкового обмена при кахексии различного генеза, астения, остеопороз, хронические заболевания печени и почек, период реконвалесценции после тяжёлых травм, операций, ожогов, тяжёлые инфекционные заболевания, сопровождающиеся потерей белка, диабетическая ретинопатия, прогрессивная мышечная дистрофия, синдром Вердни-га-Хоффмана, рак молочных желёз, апластические анемии, коррекция катаболических эффектов глюкокортикоидов. [c.388]
нарушение обмена веществ | Определение, происхождение, типы и факты
Болезнь обмена веществ , любое заболевание или расстройство, нарушающее нормальный обмен веществ, процесс преобразования пищи в энергию на клеточном уровне. Тысячи ферментов, участвующих во множестве взаимозависимых метаболических путей, осуществляют этот процесс. Метаболические заболевания влияют на способность клетки выполнять важные биохимические реакции, которые включают переработку или транспорт белков (аминокислот), углеводов (сахаров и крахмалов) или липидов (жирных кислот).
Британская викторина
Болезни, расстройства и многое другое: медицинская викторина
Какое состояние вызвано отложением солей мочевой кислоты? Как еще называют перелом костей? Узнайте, что вы знаете о болезнях, расстройствах и многом другом.
Болезни обмена веществ обычно передаются по наследству, но большинство людей, страдающих ими, могут выглядеть здоровыми в течение нескольких дней, месяцев или даже лет.Симптомы обычно появляются, когда метаболизм в организме подвергается стрессу, например, после длительного голодания или во время лихорадочного заболевания. При некоторых нарушениях обмена веществ можно пройти пренатальный диагностический скрининг. Такой анализ обычно предлагается семьям, у которых ранее был ребенок с нарушением обмена веществ или которые принадлежат к определенной этнической группе. Например, тестирование на болезнь Тея-Сакса относительно распространено среди еврейского населения ашкенази. Страны, которые проводят скрининг на метаболические заболевания при рождении, обычно проверяют до 10 различных состояний.Тандемная масс-спектрометрия — это новая технология, которая позволяет обнаруживать несколько аномальных метаболитов почти одновременно, что позволяет добавить около 30 расстройств к списку состояний, на которые могут быть проверены новорожденные. Если известно, что у младенца нарушение обмена веществ вскоре после рождения, соответствующая терапия может быть начата раньше, что может улучшить прогноз. Некоторые нарушения обмена веществ очень хорошо поддаются лечению, если лечение начинается в раннем возрасте. Однако у других нет эффективной терапии и они вызывают серьезные проблемы, несмотря на раннюю диагностику.В будущем генная терапия может оказаться успешной в лечении некоторых из этих заболеваний.
Заболевания обмена веществ довольно редки по отдельности, но относительно часто, если рассматривать их в группе. Частота конкретных метаболических нарушений варьируется от примерно 1 на 500 (или даже выше в изолированных популяциях) до менее 1 на 1000000. Было подсчитано, что в группе нарушения обмена веществ затрагивают примерно 1 из 1000 человек.
Истоки нарушения обмена веществ
Метаболические пути
В 1908 году британский врач сэр Арчибальд Гаррод предположил, что четыре унаследованных пожизненных состояния — алкаптонурия, пентозурия, альбинизм и цистинурия — были вызваны дефектами определенных биохимических путей из-за пониженной активности или полного отсутствия данного фермента.Он назвал эти расстройства «врожденными нарушениями обмена веществ». Хотя Гаррод ошибался в категоризации цистинурии, его идеи предоставили области биохимической генетики прочную основу, и список унаследованных врожденных ошибок метаболизма быстро увеличивался. Эта статья в первую очередь касается этих наследственных метаболических заболеваний, хотя другие нарушения, включая эндокринные заболевания (например, сахарный диабет и гипотиреоз) и недоедание (например, маразм и квашиоркор), также влияют на клеточный метаболизм.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасПища расщепляется клеточными ферментами (белками, которые катализируют превращение соединений, называемых субстратами) в несколько этапов в продукты с другой биохимической структурой. Затем эти продукты становятся субстратом для следующего фермента метаболического пути. Если фермент отсутствует или имеет пониженную активность, путь блокируется, и образование конечного продукта оказывается недостаточным, что приводит к заболеванию.Низкая активность фермента может привести к последующему накоплению субстрата фермента, который может быть токсичным при высоких уровнях. Кроме того, незначительные метаболические пути, которые обычно находятся в спящем состоянии, могут активироваться при накоплении субстрата, возможно, с образованием атипичных, потенциально токсичных продуктов. Каждая клетка в организме содержит тысячи метаболических путей, все из которых в той или иной степени взаимосвязаны, так что единичная блокада может повлиять на множество биохимических процессов.
Последствия метаболического дисбаланса могут быть серьезными; умственная отсталость, судороги, снижение мышечного тонуса, органная недостаточность, слепота и глухота могут возникнуть в зависимости от того, какой фермент дисфункциональный.В последние годы стало очевидно, что даже некоторые состояния, связанные с множественными врожденными аномалиями (например, синдром Смита-Лемли-Опица), имеют метаболическую причину.
Нарушение белкового обмена | Что делать, если нарушен белковый обмен?
Белки — важнейшие биологические вещества живых организмов. Они служат пластическим материалом, из которого построены клетки, ткани и органы человеческого тела. Белки являются основой гормонов, ферментов, антител и других объектов, которые выполняют сложные функции в жизни человека (пищеварение, рост, размножение, иммунитет и т. Д.).), способствуют нормальному обмену в организме витаминов и минеральных солей. Белки участвуют в образовании энергии, особенно в период больших энергетических затрат или когда в рационе не хватает углеводов и жиров. Энергетическая ценность 1 г белка составляет 4 калории (16,7 кДж).
При недостатке белка в организме наблюдаются серьезные нарушения роста и развития детей, изменения в печени взрослых, активности желез внутренней секреции, состава крови, ослабление умственной деятельности, снижение работоспособности и сопротивляемости инфекционным заболеваниям. болезни.
При каких заболеваниях наблюдается нарушение белкового обмена
Поскольку белки занимают центральное положение в реализации процессов жизнедеятельности организма, и нарушения белкового обмена в различных вариантах являются составляющими патогенеза всех без исключения патологических процессов. Для полного представления об обмене белков человека на основе концепции азотного баланса. В норме у взрослого человека количество азотистых веществ, выводимых из организма, равно тому, которое он получает с пищей.В растущем организме во время беременности, при введении или превышении выработки гормонов анаболического действия, при кормлении после изнуряющих болезней азота выделяется меньше, чем поступает, т.е. анаболические процессы преобладают над катаболическими (положительный азотистый баланс). Отрицательный баланс азота имеет место при потере белков или большом потреблении их организмом. Это может происходить из-за голодания, потери белков через почки (протеинурия), кожи (ожоги), толстой кишки (диарея), тиреотоксикоза, инфекционной лихорадки.
Нарушение белкового обмена возможно на всех стадиях, начиная с отсасывания и заканчивая выведением из организма конечных продуктов обмена. В такой последовательности эти нарушения будут рассмотрены ниже.
I. Нарушения всасывания и синтеза белков
Так как в организме практически отсутствуют депо-белки, а исходные аминокислоты для их синтеза используются в основных компонентах пищи, то, естественно, с нарушением пищеварения и всасывание белков приводит к дефициту пищевых белков.Наблюдается при воспалительных и дегенеративных изменениях различных отделов кишечника, сопровождающихся нарушением их секреторной и двигательной функций, при голодании, плохо сбалансированном аминокислотном составе пищи.
Однако для нормального синтеза белков необходимо не только достаточное количество аминокислот, но и правильное и активное функционирование системы синтеза и кодирования ее генетических структур. Нарушение белковой продукции может быть приобретенным или наследственным.Это выражается в изменении количества синтезируемых молекул или появлении молекул с разной структурой.
Увеличение или уменьшение количества синтезируемого белка часто связано с изменением регулирующих влияний со стороны ряда гормонов, нервов и иммунной системы. Помимо нарушения протеосинтеза может вызвать конденсацию хроматина при различных патологических процессах в клетках, фиксированную скорость обмана матричной РНК при нарушении функционирования гена-регулятора или оператора (в опухолевых клетках), а также дефекты в структуре рибосом, возникающих, например, под действием стрептомицина.
Синтез белков с разной структурой обычно является результатом ошибок в геноме. Это может быть нарушение аминокислотного состава белковой молекулы (например, молекулы гемоглобина при серповидно-клеточной анемии), укорочение молекул транскрипции (когда информация из ДНК-матрицы сводится только к ее дефекту). ), а также синтез аномально длинных белков, если мутация произошла в гене «стоп-сигнала» и терминирующий кодон исчез.Примером этого является появление длинных альфа-глобиновых цепей. нарушение белкового обмена —
Белки — важнейшие биологические вещества живых организмов. Они служат пластическим материалом, из которого построены клетки, ткани и органы человеческого тела. Белки являются основой гормонов, ферментов, антител и других сущностей, которые выполняют сложные функции в жизни человека (пищеварение, рост, размножение, иммунитет и т. Д.), Способствуют нормальному обмену в организме витаминов и минеральных солей.Белки участвуют в образовании энергии, особенно в период больших энергетических затрат или когда в рационе не хватает углеводов и жиров. Энергетическая ценность 1 г белка составляет 4 калории (16,7 кДж).
При недостатке белка в организме наблюдаются серьезные нарушения роста и развития детей, изменения в печени взрослых, активности желез внутренней секреции, состава крови, ослабление умственной деятельности, снижение работоспособности и сопротивляемости инфекционным заболеваниям. болезни.
При отсутствии заболеваний происходит нарушение белкового обмена:
Поскольку белки занимают центральное положение в реализации процессов жизнедеятельности организма, а нарушения белкового обмена в различных вариантах являются составляющими патогенеза всех без исключения патологических процессов. Для полного представления об обмене белков человека на основе концепции азотного баланса. В норме у взрослого человека количество азотистых веществ, выводимых из организма, равно тому, которое он получает с пищей.В растущем организме при беременности, при введении или избытке продукции гормонов анаболическое действие, при откорме после изнуряющих болезней азота выделяется меньше, чем наступает, т.е. анаболические процессы преобладают над катаболическими (положительный азотистый баланс). Отрицательный баланс азота имеет место при потере белков или большом потреблении их организмом. Это может происходить из-за голодания, потери белков через почки (протеинурия), кожи (ожоги), толстой кишки (диарея), тиреотоксикоза, инфекционной лихорадки.
Нарушение белкового обмена возможно на всех стадиях, начиная с отсасывания и заканчивая выведением из организма конечных продуктов обмена. В такой последовательности эти нарушения будут рассмотрены ниже.
I. Нарушения всасывания и синтеза белков
Так как в организме практически отсутствуют депо-белки, а исходные аминокислоты для их синтеза используются в основных компонентах пищи, то, естественно, с нарушением пищеварения и всасывание белков приводит к дефициту пищевых белков.Наблюдается при воспалительных и дегенеративных изменениях различных отделов кишечника, сопровождающихся нарушением их секреторной и двигательной функций, при голодании, плохо сбалансированном аминокислотном составе пищи.
Однако для нормального синтеза белков необходимо не только достаточное количество аминокислот, но и правильное и активное функционирование системы синтеза и кодирования ее генетических структур. Нарушение белковой продукции может быть приобретенным или наследственным.Это выражается в изменении количества синтезируемых молекул или появлении молекул с разной структурой.
Увеличение или уменьшение количества синтезируемого белка часто связано с изменением регулирующих влияний со стороны ряда гормонов, нервов и иммунной системы. Помимо нарушения протеосинтеза может вызвать конденсацию хроматина при различных патологических процессах в клетках, фиксированную скорость обмана матричной РНК при нарушении функционирования гена-регулятора или оператора (в опухолевых клетках), а также дефекты в структуре рибосом, возникающих, например, под действием стрептомицина.
Синтез белков с разной структурой обычно является результатом ошибок в геноме. Это может быть нарушение аминокислотного состава белковой молекулы (например, молекулы гемоглобина при серповидно-клеточной анемии), укорочение молекул транскрипции (когда информация из ДНК-матрицы сводится только к ее дефекту). ), а также синтез аномально длинных белков, если мутация произошла в гене «стоп-сигнала» и терминирующий кодон исчез.Примером этого является появление длинных альфа-глобиновых цепей. Продукция белков с разной структурой также может быть следствием нарушения одного из звеньев системы синтеза белков — машинной трансляции или посттрансляционной модификации молекул. С увеличением частоты ошибок перевода в жизненном процессе связано старение организма.
II. Обмен аминокислот
Нарушение переаминирования и окислительного дезаминирования. Процессы трансаминирования и дезаминирования имеют универсальное значение для всех живых организмов и всех аминокислот: трансаминирование приводит к образованию аминокислот, дезаминирование — к их разрушению.
Суть реакции трансаминирования заключается в обратимом переносе аминогруппы аминокислот на α-кетокислоту без промежуточного образования свободного аммиака. Реакцию катализируют специфические ферменты: аминотрансфераза или трансаминазы, кофакторы, которые представляют собой фосфорилированные формы пиридоксина (пиридоксаль и пиридоаминофосфат).
Нарушение реакции трансаминирования может происходить по нескольким причинам: это прежде всего пиридоксин (беременность, подавление сульфаниламидными препаратами кишечной флоры, частичный синтез витаминов, угнетение синтеза пиридоксаля на фоне лечения фтивазидом).Снижение активности трансаминаз также является ограничением синтеза белка (голодание, тяжелые заболевания печени). Если в отдельных органах возникает некроз (инфаркт миокарда или легочной артерии, панкреатит, гепатит и др.), В результате разрушения ткани трансаминазы попадают в кровь и повышают свою активность в крови при данной патологии является одним из диагностических критериев. тесты. В изменении скорости трансаминирования значительную роль играет нарушение соотношения субстратных реакций, а также гормонов, в частности глюкокортикоидов и гормона щитовидной железы, оказывающего стимулирующее влияние на этот процесс.
Угнетение окислительного дезаминирования, приводящее к накоплению неиспользованных аминокислот, может увеличивать концентрацию аминокислот в крови — гипераминоацидемия. Следствием этого является повышенное выведение аминокислот почками (ацидаминурия) и изменение соотношения отдельных аминокислот в крови, создавая неблагоприятные условия для синтеза белковых структур. Нарушение дезаминирования происходит при недостатке компонентов, прямо или косвенно участвующих в этой реакции (недостаток пиридоксина, рибофлавина, никотиновой кислоты; гипоксия; белково-энергетическая недостаточность при голодании).
Нарушения декарбоксилирования. Являясь очень важным, хотя и не универсальным, направлением белкового обмена, декарбоксилирование протекает с образованием СО2 и биогенных аминов. Декарбоксилированием подвергаются лишь некоторые аминокислоты: гистидин — с образованием гистамина, тирозин — тирамин, 1-глутаминовая кислота — γ-аминомасляная кислота, 5-гидрокситриптофан — серотонин, производные тирозина (3,4-l-DOPA) и цистин. (1-цистеиновая кислота), 3,4-диоксид фенилэтиламина (дофамин) и таурин.
Биогенные амины, как известно, обладают особой биологической активностью и увеличение их количества может вызвать ряд патологических явлений в организме. Причиной такого увеличения может быть не только усиление декарбоксилирования соответствующих аминокислот, но и угнетение окисления аминов и нарушение их связывания с белками. Так, например, в условиях гипоксии ишемия и разрушение тканей, травмы, облучение и т. Д.) Ослабляют процессы окисления, что способствует усилению декарбоксилирования.Появление в тканях большого количества биогенных аминов (особенно гистамина и серотонина) может вызвать значительное нарушение местного кровообращения, повышение проницаемости сосудов и повреждение нервного аппарата.
Наследственные нарушения обмена некоторых аминокислот. Прохождение аминокислот через определенный метаболический путь определяется присутствием и активностью соответствующих ферментов. Наследственное нарушение синтеза ферментов приводит к тому, что соответствующая аминокислота не включается в обмен веществ, а накапливается в организме и появляется в биологических средах: моча, кал, пот, спинномозговая жидкость.Клиническая картина этого заболевания определяется, во-первых, появлением слишком большого количества веществ, которые должны метаболизироваться с участием заблокированного фермента, и, во-вторых, дефицитом вещества, которое должно было образоваться.
Обмен фенилаланина. Фенилаланин в норме необратимо окисляется в тирозин. Если в печени нарушается синтез фермента фенилаланина, окисление фенилаланина идет по пути образования фенилпировиноградной и фенилмолочной кислот — развивается фенилкетонурия.Однако этот путь имеет малую пропускную способность и поэтому фенилаланин в больших количествах накапливается в крови, тканях и спинномозговой жидкости, что в первые месяцы жизни приводит к тяжелому поражению центральной нервной системы и запущенной форме слабоумия. Из-за отсутствия синтеза тирозина уменьшается образование меланина, что приводит к осветлению кожи и волос. Кроме того, при повышенной выработке фенилпировиноградная кислота подавляла активность фермента (дофамингидроксилазы), необходимого для образования катехоламинов (адреналина и норадреналина).Поэтому тяжесть наследственных заболеваний определяется комплексом всех этих нарушений.
Установить болезнь можно с помощью следующих анализов: при добавлении в свежую мочу нескольких капель 5% раствора трихлоруксусного железа приобретает оливково-зеленый цвет. Больные умирают в детстве, если не проводится специальное лечение, заключающееся в постоянном, но осторожном (контроль аминокислотного состава крови) ограничении поступления фенилаланина с пищей.
Обмен тирозина.Обмен тирозина осуществляется несколькими способами. При недостаточном превращении тирозина образуется парагидроксифенилпировиноградная кислота в гомогенизат, а также тирозин выводится с мочой. Это нарушение называется тирозинозом. Если задержка окисления тирозина происходит в момент превращения гомогентизиновой кислоты в малеиноацетоуксусную, развивается гомогентизурия. Фермент, окисляющий оксидазу гомогентизиновой кислоты (гомогентизиновая кислота), образуется в печени. В норме гидрохиноновое кольцо так быстро разрывается, что кислота не успевает «появиться в крови», а если и появляется, то быстро выводится почками.При наследственном дефекте этого фермента гомогентизиновая кислота в большом количестве обнаруживается в крови и моче. Моча так и стоит на воздухе, а при добавлении в нее щелочи становится черной. Это связано с окислением гомогентизиновой кислоты кислородом воздуха и образованием в нем алкапона («возбуждающей щелочи»). гомогентизиновая кислота из крови проникает в ткани, хрящи, сухожилия, связки, внутренний слой стенки аорты, вследствие чего появляются темные пятна в области ушей, носа, щек, склеры.Иногда развиваются сильные изменения суставов.
Тирозин, кроме того, является исходным продуктом для образования красящего вещества меланина кожи и волос. Если превращение тирозина в меланин снижено из-за наследственной недостаточности тирозиназы), возникает альбинизм.
Наконец, тирозин является предшественником тироксина. При недостаточном синтезе фермента, катализирующего процесс йодирования тирозина, свободного йода, нарушается образование гормонов щитовидной железы.
Обмен триптофана. Основной путь метаболизма триптофана приводит к синтезу амида никотиновой кислоты, которая играет очень важную роль в жизнедеятельности организма, как простетическая группа ряда окислительных ферментов — никотинамида аденина чинук-леотида (ВВЕРХУ) и его восстановленного образуют никотинамид аденин (НАДФ). Поэтому при недостаточности никотиновой кислоты и ее амида нарушаются многие метаболические реакции, а при дефиците этих веществ развивается пеллагра.
Нарушения метаболизма триптофана могут возникать также при изменении количества вырабатываемого из него серотонина.
III. Нарушения конечных стадий белкового обмена
Патофизиология конечных стадий белкового обмена включает патологию процессов образования азотистых продуктов (мочевины, аммиака, мочевой кислоты) и их удаления из организма. Основным показателем нарушений образования и выброса мочевины и других азотистых продуктов обмена является изменение содержания и состава остаточного (белкового) азота в крови (норма — 20 — 30 мг%).Остальной азот на 50% состоит из азота мочевины, около 25% приходится на аминокислоты, остальное — на другие азотные продукты. Его некарбамидная часть получила название остаточный азот. Повышение остаточного азота в крови — гиперазотемия — может быть результатом нарушения образования мочевины в печени (продукция, или печень, гиперазотемия) и выделительной функции почек (задержка, или почечная, гиперазотемия).
Нарушения образования мочевины наблюдаются при ряде заболеваний (дистрофические изменения печени, гипоксия), а также могут быть вызваны наследственным пороком.Наследственные нарушения мочевинообразования возникают при недостаточном синтезе аргинин-сукцинатлиазы (аргининосукцината), карбамоилфосфатсинтетазы и орнитинкарбамоилтрансферазы (аммониемия) и аргининосукцинат-синтетазы (цитруллинемия).
Наиболее частым результатом синтеза мочевины является накопление аммиака в крови. Количество его может возрастать при резко выраженном нарушении выделительной функции почек. Токсическое действие аммиака было связано, прежде всего, с его влиянием на центральную нервную систему.Он может быть прямым и косвенным. Последний заключается в принудительной нейтрализации аммиака за счет связывания его глутаминовой кислоты. Выключение из-за этого глутаминовой кислоты из обмена проявляется ускорением трансаминирования аминокислот и -кетоглутаровой кислоты, что тем самым отвлекает от участия в цикле трикарбоновой кислоты (цикл Кребса). Седация цикла Кребса приводит к задержке вывода ацетил-КоА, который, превращаясь в кетоновые тела, способствует развитию коматозного состояния.
Нарушения образования и выведения мочевой кислоты. Мочевая кислота — конечный продукт обмена пуриновых оснований, входящий в состав нуклеиновых кислот. Нарушения образования и выведения мочевой кислоты могут наблюдаться при заболеваниях почек, при лейкозах. Однако наиболее выраженные из этих нарушений возникают при подагре.
Подагра была известна еще в древнем мире и описана Гиппократом. Изучение болезни началось в 1860 г., когда Гаррод, сам страдавший подагрой, дал ей классическое описание и обнаружил в крови больных повышенное содержание мочевой кислоты (гиперурикемия).К подагре существует предрасположенность в виде преимущественно наследственного повышения уровня мочевой кислоты в крови и, возможно, изменения факторов, поддерживающих мочевую кислоту в растворенном состоянии. Факторами риска возникновения подагры могут быть чрезмерное поступление пуринов в организм (употребление большого количества мяса, особенно с вином и пивом), чрезмерное поступление молибдена, который входит в состав ксантиноксидазы, выводя ксантин в гипоксантин, который затем превращается в в мочевую кислоту; пол (чаще страдают от мужского, пожилого возраста, для которого характерна возрастная гиперурикемия.
Механизм повышения уровня мочевой кислоты в крови больных не выяснен. Особую роль в этом играют как нарушение разделения мочекислых соединений почек, так и повышенное образование в них глицерина и других предшественников.
Гиперурикемия может сопровождаться отложением солей мочевой кислоты в суставах и хрящах, где из-за плохого кровоснабжения всегда имеется склонность к закислению среды, которая способствует отложению солей в осадке (особенно поддерживающих их дефектных факторов. в растворенном состоянии).Отложение солей вызывает острое подагрическое воспаление, сопровождающееся болью, лихорадкой и аллергическими проявлениями, приводит к образованию подагрических узлов и деформации суставов.
IV. Нарушения белкового состава крови
Изменения количественного и качественного соотношения белков крови наблюдаются практически при всех патологических состояниях, влияющих на организм в целом, а также при врожденных аномалиях синтеза белков. Нарушение содержания белков плазмы крови может выражаться изменением общего количества белков (гипопротеинемия, гиперпротеинемия) или соотношения отдельных белковых фракций (диспротеинемия) при нормальном общем содержании белков.
Гипопротеинемия возникает в основном из-за уменьшения количества альбуминов и может быть приобретенной (при голодании, заболеваниях печени, нарушении всасывания белков) и наследственной. К гипопротеинемии также может приводить выход белков из кровотока (потеря крови, потеря плазмы, экссудация, транссудация) и потеря белка с мочой (протеинурия).
Гиперпротеинемия чаще бывает относительной (тромбы). Абсолютная гиперпротеинемия обычно связана с гиперглобулинемией, как правило, с повышением уровня ин-глобулинов (как компенсаторная реакция с низким содержанием альбумина в крови, повышающим синтез антител).
Диспротеинемия носит приобретенный и наследственный характер. Условно их можно разделить на дисглобулинемию, дис-гаммаглобулинемию и дисиммуноглобулинемию. На краю белковый состав крови — это просто отражение общей перестройки иммунной системы, включая обе клеточные реакции.
Примерами наиболее частой диспротеинемии могут быть увеличение содержания α2-глобулина, снижение α- и β-липопротеидов и нарушения функции печени, изменение количества и структуры гена.Последнее имеет большое практическое значение.
Изменения γ-глобулинов могут быть количественными и качественными. Количественно модифицированный γ-глобулин называют парапротеином. Они относятся к иммуноглобулинам и обычно являются продуктами отдельных клонов клеток, продуцирующих антитела. Увеличение количества крови называется моноклональной гипергаммаглобулинемией и обычно наблюдается при пролиферации соответствующих клонов, чаще всего вызванной неопластическим характером патологического процесса (болезнь миеломная, макроглобулинемия вальденстрема).Разновидностью парапротеинов также являются криоглобулины — патологические белки с особенностями иммуноглобулинов, которые выпадают в осадок при охлаждении.
К каким врачам обращаться при нарушении белкового обмена
- терапевт
- Семейный врач
- Врач-диетолог
У вас нарушение белкового обмена? Хотите узнать более подробную информацию или вам нужен осмотр? Пожалуйста, записывайтесь на прием к врачу ! Врачи осмотрят вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют и окажут необходимую помощь.Также можно вызвать врача на дом.
Вы чувствуете нарушение белкового обмена? Следует очень внимательно относиться к своему здоровью в целом. Люди уделяют недостаточно внимания симптомам болезни и не осознают, что эти заболевания могут быть критически опасными. Есть много болезней, которые вначале не проявлялись в нашем организме, но в итоге оказывается, к сожалению, лечить уже слишком поздно. Каждое заболевание имеет свои характерные особенности и типичные симптомы — симптомов болезни называются .Определение симптомов — это первый шаг в диагностике болезней в целом. Просто нужно несколько раз в год проходить обследование у врача не только для предотвращения страшного заболевания, но и для поддержания здорового духа в теле и организме в целом.
Заболевания по категориям
Заболевания по алфавиту
Карта симптомов и типов расстройств предназначена исключительно для образовательных целей. Настоятельно рекомендуем НЕ заниматься самолечением; По всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу.Md-tips не несет ответственности за последствия использования информации, размещенной на сайте.
Белковый метаболизм | Encyclopedia.com
Определение
Белковый метаболизм — это химический цикл расщепления белка (катаболизм) и использования компонентов для синтеза (анаболизм) новых молекул, которые будут использоваться в организме. Этот процесс также известен как протеометаболизм.
Описание
Белки, жиры и углеводы (называемые макроэлементами) являются частью сложного метаболического цикла, необходимого для жизни.Во время пищеварения пища, содержащая эти питательные вещества, химически расщепляется на основные компоненты и всасывается для использования в организме. Молекулы белков разделяются на их основные строительные блоки, называемые аминокислотами, которые затем химически перестраиваются для синтеза новых белков, необходимых организму. Жиры расщепляются на жирные кислоты и холестерин, а углеводы расщепляются на простые сахара, такие как глюкоза и фруктоза, которые обеспечивают большую часть энергии для запуска химических реакций в организме.Эти более мелкие и простые молекулы всасываются в тонком кишечнике и попадают в систему кровообращения. Затем они проходят через печень, где некоторые из этих «строительных блоков молекул» синтезируются в более сложные соединения, необходимые организму.
Для клеточного метаболизма непрерывно происходят две реакции. Небольшие молекулы превращаются в более крупные молекулы, этот процесс называется анаболизмом или конструктивным метаболизмом, в то время как большие молекулы распадаются на составные части в ходе процесса, называемого катаболизмом или деструктивным метаболизмом.Это наращивание и разрушение регулируется сложным набором гормонов и ферментов, которые сами являются белками. Чтобы человек оставался здоровым, процессы анаболизма и катаболизма должны оставаться в равновесии.
Катаболизм, или распад питательных веществ, полученных из пищи, высвобождает энергию, которая управляет всей метаболической деятельностью в организме. Например, глюкоза расщепляется, чтобы обеспечить энергию для клеточного дыхания, которое позволяет выполнять такие функции, как движение мышц. Белки расщепляются на аминокислоты, а затем повторно синтезируются в гормоны и ферменты для регулирования химических реакций в клетке, а также в молекулы, используемые для роста и восстановления тканей.Углеводы и жиры являются предпочтительными источниками энергии для клеточного метаболизма. Когда поступление жиров и углеводов недостаточно для удовлетворения потребностей организма, белки могут расщепляться для получения энергии. Это объясняет потерю мышечной массы, наблюдаемую при длительном голодании.
Белок — это азотсодержащее соединение, которое содержится во всех растениях и животных. Существует постоянная потребность в белке для выработки гормонов, ферментов, антител, а также для производства новой ткани (роста) и восстановления поврежденных тканей (поддержание).Около 75% тканей человеческого тела состоит из белков. От 1 до 2% общего белка в организме каждый день расщепляется на аминокислоты и перерабатывается в новые белки. Около 60-70% аминокислот, необходимых организму, поступает из этого процесса переработки. Остальное должно обеспечиваться диетой.
Сложная молекула
Белки представляют собой сложные азотсодержащие молекулы, образованные комбинацией примерно из 20 аминокислот. Эти двадцать аминокислот могут быть соединены в тысячи различных комбинаций, чтобы сформировать все различные белки в организме.Во время образования белка (анаболизма) аминокислоты соединяются в длинные цепи, называемые полипептидами, которые складываются в трехмерные формы. Комбинации аминокислот производят белки уникальной формы, которые выполняют определенные функции в организме, такие как катализирование метаболических реакций, восстановление тканей или стимуляция желез для производства других белков.
Организм может синтезировать 11 аминокислот естественным путем. Остальные девять должны быть получены из диетического белка. Девять аминокислот, которые не могут быть синтезированы организмом, называются незаменимыми аминокислотами.Для здоровья абсолютно необходимо, чтобы в диету входили продукты, содержащие достаточное количество этих незаменимых аминокислот. Продукты, содержащие все незаменимые аминокислоты, называются полноценными белками. Примерами полноценных белков являются все мясо и рыба, яйца и молочные продукты. Продукты, в которых отсутствует одна или несколько незаменимых аминокислот, называются неполными белками. Большинство растительных белков — это неполные белки. Сушеные бобы, чечевица и рис являются примерами неполного белка. Хотя некоторые избыточные аминокислоты превращаются в жир и сохраняются в качестве источника энергии в будущем, организм не может не хранить аминокислоты для использования в производстве будущих белков.В результате люди нуждаются в постоянном поступлении белка в свой рацион. Люди, чья диета полностью или преимущественно вегетарианская, должны обязательно употреблять комбинации продуктов, которые содержат все незаменимые аминокислоты, например красную фасоль и рис или кукурузные лепешки и бобы.
Переваривание белков
Переваривание белков начинается в желудке, где желудком секретируется гормон пепсин. Пепсин разбивает длинные молекулы полипептида на более мелкие пептиды. Механическое взбалтывание желудка способствует пищеварению, смешивая пищу с желудочными (желудочными) выделениями.Когда содержимое желудка достигает определенной степени кислотности, открывается пилорический сфинктер, мышца, отделяющая желудок от тонкой кишки. Содержимое желудка, называемое химусом, попадает в двенадцатиперстную кишку или верхнюю часть тонкой кишки. Когда химус движется по тонкой кишке, ферменты разрывают химические связи в пептидах, превращая белки в составляющие их аминокислоты. (Расщепление жиров и углеводов происходит одновременно под действием разных гормонов и ферментов).В тонком кишечнике клетки кишечника и кровеносные сосуды находятся в непосредственной близости, разделенные только клеточными мембранами. Молекулы аминокислот достаточно малы, чтобы они могли перемещаться через стенку кишечника в кровь, где они (вместе с глюкозой, жирными кислотами и другими продуктами пищеварения) переносятся по крупным кровеносным сосудам в печень.
Печень находится в центре белкового обмена. Он имеет как анаболические, так и катаболические функции. В печени аминокислоты синтезируются в более крупные белки, которые циркулируют по организму, выполняя огромное количество задач, включая стимуляцию производства других белков.Печень также расщепляет белки, например, гемоглобин, содержащийся в мертвых эритроцитах. Печень очищает кровь, удаляя клеточный мусор и перерабатывая избыточный азот, который образуется в результате химических реакций внутри клеток. Этот избыток азота изначально находится в форме аммиака (NH 3 . Если оставить его в крови, он быстро станет токсичным для организма. Печень превращает аммиак в нетоксичную мочевину, которая выводится из организма с мочой. Этот потерянный азот необходимо восполнить с помощью диеты.
Функция
Метаболизм белков состоит из цикла расщепления белков, синтеза новых и удаления азотистых отходов, образующихся в результате этих реакций. Количество белка, необходимого для балансировки этого цикла, меняется на протяжении жизни человека. Например, у растущих детей, у которых появляются новые мышцы и кости, потребность в белке выше, чем у взрослых.
Роль в здоровье человека
Ежедневное референсное потребление (DRI) для изменения белка с возрастом.DRI — это определяемая правительством США мера количества питательного вещества, которое человек должен потреблять ежедневно, и заменяет измерение рекомендованного суточного количества (RDA). Текущие рекомендации DRI призывают детей в возрасте от 1 до 3 лет потреблять 1,1 грамма белка на килограмм веса тела (г / кг веса тела) или примерно 17 г в день. Дети в возрасте 4-13 лет должны получать 0,95 г / кг массы тела, а дети 14-18 лет — 0,85 г / кг массы тела. Для справки, 3 унции нежирной говядины содержат около 30 граммов белка; молоко обеспечивает около 1 г / унцию или 8 г на чашку; в яйце содержится около 6 граммов белка.Мальчики-подростки имеют более высокие потребности в белке, чем девочки-подростки, а беременным женщинам требуется больше белка, чем небеременным женщинам.
Отрицательный азотный баланс возникает, когда человек теряет (за счет экскреции) больше белка, чем обеспечивается с помощью диеты. Отрицательный баланс азота часто связан с недостаточным потреблением калорий (голоданием), а не только с недостаточным потреблением белка. Однако может возникнуть недоедание. В рацион человека не входят продукты, содержащие все незаменимые аминокислоты.Это может быть особой проблемой для людей, которые не употребляют в пищу продукты животного происхождения. Отрицательный азотный баланс также может возникнуть после операции и на поздних стадиях рака.
Общие болезни и расстройства
Состояние здоровья, связанное с метаболизмом белка, обычно обусловлено количеством потребляемого с пищей белка. Недостаточное потребление белка редко является проблемой в Соединенных Штатах, потому что большинство людей обычно едят пищу, содержащую гораздо больше белка, чем рекомендованный DRI. Люди, которые едят слишком много белка, рискуют набрать вес, поскольку избыток белка превращается в жир.Мясо, являющееся хорошим источником белка, также содержит жир и холестерин. Диета, в которой слишком много белка из жирного мяса, может привести к высокому уровню холестерина и увеличению риска сердечных заболеваний.
Кроме того, чрезмерное потребление белка увеличивает количество кальция, выводимого с мочой. Кальций имеет решающее значение для здоровья костей, поэтому длительная диета с высоким содержанием белка может повлиять на прочность костей. Избыток диетического белка также может повредить печень и почки. Кроме того, рекомендованное ежедневное потребление белка для здоровых людей вредно для людей с циррозом печени, поэтому люди с поражением печени или почек могут быть переведены на диеты с низким содержанием белка.
Недостаточное потребление белка может подавлять рост, уменьшать мышечную массу, ослаблять иммунную систему. Со временем это может перегрузить сердце и стать причиной смерти. Острая нехватка белка, известная как белковая энергетическая недостаточность, может быть вызвана такими расстройствами пищевого поведения, как анорексия и булимия.
Голодание — еще одна причина низкого потребления белка. Голод (потребление недостаточного количества калорий) может быть результатом голода, экономических условий или жестокого обращения со стороны воспитателя. В бедных странах серьезное белковое голодание вызывает заболевание, называемое квашиоркор.Это заболевание в первую очередь поражает детей в возрасте от 1 до 3 лет. После того, как эти дети отлучены от груди и больше не получают грудное молоко, их рацион будет состоять из продуктов, содержащих мало белка. Симптомы этого состояния включают нарушение роста, вздутие живота и утомляемость. Лечение заключается в постепенном возвращении к сбалансированной высококалорийной диете. Если не лечить, квашиоркор может привести к повреждению печени и смерти.
КЛЮЧЕВЫЕ УСЛОВИЯ
Кальций— Минеральное вещество, обнаруженное в костях и зубах.
Холестерин — Мягкое, восковидное и жирное вещество (липид), обнаруженное в тканях и жире животных.
Клетка — Основная структурная единица всех живых организмов, таких как животные и растения.
Цирроз — Состояние, при котором здоровые клетки печени заменяются рубцовой тканью. Заболевание чаще всего вызвано алкоголизмом.
Фермент — Белок, который помогает регулировать скорость химической реакции.
Глюкоза — Простой сахар, который может быть использован организмом.
Азот— Химический элемент, содержащийся во всех белках.
Триглицериды — Жирные соединения, состоящие из трех жирных кислот и одной молекулы глицерина.
Ресурсы
КНИГИ
Гаррисон-младший, Роберт и Элизабет Сомеры. The Nutrition Desk Reference New York: McGraw-Hill, 1998.
Tortora, Gerard, and Sandra Reynolds Grabowski. Введение в человеческое тело Нью-Йорк: JohnWiley & Sons, 2001.
ПЕРИОДИЧЕСКИЕ ИЗДАНИЯ
Дэвис, Карла. «Вопрос о белке». Vegetarian Times 331 (май 2005 г.): 26.
Hrastar, Laura M. «Новые амины на пороге: синтетические аминокислоты помогают понять большие белковые комплексы». Ученый 19 i11 (6 июня 2005 г.): 34.
ОРГАНИЗАЦИИ
Американская диетическая ассоциация. 120 South Riverside Plaza, Suite 2000, Чикаго, Иллинойс 60606-6995. (800) 877-1600. http://www.eatright.org
Журнал— Питание — Обзор питания: Нарушения белкового метаболизма
Ниже приводится первая публикация из серии кратких статей, собранных исследовательской группой Мида Джонсон по общим темам в области питания детей грудного возраста.Все темы можно найти на странице «Питание и ваш ребенок».
Нарушения обмена веществ или врожденные нарушения обмена веществ — это наследственные генетические заболевания, при которых ребенок не может усваивать определенные питательные вещества. Без надлежащего диетического контроля неметаболизированные питательные вещества и побочные продукты метаболизма будут накапливаться в организме, что может привести к побочным эффектам, препятствующим нормальному росту и развитию. Однако многие младенцы, начавшие лечение в раннем возрасте, могут нормально расти и развиваться.Mead Johnson Nutrition является пионером в области специализированного питания при нарушениях обмена веществ и более 50 лет является лидером в разработке научно обоснованных продуктов для метаболизма.
Нарушения белкового обмена
Белок является ключевым компонентом большинства продуктов, которые мы едим, включая мясо, бобы, молочные продукты и злаки. Младенцы с нарушениями белкового обмена не могут пить грудное молоко, поскольку оно также содержит белки и аминокислоты, которые не могут быть метаболизированы.Младенцы с нарушениями белкового обмена не могут метаболизировать определенные аминокислоты и нуждаются в специальных смесях без вредных аминокислот, что позволяет ребенку получать необходимые питательные вещества для роста.
Примеры нарушений белкового обмена включают:
- Фенилкетонурия (PKU)
- Болезнь мочи кленового сиропа (MSUD)
- Тирозинемия
- Гомоцистинурия
Более пристальный взгляд на фенилкетонурию (PKU)
Фенилкетонурия, часто называемая фенилкетонурией, является одним из наиболее распространенных нарушений метаболизма белков.В норме организм человека превращает незаменимую аминокислоту фенилаланин в тирозин. У младенцев с ФКУ нет фермента, необходимого для этого преобразования. Следовательно, в их организме содержится избыточное количество фенилаланина и низкий уровень тирозина. Следующие симптомы могут быть результатом отсутствия лечения ФКУ:
Вялость
Умственная отсталость
Светлый пигмент
Изъятия
Экзема
Гиперактивность
Диетический менеджмент имеет решающее значение для людей с фенилкетонурией для обеспечения нормального роста и развития, а также для поддержки нормальной нейрокогнитивной функции.К счастью, ФКУ можно диагностировать на раннем этапе жизни с помощью обследований на генетические нарушения, которые во многих странах являются обязательными. После постановки диагноза диетическое лечение фенилкетонурии можно начинать сразу же.
Лечение фенилкетонурии включает строго ограничительную диету, которая сводит к минимуму количество потребляемого фенилаланина, и регулярный контроль со стороны медицинских специалистов, имеющих опыт диетического управления метаболическими заболеваниями. Для младенцев с фенилкетонурией в качестве основного источника протеина используются специальные смеси без фенилаланина.Регулярные посещения клиники позволяют контролировать уровень фенилаланина в крови и рост ребенка, чтобы гарантировать успешное соблюдение диеты.
Обмен белков при циррозе печени: от альбумина к миофибриллам мышц
Для исследования распространенности хронической одышки и ее взаимосвязи с функцией дыхательных мышц при терминальной стадии заболевания печени. Шестьдесят восемь последовательных амбулаторных пациентов европеоидной расы с терминальной стадией заболевания печени, кандидаты на трансплантацию печени, были направлены для предоперационной оценки респираторной функции.Сорок из них (29 мужчин) были включены в это предварительное исследование после применения строгих критериев включения и исключения. У 17 из 40 пациентов (42%) был асцит, но ни у одного из них не было кахектики. Пятнадцать из 40 пациентов (38%) имели в анамнезе печеночную энцефалопатию, хотя во время исследования ни у одного из них не было симптомов. Все пациенты с известным анамнезом и / или наличием сопутствующих заболеваний были исключены. Хроническая одышка оценивалась по 6-балльной шкале модифицированного совета медицинских исследований (mMRC). Тяжесть заболевания печени оценивали в соответствии с моделью терминальной стадии заболевания печени (MELD).Были измерены стандартные функциональные пробы легких, максимальное статическое давление во рту на выдохе (Pemax) и вдохе (Pimax). Сила дыхательных мышц (RMS) рассчитывалась на основе значений Pimax и Pemax. Кроме того, измерялись газы артериальной крови и характер дыхания (VE: минутная вентиляция; VT: дыхательный объем; VT / TI: средний поток вдоха; TI: продолжительность вдоха). Тридцать пять (88%) из 40 пациентов в возрасте (среднее ± стандартное отклонение) 52 ± 10 лет сообщили о различной степени хронической одышки (mMRC) от 0 до 4 со средним значением 2.0 ± 1,2. Оценка MELD составляла 14 ± 6. Pemax, процент прогнозируемого (% pred) был 105 ± 35, Pimax,% pred составлял 90 ± 29, а RMS,% pred составлял 97 ± 30. Эти давления были ниже нормальных пределов в 12 ( 30%), 15 (38%) и 14 (35%) пациентов соответственно. Кроме того, сравнивая подгруппы пациентов с асцитом и неасцитом, было обнаружено, что все измеренные индексы дыхательных мышц значительно снизились у пациентов с асцитом. Пациенты с асцитом также имели значительно худший балл MELD по сравнению с пациентами без асцита (P = 0.006). Выявлены достоверные корреляционные связи между показателями хронической одышки и функцией дыхательной мышцы у всех пациентов. В частности, оценка mMRC достоверно коррелировала с Pemax, Pimax и RMS (r = -0,53, P <0,001; r = -0,42, P <0,01; r = -0,51, P <0,001, соответственно). Эти корреляции были значительно ближе в подгруппе без асцита (r = -0,82, P <0,0001; r = -0,61, P <0,01; r = -0,79, P <0,0001, соответственно) по сравнению со всеми пациентами. Аналогичные результаты были получены для взаимосвязи между показателями mMRC и MELD и MELD и показателями силы дыхательных мышц.У всех пациентов единственным предиктором оценки mMRC был RMS (r = -0,51, P <0,001). В подгруппе пациентов без асцита эта взаимосвязь становится более тесной (r = -0,79, P <0,001), тогда как в подгруппе пациентов с асцитом эта взаимосвязь нарушается. Исчезновение такой корреляции может быть связано с тем, что асцит действует как «смешивающий» фактор. PaCO2 (4,4 ± 0,5 кПа) был увеличен, тогда как pH (7,49 ± 0,04) снизился у 26 (65%) и 34 (85%) пациентов соответственно. PaO2 (12.3 ± 0,04 кПа) было в пределах нормы. VE (11,5 ± 3,5 л / мин), VT (0,735 ± 0,287 л) и VT / TI (0,449 ± 0,129 л / с) были увеличены, что свидетельствует о гипервентиляции в обеих подгруппах пациентов. VT / TI был значительно выше у пациентов с асцитом, чем без асцита. Значимые корреляции, хотя и слабые, были обнаружены для PaCO2 с VE и VT / TI (r = -0,44, P <0,01; r = -0,41, P <0,01, соответственно). Распространенность хронической одышки в терминальной стадии заболевания печени составляет 88%. Показатель mMRC тесно коррелирует с силой дыхательной мышцы.
Исследование показателей белкового обмена в организме крыс при ингаляционной интоксикации электронными сигаретами «Вапор» | Безродно | Вестник Киевского национального университета имени Тараса Шевченко
Де Харт В. Б., Меллис А. М., Каплан Б. А. Экспериментальный рынок табака: повествования задействуют когнитивные предубеждения для увеличения замены электронных сигарет. Зависимость от наркотиков и алкоголя. 2019: 19: 203-11.
Кочеткова С.К., Остапченко И.М. Исследование особенностей курения кальяна и электронных сигарет. Материалы региональной научно-практической конференции «Научное обеспечение производства высококачественной сельскохозяйственной и пищевой продукции и повышенная безопасность». — Краснодар: ГНУ ВНИИТТИ., 2011: 249-56.
Кочеткова С.К., Дурунча Н.А., Пережогин Т.А., Остапченко И.М. Исследование жидкостей для электронных систем доставки никотина. Международный исследовательский журнал. 2017: 4 (58): 54-57.
Центры по контролю и профилактике заболеваний. Заметки с мест: использование электронных сигарет учащимися средних и старших классов — США, 2011-2012 гг.Еженедельный отчет о заболеваемости и смертности. 2013: 62 (35): 729-62.
Скворцова С.В., Штурмин Ф.С. Правовое регулирование использования электронных сигарет в России. Успехи химии и химической технологии. 2017: XXXI (7): 79-81.
Осипов Д.А. Место электронных систем доставки никотина в лечении никотиновой зависимости: современный взгляд на проблему. Вестник современной клинической медицины. 2018: 11 (2): 46-50.
Наконечная О.А., Бабийчук Л.А., Безродна А. И. Нарушение трансмембранной асимметрии фосфатидилсерина в гепатоцитах как маркер апоптоза при действии ксенобиотиков на крыс. Укр. Биохим. J. 2018: 90 (6): 82-88.
Наконечная О.А., Безродная А.И., Кривонос К.А. Влияние блоксополимеров на регуляцию и основные показатели белкового и углеводного обмена у крыс в условиях предметного токсикологического эксперимента. Вестник Киевского национального университета имени Тараса Шевченко. Проблемы регуляции физиологических функций.2018: 25: 55-59.
Папаэфстатиу Э., Стилиану М., Агапиу А. Основные и побочные эффекты электронных сигарет. J. Environ. Управлять. 2019: 238 (2): 10-17.
Reidel B., Radicioni G., Clapp P.W. Использование электронных сигарет вызывает уникальный врожденный иммунный ответ в легких, связанный с повышенной нейтрофильной активацией и изменением секреции муцина. Американский журнал респираторной медицины и реанимации. 2018: 197 (4): 492-501.
Петрова А.П., Павлова А.О., Мирошниченко Ю.Д., Сергеев А.А. Влияние вейп-сигарет и табачных сигарет на слизистую рта. Международный студенческий научный вестник. 2018: 1: 35-39.
Dong W. S., Young I.K., Seung J.K. Отношение врачей-специалистов по раку легких к электронным сигаретам: общенациональное исследование. PLOS ONE. 2017: DOI: 10.1371 / journal.pone.0172568.
Атала А. Re: Дым электронных сигарет повреждает ДНК и снижает активность восстановления в легких, сердце и мочевом пузыре мыши, а также в клетках легких и мочевого пузыря человека.Ж. Урол: 2018. 200 (4): 701-711.
Ли Х.-В. Дым электронных сигарет повреждает ДНК и снижает активность восстановления в легких, сердце и мочевом пузыре мыши, а также в клетках легких и мочевого пузыря человека. Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2018: 1: 1560–69.
[ГОСТ 32646-2014 Методы испытаний на действие химических продуктов на организм человека. Acute Inhalation Toxicity — метод определения класса острой токсичности. Дата введения: 01.06.2015. Русский.
Камышников В.С.[Справочник клинико-биохимических исследований и лабораторной диагностики]. 3-е изд. Москва: Медпресс информ; 2009. 896 с. Русский.
Ингерлейб МБ. [Анализирует: полное руководство]. Издательство АСТ; 2011. 250 с. Русский.
Меньшиков В.В. Редактор. [Лабораторные методы исследования в клинике. Справочник]. Москва: Медицина; 1987. 368 с. Русский.
Ву Си, Ю. Кот, К. Кот, Э. Перски, Р. Морс, О. Доран, Хамдаллах Амджад Параметры общего метаболизма и окислительного стресса у крыс при длительном воздействии низких концентраций Cd2 +.Журнал В. Харьковский национальный университет имени Каразина. Серия «Биология». 2017: 29: 182-87.
Вышницкая Я., Маракушин Д.И., Наконечная О.А. Влияние этоксилированных алкилфенолов на состояние метаболизма белков в подостром токсикологическом эксперименте. Украинский журнал клинической и лабораторной медицины. 2013; 8 (2): 173-8. Русский.
Поступила: 15.02.2019
Исправлено: 14.03.2019
Принято и опубликовано: 15.03.2019
% PDF-1.4 % 545 0 объект > эндобдж xref 545 76 0000000016 00000 н. 0000002621 00000 н. 0000002786 00000 н. 0000003417 00000 н. 0000003600 00000 н. 0000004022 00000 н. 0000004493 00000 н. 0000004927 00000 н. 0000005089 00000 н. 0000005139 00000 п. 0000005188 00000 п. 0000005302 00000 н. 0000005414 00000 н. 0000005663 00000 п. 0000006225 00000 н. 0000006568 00000 н. 0000007484 00000 н. 0000007857 00000 н. 0000008289 00000 н. 0000009072 00000 н. 0000009341 00000 п. 0000009983 00000 н. 0000010260 00000 п. 0000010710 00000 п. 0000011439 00000 п. 0000012236 00000 п. 0000013072 00000 п. 0000013249 00000 п. 0000013689 00000 п. 0000014496 00000 п. 0000015471 00000 п. 0000015604 00000 п. 0000016018 00000 п. 0000016333 00000 п. 0000017294 00000 п. 0000018196 00000 п. 0000049312 00000 п. 0000095939 00000 п. 0000105821 00000 н. 0000107885 00000 н. 0000108705 00000 н. 0000108795 00000 н. 0000108865 00000 н. 0000108963 00000 н. 0000124513 00000 н. 0000124781 00000 н. 0000125091 00000 н. 0000125118 00000 н. 0000125526 00000 н. 0000125976 00000 н. 0000126254 00000 н. 0000126551 00000 н. 0000126968 00000 н. 0000151691 00000 н. 0000151946 00000 н. 0000152424 00000 н. 0000162651 00000 н. 0000162908 00000 н. 0000163267 00000 н. 0000176475 00000 н. 0000176729 00000 н. 0000177033 00000 н. 0000199883 00000 н. 0000200138 00000 н. 0000200626 00000 н. 0000221469 00000 н. 0000221727 00000 н. 0000222175 00000 н. 0000254036 00000 н. 0000254290 00000 н. 0000254658 00000 н. 0000258712 00000 н. 0000264051 00000 н. 0000264665 00000 н. 0000002432 00000 н. 0000001852 00000 н. трейлер ] / Предыдущая 405939 / XRefStm 2432 >> startxref 0 %% EOF 620 0 объект > поток hb«b` * Ā
.
 Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.