Белки синтезируются: 1. Синтез белков в клетке
1. Синтез белков в клетке
Каждая клетка содержит тысячи белков. Свойства белков определяются их первичной структурой, т. е. последовательностью аминокислот в их молекулах.
В свою очередь наследственная информация о первичной структуре белка заключена в последовательности нуклеотидов в молекуле ДНК. Эта информация получила название генетической, а участок ДНК, в котором содержится информация о первичной структуре одного белка, называется ген.
Ген — это участок ДНК, в котором содержится информация о первичной структуре одного белка.
Ген — это единица наследственной информации организма.
Каждая молекула ДНК содержит множество генов. Совокупность всех генов организма составляет его генотип.
Биосинтез белка
Биосинтез белка — это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определённую последовательность аминокислот в белковых молекулах.
Процесс биосинтеза белка состоит из двух этапов: транскрипции и трансляции.
Каждый этап биосинтеза катализируется соответствующим ферментом и обеспечивается энергией АТФ.
Биосинтез происходит в клетках с огромной скоростью. В организме высших животных в одну минуту образуется до \(60\) тыс. пептидных связей.
Транскрипция
Транскрипция — это процесс снятия информации с молекулы ДНК синтезируемой на ней молекулой иРНК (мРНК).
Носителем генетической информации является ДНК, расположенная в клеточном ядре.
В ходе транскрипции участок двуцепочечной ДНК «разматывается», а затем на одной из цепочек синтезируется молекула иРНК.
Информационная (матричная) РНК состоит из одной цепи и синтезируется на ДНК в соответствии с правилом комплементарности.
Формируется цепочка иРНК, представляющая собой точную копию второй (нематричной) цепочки ДНК (только вместо тимина включён урацил).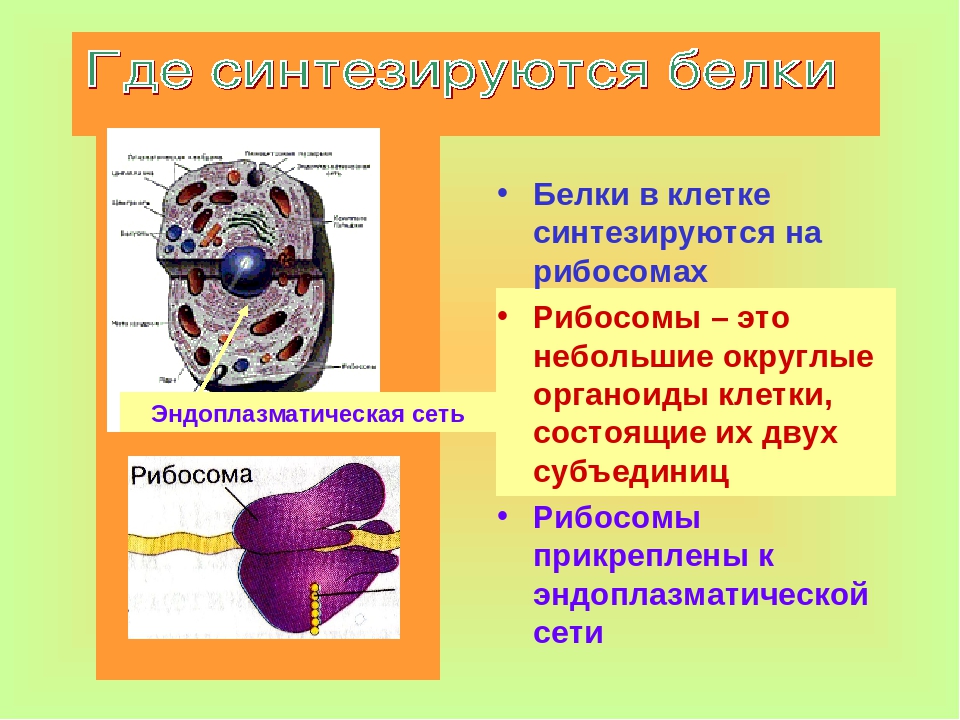 Так информация о последовательности аминокислот в белке переводится с «языка ДНК» на «язык РНК».
Так информация о последовательности аминокислот в белке переводится с «языка ДНК» на «язык РНК».
Как и в любой другой биохимической реакции, в этом синтезе участвует фермент — РНК-полимераза.
Так как в одной молекуле ДНК может находиться множество генов, очень важно, чтобы РНК-полимераза начала синтез иРНК со строго определённого места ДНК. Поэтому в начале каждого гена находится особая специфическая последовательность нуклеотидов, называемая промотором. РНК-полимераза «узнаёт» промотор, взаимодействует с ним и, таким образом, начинает синтез цепочки иРНК с нужного места.
Фермент продолжает синтезировать иРНК до тех пор, пока не дойдёт до очередного «знака препинания» в молекуле ДНК — терминатора (это последовательность нуклеотидов, указывающая на то, что синтез иРНК нужно прекратить).
У прокариот синтезированные молекулы иРНК сразу же могут взаимодействовать с рибосомами и участвовать в синтезе белков.
У эукариот иРНК синтезируется в ядре, поэтому сначала она взаимодействует со специальными ядерными белками и переносится через ядерную мембрану в цитоплазму.
Трансляция
Трансляция — это перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка.
В цитоплазме клетки обязательно должен иметься полный набор аминокислот, необходимых для синтеза белков. Эти аминокислоты образуются в результате расщепления белков, получаемых организмом с пищей, а некоторые могут синтезироваться в самом организме.
Обрати внимание!
Аминокислоты доставляются к рибосомам транспортными РНК (тРНК). Любая аминокислота может попасть в рибосому, только прикрепившись к специальной тРНК.
На тот конец иРНК, с которого нужно начать синтез белка, нанизывается рибосома. Она движется вдоль иРНК прерывисто, «скачками», задерживаясь на каждом триплете приблизительно \(0,2\) секунды.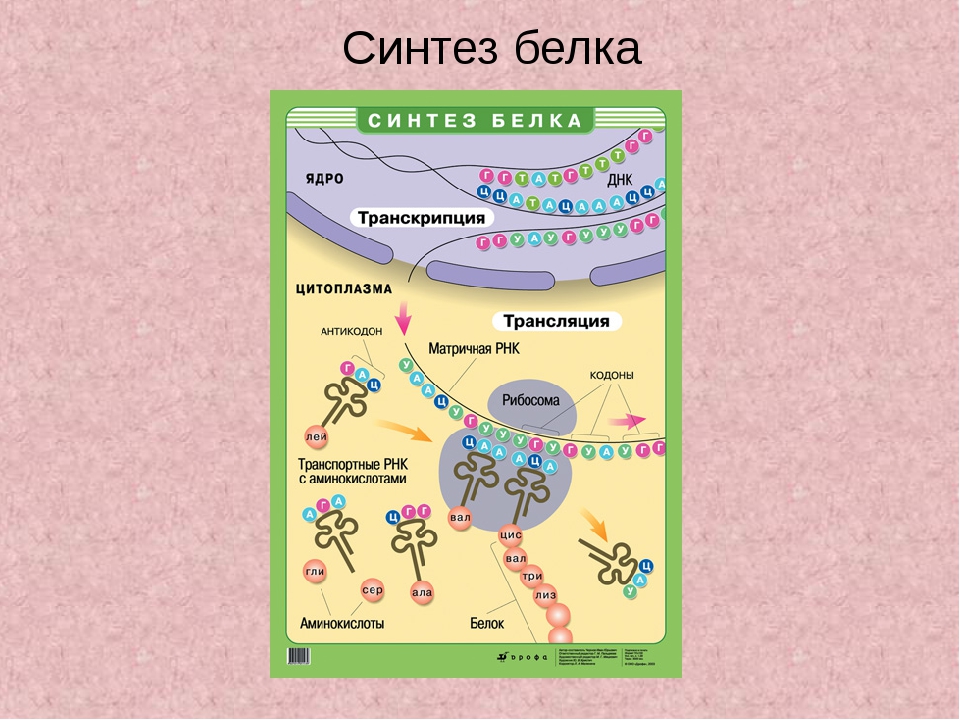
За это время молекула тРНК, антикодон которой комплементарен кодону, находящемуся в рибосоме, успевает распознать его. Аминокислота, которая была связана с этой тРНК, отделяется от «черешка» тРНК и присоединяется с образованием пептидной связи к растущей цепочке белка. В тот же самый момент к рибосоме подходит следующая тРНК (антикодон которой комплементарен следующему триплету в иРНК), и следующая аминокислота включается в растущую цепочку.
Аминокислоты, доставленные на рибосомы, ориентированы по отношению друг к другу так, что карбоксильная группа одной молекулы оказывается рядом с аминогруппой другой молекулы. В результате между ними образуется пептидная связь.
Рибосома постепенно сдвигается по иРНК, задерживаясь на следующих триплетах. Так постепенно формируется молекула полипептида (белка).
Синтез белка продолжается до тех пор, пока на рибосоме не окажется один из трёх стоп-кодонов (УАА, УАГ или УГА). После этого белковая цепочка отсоединяется от рибосомы, выходит в цитоплазму и формирует присущую этому белку вторичную, третичную и четвертичную структуры.
Так как клетке необходимо много молекул каждого белка, то как только рибосома, первой начавшая синтез белка на иРНК, продвинется вперёд, за ней на ту же иРНК нанизывается вторая рибосома. Затем на иРНК последовательно нанизываются следующие рибосомы.
Все рибосомы, синтезирующие один и тот же белок, закодированный в данной иРНК, образуют полисому. Именно на полисомах и происходит одновременный синтез нескольких одинаковых молекул белка.
Когда синтез данного белка окончен, рибосома может найти другую иРНК и начать синтезировать другой белок.
Общая схема синтеза белка представлена на рисунке.
Пример:
последовательность нуклеотидов матричной цепи ДНК: ЦГА ТТА ЦАА.
На информационной РНК (иРНК) по принципу комплементарности будет синтезирована цепь ГЦУ ААУ ГУУ, в результате чего выстроится цепочка аминокислот: аланин — аспарагин — валин.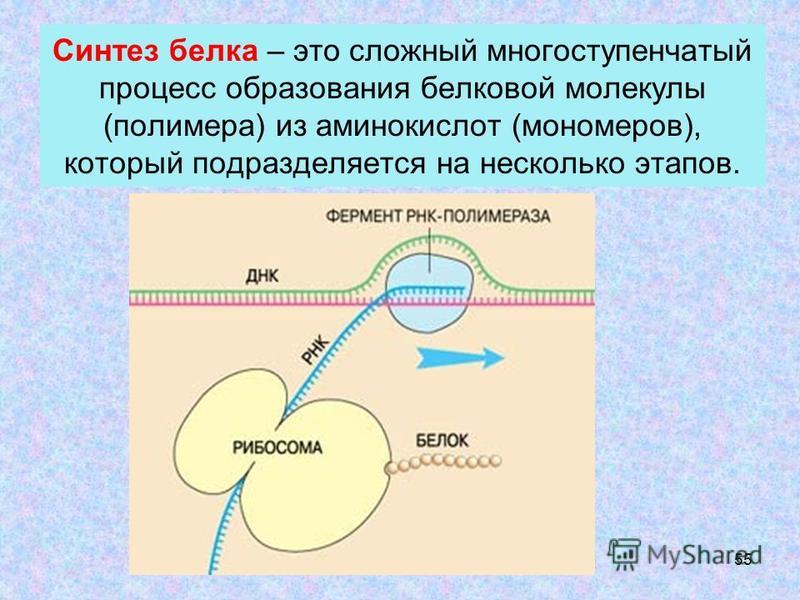
При замене нуклеотидов в одном из триплетов или их перестановке этот триплет будет кодировать другую аминокислоту, а следовательно, изменится и белок, кодируемый данным геном.
Изменения в составе нуклеотидов или их последовательности называются мутациями.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://distant-lessons.ru/molekula-rnk.html
http://900igr.net
http://tonpix.ru/biosintez_belka_translyaciya_47725/
Белки синтезируемые в oli — Справочник химика 21
Рекомбинантные микроорганизмы широко используются для получения разнообразных белковых продуктов, применяющихся в медицине (например, инсулина), а также в качестве своего рода фабрик по производству имеющих коммерческую ценность метаболитов (например, антибиотиков).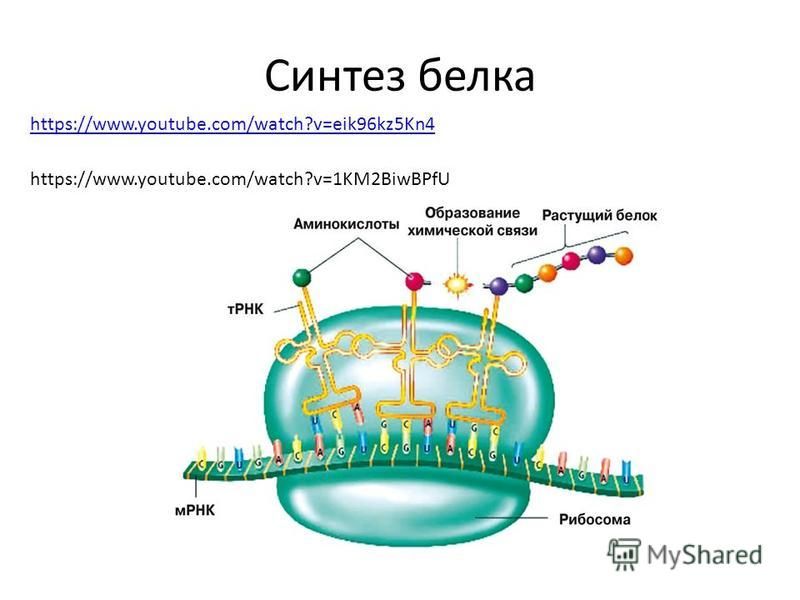 Белки синтезируются наиболее [c.359]
Белки синтезируются наиболее [c.359] Биохимические исследования давно привели к заключению, что синтезы таких специфических белков, как ферменты и т.д., контролируются шаблонами или матрицами, называемыми генами. Гены выполняют двойную функцию — воспроизведение собственной копии и обеспечение специфической структуры молекулы белка. Приведенные выше новые исследования, а также работы, направленные на изз ение размножения вирусов (см. Вирусы ), являются важным началом в познании химической природы генов. Большинство белков синтезируется в клеточной плазме в определенных полимеризационных центрах, называемых микросомами. Последние содержат только рибонуклеиновую кислоту и белки. Были открыты ферменты, связывающие аминокислоты с аденозинмонофосфорной кислотой с образованием смешанных ангидридов. Оказалось также, что эти ангидриды соединяются далее до входа в микросомы с рибонуклеиновой кислотой небольшого молекулярного веса, служащей, вероятно, переносчиком (М. Б. Хогланд 1956 г.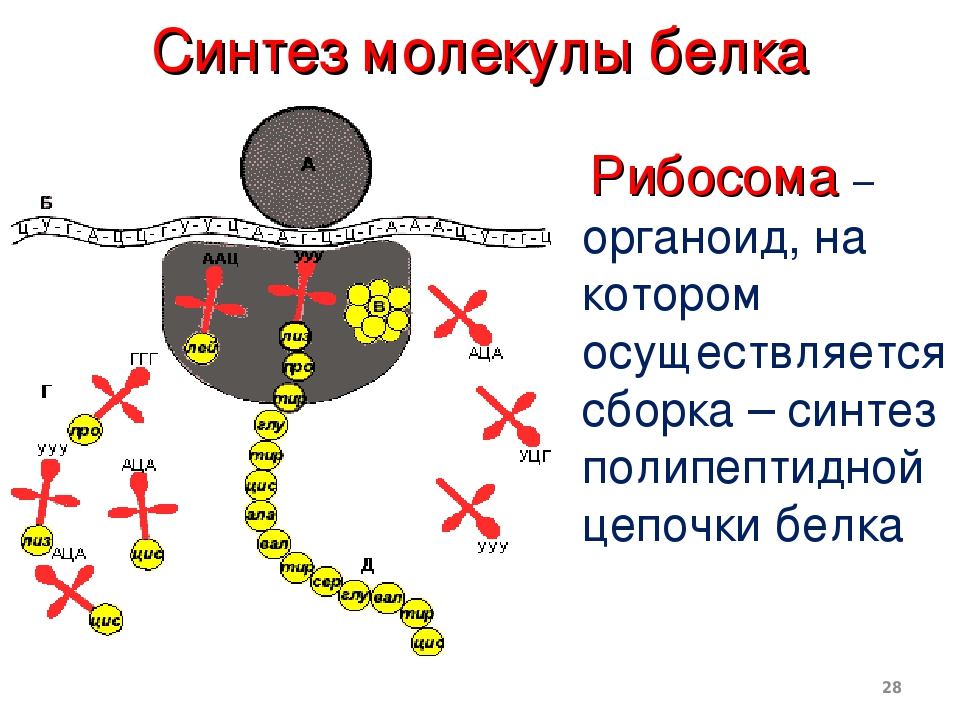
Транскрипция. ДНК служит шаблоном, с которого копируются синтезируемые соединения. Но синтез белков происходит без непосредственного участия ДНК. Белки синтезируются в клеточных рибосомах, а ДНК в рибосомах не содержится. Информация передается от ДНК к рибосомам — центрам синтеза белков — посредством информационной рибонуклеиновой кислоты или матричной РНК, обозначаемой мРНК. Копирование (считывание информации с ДНК) представляется в следующем виде. На ДНК строится мРНК- Переписывание ин-
Во всех живых клетках белки синтезируются рибосомами. Рибосома представляет собой крупную макромолекулу со сложной асимметричной четвертичной структурой, построенной из рибонуклеиновых кислот (рибосомных РНК) и белков. Для того чтобы синтезировать белок, рибосома должна быть снабжена а) программой, задающей порядок чередования аминокислотных остатков в полипептидной цепи белка б) аминокислотным материалом, из которого надлежит строить белок в) энергией.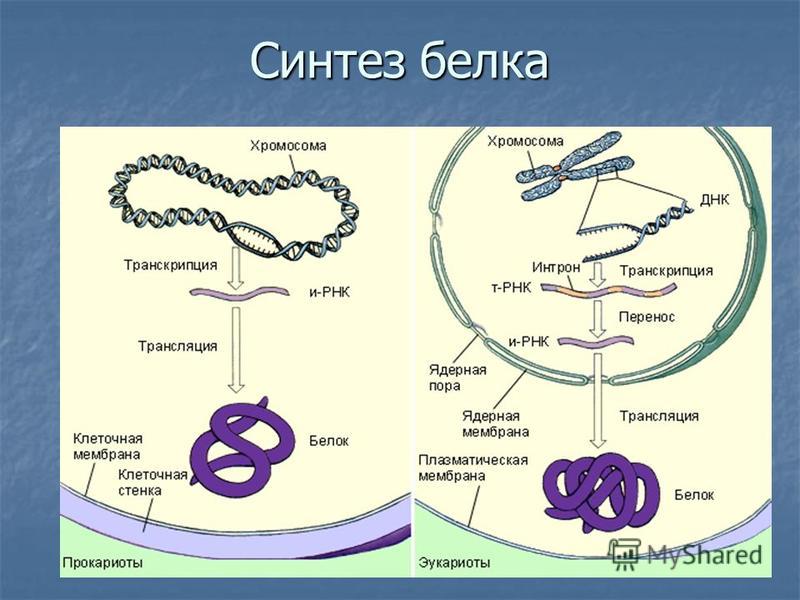
Некоторые белки, синтезирующиеся в клетках в избыточном количестве, образуют нерастворимые частицы (тельца включения). После разрущения клеток их легко можно отделить от большинства других клеточных компонентов. Вначале исследователям не удавалось дезагрегировать выделенные тельца включения так, чтобы при этом не произошла необратимая денатурация белков, но позже были разработаны методы, позволяющие ренатурировать рекомбинантный белок и восстановить его активность. Ясно, что все эти дополнительные процедуры увеличивают стоимость процесса очистки.
Ферментацию можно проводить по-разному. При периодической ферментации посевной материал вводят в свежую культуральную среду и проводят культивирование, не добавляя субстрат до тех пор, пока количество нужного продукта не достигнет максимума.
Защитные белки представлены прежде всего антителами или иммуноглобулинами. Эти белки синтезируются в костном мозге и предохраняют организм от чужеродных веществ. Они обладают уникальным свойством распознавать чужеродные бактерии, вирусы или белки, связываться с ними и нейтрализовать.
 [c.45]
[c.45] Как мы знаем, антитела содержат легкие и тяжелые полипептидные цепи, а IgM и IgA, кроме того, состоят из пяти и двух субъединиц соответственно. Антитела, будучи секреторными или мембранными белками, синтезируются на мембранно-связанных рибосомах. Их созревание и транспорт проходит по механизмам, описанным в гл. 29. В цистернах эндоплазматического ретикулума происходит формирование третичной структуры антител и частичное их гликозилирование. Далее в аппарате Гольджи заверщается их окончательное
У растений синтез белка в ядрах, а также в митохондриях и хлоропластах еще недостаточно исследован, чтобы можно было определить, происходит ли он по той же схеме, как в рибосомах. Имеется мало данных, не согласующихся с гипотезой, что в растениях все белки синтезируются по той же схеме, как в рибосомах. Сообщалось, что в хлоропластах присутствуют ферменты, активирующие аминокислоты.
В большинстве случаев функциональная трехмерная укладка полипептидной цепи, т. е. нативная структура белка, представляет собой его наиболее стабильную конформацию. Следовательно, хотя белки синтезируются в виде линейных полимеров, они спонтанно принимают правильную трехмерную конформацию. Подтверждение этой мысли можно найти в классической работе Анфинсена по рибонуклеазе (см. рис. 8-8). [c.356]
е. нативная структура белка, представляет собой его наиболее стабильную конформацию. Следовательно, хотя белки синтезируются в виде линейных полимеров, они спонтанно принимают правильную трехмерную конформацию. Подтверждение этой мысли можно найти в классической работе Анфинсена по рибонуклеазе (см. рис. 8-8). [c.356]
В растениях белки синтезируются из неорганических соединений,. в организме животных — из аминокислот. Последние поступают с пищей в виде растительных или животных белков. Только некоторые заменимые аминокислоты в организме животных синтезируются из кетокислот и аммиака или других аминокислот.
В растениях белки синтезируются из неорганических соединений при взаимодействии энзимов, в организме животных — из амино- [c.323]
В природе огромное количество белков синтезируется растениями из неорганических соединений, содержащих углерод и азот. Углерод поступает в зеленый лист растения из воздуха в виде углекислого газа, а азот из почвы в виде растворимых солей. Многие растения идут в пищу человека и на корм животным.
Многие растения идут в пищу человека и на корм животным.
Белки синтезируются из простых веществ только в растениях, которые поглощают минеральные соединения азота из почвы. Животные лишь получают готовые белковые вещества с пищей, строят из них свои белки. Поэтому белковые вещества важны для питания человека и животных. [c.378]
Белки синтезируются на рибосомах из отдельных аминокислот, образуемых самими микроорганизмами. Исключение составляют некоторые ауксотрофные мутанты, для которых необходимо присутствие в среде определенных аминокислот. Биосинтез аминокислот в клетке идет ферментативно из неорганического азота и различных соединений углерода, например продуктов аэробного или анаэробного разложения углеводов. Многие аминокислоты образуются из промежуточных продуктов цикла Кребса из а-кетоглутаровой кислоты — глутаминовая кислота, орнитин, аргинин, пролин из щавелевоуксусной кислоты — Ь-ас-парагиновая кислота, гомосерин, метионин, треонин, диаминопимелиновая кислота, лизин, изолейцин из пировиноградной кислоты — аланин, валин, лейцин, серии, глицин, цистеин (рис.
В предыдущих главах уже отмечалось, что растения содержат множество разных белков, которые выполняют разнообразные функции в качестве катализаторов клеточных реакций, а также в качестве структурных компонентов. Из опытов по включению радиоактивных аминокислот известно, что белки синтезируются из двадцати аминокислот, перечисленных ниже (другие аминокислоты, найденные в составе белков, например цистин и оксипролин, образуются путем изменения соответствующих аминокислот из числа этих двадцати уже по завершении первых стадий белкового синтеза)
Акцептор (от лат. a eptor — получатель) — атом (ион) или группа атомов, принимающая электроны и образующая химическую связь за счет свободной орбитали и иеподеленной пары электронов донора. См. Донорно-акцепторная связь а-Алаиин (а-аминопропионовая кислота) СНз— H(Nh3)—СООН — аминокислота, составная часть большинства белков. Синтезируется в организме человека и Животных. 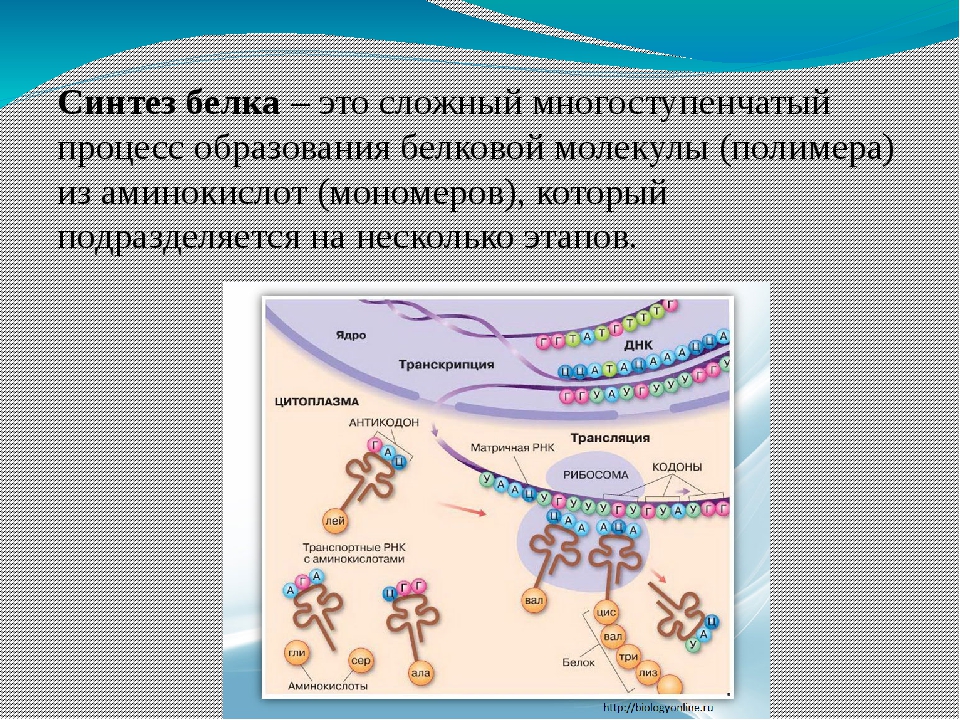 10]
10]
Для сывороточного альбумина получена гораздо меньшая величина — около 4 дней. Было обнаружено, что белки синтезируются из свободных аминокислот, но никогда не образуются из полипептидов, получившихся при распаде белка (см. табл. 4). [c.95]
Все структуры митохондрии содержат белки. Белки синтезируются на матрицах РНК. Так как теперь у нас имеется в распоряжении АТФ, изготовленная в митохондриях, то целесообразно рассмотреть те части клетки, в которых возникают матрицы ДНК и РНК и химические узлы, в которых на матрицах синте-ризуется белок. Программа химической работы клетки и планы развития организма записаны — закодированы — в ДНК, а ДНК сосредоточена в ядре. [c.166]
Из компонентов клетки было выделено три типа рибонуклеиновых кислот. Все они обладают общим химическим строением и отличаются по составу, нуклеотидной последовательности и молекулярному весу. До настоящего времени мало что известно о конформации этих молекул.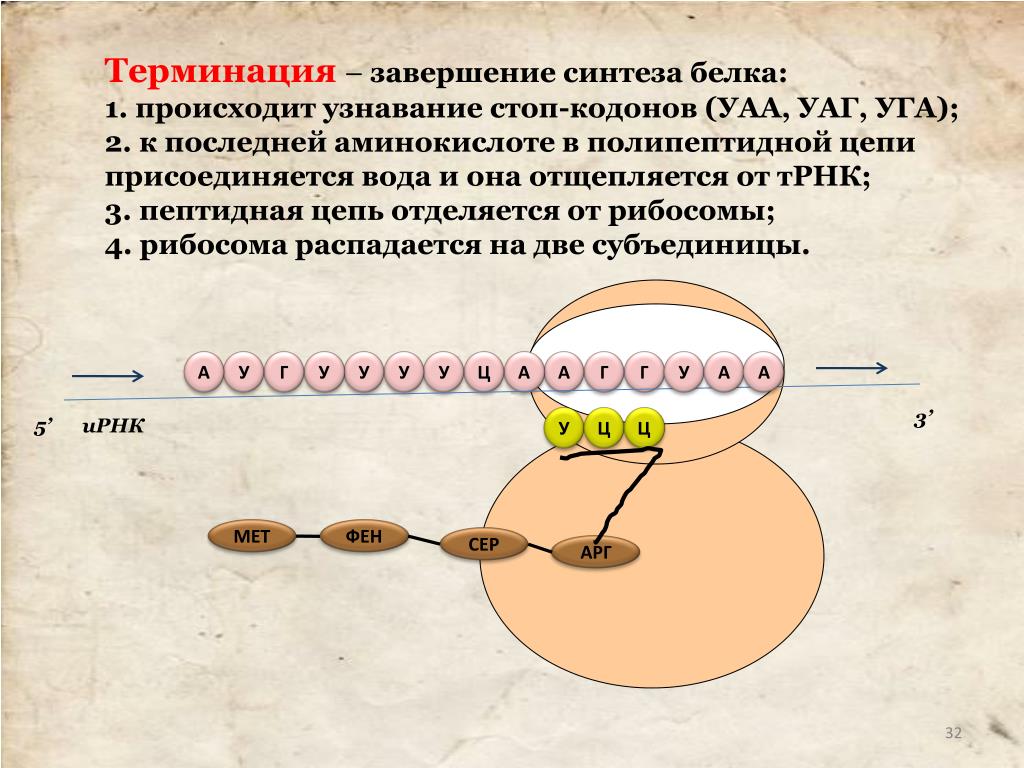 Белки синтезируются на рибонуклеопротеид-ных частицах цитоплазмы (безъядерная часть протоплазмы), РНК этих частиц называется рибосомальной РНК iB отличие от тра н1опорт,ной РНК, лереносящей аминокислоты. Дохи (1961) цредположил наличие и -формационной РНК, в которой закодирована (Последовательность ам иио-.кислот белка, синтезирующегося под действием рибосомальной РНК. [c.735]
Белки синтезируются на рибонуклеопротеид-ных частицах цитоплазмы (безъядерная часть протоплазмы), РНК этих частиц называется рибосомальной РНК iB отличие от тра н1опорт,ной РНК, лереносящей аминокислоты. Дохи (1961) цредположил наличие и -формационной РНК, в которой закодирована (Последовательность ам иио-.кислот белка, синтезирующегося под действием рибосомальной РНК. [c.735]
ИНТЕРЛЕЙКИНЫ, гормоноподобные белки, обладающие способностью стимулировать рост и диффереицировку клеток. Синтезируются в клетках н.м.мунной системы и в нек-рых др. клетках. Наиб, подробно охарактеризованы три типа H.-IL-l, IL-2 и IL-3. Первый был идентифицирован вначале как продукт макрофагов, однако впоследствии было показано, что идентичные или сходные по активности белки синтезируются также др. клетками высших животных. Синтез IL-1 макрофагами стимулируется липополисахаридами бактерий, у-интерфероном, а также комплексами антиген-антитело-комплемент. У человека найдено две разновидности IL-1 (а и ), к-рые имеют одинаковую мол. м. (ок. 17 тыс.), сходную первичную структуру и одинаковую биол. активность. IL-1 способен связываться с разными типами клеток, что приводит к многообразным биол. эффектам, [c.243]
м. (ок. 17 тыс.), сходную первичную структуру и одинаковую биол. активность. IL-1 способен связываться с разными типами клеток, что приводит к многообразным биол. эффектам, [c.243]
Исследования функциональной роли рибосом щли параллельно с их обнаружением и структурным описанием. Первой убедительной демонстрацией того, что именно рибонуклеопротеидные частицы микросом ответственны за включение аминокислот в новосинте-зированный белок, были эксперименты П. Замечника с сотрудниками (США), опубликованные в 1955 т. За этим последовали эксперименты из той же лаборатории, показавшие, что свободные рибосомы, не прикрепленные к мембранам эндоплазматического ретикулума, также включают аминокислоты и синтезируют белок, освобождающийся затем в растворимую фазу (1957). Функции бактериальных рибосом были предметом интенсивных исследований группы Р. Б. Робертса (США) К. Мак Киллен, Р. Б. Робертс и Р. Дж. Бриттен в 1959 г. окончательно установили, что белки синтезируются в рибосомах и затем распределяются по другим частям бактериальной клетки. [c.50]
[c.50]
Несмотря на большое количество примеров, когда секреторные и внутримембранные белки синтезируются с отщепляемой сигнальной N-концевой последовательностью, это, по-видимому, не есть общее правило. Некоторые белки, как оказалось, тоже синтезируются на мембраносвязанных рибосомах, но без отщепления N-конце-вой или какой-либо иной сигнальной последовательности. К ним относится такой типичный секреторный белок, как овальбумин, а также мембранные белки цитохром Р-450, эпоксидгидратаза, ретинальный опсин, гликопротеид РЕг вируса Синдбис. В этих случаях растущая полипептидная цепь тоже, по-видимому, имеет сигнальную последовательность, индуцирующую присоединение транслирующей рибосомы к мембране эндоплазматического ретикулума и ко-трансляционный транспорт белка в мембрану, но без сопутствующего процессинга. Для цитохрома Р-450 показано, что его N-концевая последовательность гидрофобна и напоминает сигнальную, но она сохраняется у зрелого белка. Однако N-концевые последовательности овальбумина и опсина не похожи на обычную сигнальную последовательность.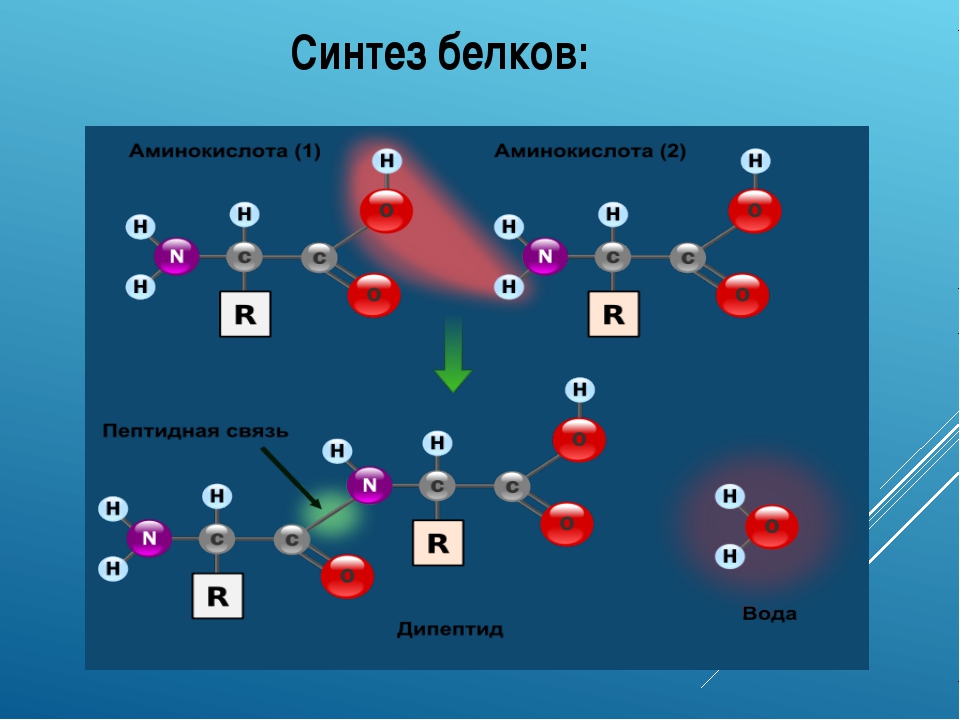 Возможно, что либо сигнальную роль здесь выполняют специальные внутренние гидрофобные участки растущего полипептида, либо не столь гидрофобная N-концевая последовательность тоже в каких-то случаях может служить сигналом для присоединения к мембране. Как и в других случаях, взаимодействие с мембраной возможно лишь в течение трансляции но не после нее очевидно, сворачивание завершенной цепи как-то блокирует (экранирует) сигнальную функцию соответствующего участка. [c.282]
Возможно, что либо сигнальную роль здесь выполняют специальные внутренние гидрофобные участки растущего полипептида, либо не столь гидрофобная N-концевая последовательность тоже в каких-то случаях может служить сигналом для присоединения к мембране. Как и в других случаях, взаимодействие с мембраной возможно лишь в течение трансляции но не после нее очевидно, сворачивание завершенной цепи как-то блокирует (экранирует) сигнальную функцию соответствующего участка. [c.282]
Следует отметить, что не все мембранные белки синтезируются на мембраносвязанных рибосомах и, следовательно, входят в мембрану ко-трансляционно. Например, цитохром bs и NADH-цитохром-Ьб-редуктаза синтезируются на свободных рибосомах и инкорпорируются в мембраны посттрансляционно. Эти белки, будучи освобождены из рибосом в цитоплазму в виде завершенных цепей, имеют высокое сродство к мембранам (возможно, за счет гидрофобного С-концевого домена) и легко вступают с ними во взаимодействие в их свернутом виде, независимо от рибосом.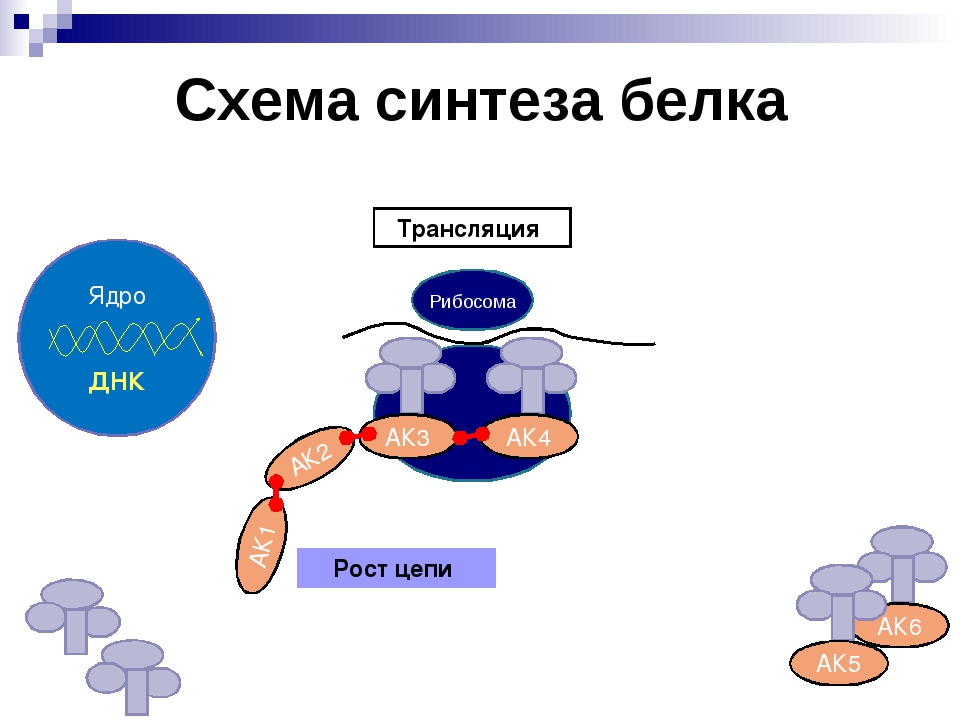 [c.282]
[c.282]
Три другие важные эндопептидазы трипсин, химотрипсин и эластаза, а также одна экзопептидаза-карбоксипептидаза, участвующие в дальнейшем после действия пепсина в переваривании белков, синтезируются в поджелудочной железе. Все они вырабатываются в неактивной форме, в виде проферментов, и их превращение в активные ферменты происходит в тонкой кишке, куда они поступают с панкреатическим соком. [c.420]
В. thuringiensis ssp. kurstaki, практически не экспрессируются в растениях (табл. 18.1), а для выведения представляющих коммерческий интерес жизнеспособных растений, устойчивых к насекомым-вредителям, необходимо, чтобы эти белки синтезировались в больщом количестве. Пытаясь решить эту проблему, уменьшили размер встроенного гена так, чтобы синтезировалась только N-концевая часть молекулы токсина, и снабдили его сильным растительным промотором, чтобы повысить уровень экспрессии. Количество синтезируемого токсина при этом значительно увеличилось, и трансгенные растения получили некоторую защиту от насекомых-вредителей. [c.390]
[c.390]
С разработкой Т1-плазмидной системы трансформации растений у исследователей появилась возможность введения в них чужеродных генов с целью синтеза различных ценных белковых продуктов. Вначале большинство генов, вводимых в растительные ютетки, находились под транскрипционным контролем сильного конститутивного 358-промотора вируса мозаики цветной капусты или немного менее сильного конститутивного промотора гена нопалинсинтазы, содержащегося в некоторьгх Т-ДНК. Однако для получения растений с новыми полезными признаками часто бывает необходимо, чтобы специфические белки синтезировались только в определенной тка- [c.403]
Внутриклеточные белки синтезируются на свободных рибосомах. Они не имеют сигнальных последовательностей, однако в больщинстве своем синтезируются в виде пробелков. Некоторые из них после соответствующего процессинга функционируют в цитоплазме, другие импортируют во внутриклеточные органеллы. Кроме адресной модификации, существуют многообразные химические модификации и локальный протеолиз белков, необходимые для их полноценного функционирования. Такими модификациями могут быть фосфорилирование по гидроксильным группам аминокислот, метилирование, гидроксилирование, присоединение карбоксильных, сульфо- и ацетильных групп и др. [c.470]
Такими модификациями могут быть фосфорилирование по гидроксильным группам аминокислот, метилирование, гидроксилирование, присоединение карбоксильных, сульфо- и ацетильных групп и др. [c.470]
Многие функционально важные белки синтезируются в виде неактивных предшественников, от которых затем отщепляются биологически активные продукты. Зачастую правильное направление фрвгментации диктуется олигосахаридными цепями. Нвпример, ряд гормонов гипофиза образуется в результате направленного протеолиза единого предшественника, несущего углеводные цепи,— препроопиомеланокортина (см. с. 271). [c.507]
Многими авторами убедительно показано, что кристаллы белка синтезируются из аминокислот, поступающих из питательной среды и из цитоплазмы вегетативной клетки. Кристаллы имеют кубическую или тетрагональную форму. Они выявляются также у Вас. ereus и Вас. рорНИае. Эти кристаллы вызывают интоксикацию насекомых переносчиков заболеваний и вредителей сельскохозяйственных культур.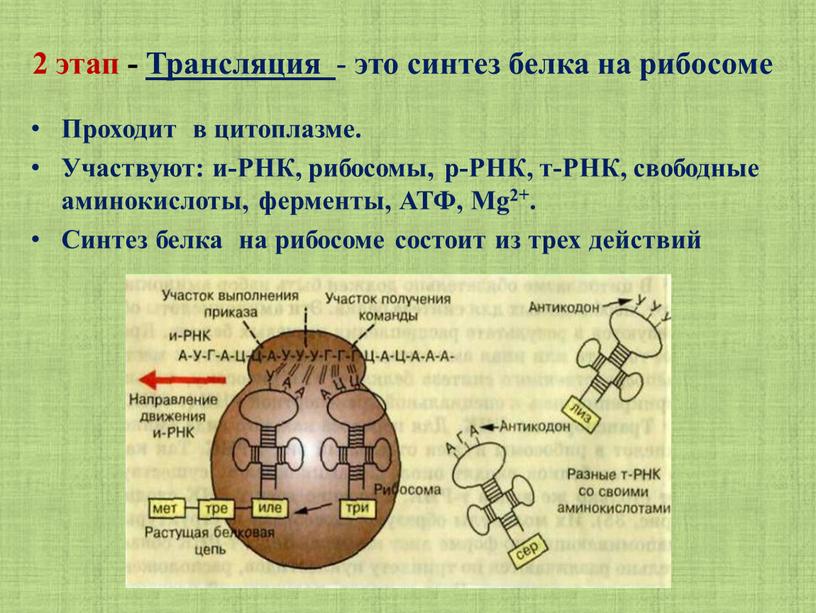 В то же время они безвредны для млекопитающих, птиц и полезных насекомых. На этой избирательности их действия строится практика использования указанных выше культур в народном хозяйстве. Ряд исследователей считают, что в будущем биологические методы и средства борьбы с вредителями сельского хозяйства окажутся преобладающими. [c.137]
В то же время они безвредны для млекопитающих, птиц и полезных насекомых. На этой избирательности их действия строится практика использования указанных выше культур в народном хозяйстве. Ряд исследователей считают, что в будущем биологические методы и средства борьбы с вредителями сельского хозяйства окажутся преобладающими. [c.137]
Многие аминокислоты, необходимые для строи-телыггва белка, синтезируются в организме человека. Однако существует восемь кислот, которые наши клетки не могут производить. Эти аминокислоты, которые мы должны получать с пищей, называют неза-менимыми аминокислотами. [c.80]
Поскольку белки синтезируются в рибосомах, была выдвинута гипотеза, что рибосомы возникают в ядрах и рибосомная РНК служит матрицей. Совсем недавно эта гипотеза была отвергнута. Исследования, проведенные с Е. oli, зараженной фагом, показали, что, хотя после заражения и синтезируется белок, специфичный для данного фага, он образуется в рибосомах, которые существовали до вхождения фага в клетку.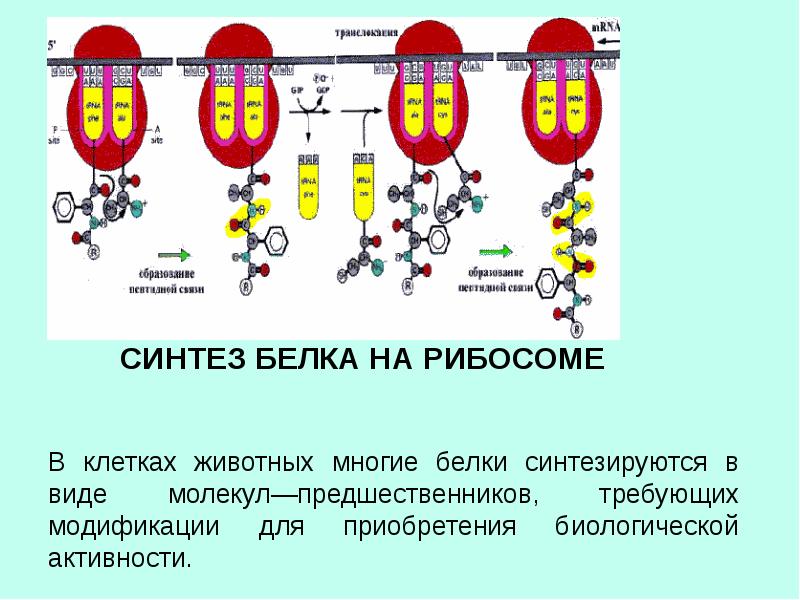 Действительно, после заражения не было обнаружено никаких вновь образованных рибосом. В последующих опытах с бактериями получены данные о существовании до сих пор неизвестного типа РНК, названного информационной РНК (т-РНК). Имеются данные, что т-РНК составляет небольшую часть всей РНК клетки. Она лабильна, быстро обновляется, имеет такое же соотношение оснований, как ДНК, и может обратимо присоединяться к рибосомам. Предполагают, что т-РНК, образованная в ядрах, действует как матрица при синтезе белка в рибосоме. Быстрое обновление т-РНК использовали для того, чтобы показать, что данная матрица существует очень короткое время. Если все высказанные гипотезы правильны, то рибосому следует рассматривать как неспецифичную структуру, которая может синтезировать различные белки в соответствии с присутствующей в ней т-РНК. [c.487]
Действительно, после заражения не было обнаружено никаких вновь образованных рибосом. В последующих опытах с бактериями получены данные о существовании до сих пор неизвестного типа РНК, названного информационной РНК (т-РНК). Имеются данные, что т-РНК составляет небольшую часть всей РНК клетки. Она лабильна, быстро обновляется, имеет такое же соотношение оснований, как ДНК, и может обратимо присоединяться к рибосомам. Предполагают, что т-РНК, образованная в ядрах, действует как матрица при синтезе белка в рибосоме. Быстрое обновление т-РНК использовали для того, чтобы показать, что данная матрица существует очень короткое время. Если все высказанные гипотезы правильны, то рибосому следует рассматривать как неспецифичную структуру, которая может синтезировать различные белки в соответствии с присутствующей в ней т-РНК. [c.487]
Очень важной характеристикой структуры любого полимера является природа связей, соединяющих мономерные звенья. В 1902 г. Гофмейстер и Фишер независимо друг от друга высказали предположение о том, что белки синтезируются в результате образования вторичных амидных связей между а-карбоксильными группами и а-аминогруппами соседних аминокислот. Такие связи называют пептидными связями, а структуры, возникающие в результате образования пептидных связей между остатками аминокислот,— пептидами. Пептид, содержащий два аминокислотных остатка, называют дипептидом пептид, содержащий три остатка, — трипептидом и т. д. Нин е в качестве примера приведена структурная формула тетрапеи- [c.49]
Такие связи называют пептидными связями, а структуры, возникающие в результате образования пептидных связей между остатками аминокислот,— пептидами. Пептид, содержащий два аминокислотных остатка, называют дипептидом пептид, содержащий три остатка, — трипептидом и т. д. Нин е в качестве примера приведена структурная формула тетрапеи- [c.49]
Если, например, взять 300 аминокислот по десяти от каждой из 30 различных групп, то оказывается, что из этого количества можно создагь около единицы с пятьюдесятью нулями (10 °) различных комбинаций белков и каждый из них будет обладать отличными от других свойствами. Большинство таких белков синтезируется животными и растительными организмами. [c.63]
В настоящее время твердо установлено, что все метаболические реакции протекают при участии ферментов. Однако а priori очевидно, что фермент не может определять специфическую для каждого белка последовательность аминокислот, поскольку ферменты сами являются белками. Даже в бактериальной клетке содержится около 1000 ферментов. Если считать, что специфическая последовательность аминокислот в каждом белке обусловлена действием набора ферментов (или даже одним ферментом), то число ферментов окажется очень большим. Если же еще учесть число ферментов, необходимых для синтеза уже известных ферментов, то довольно быстро можно прийти к астрономическому числу. Поэтому необходимо допустить, что белки синтезируются с помощью какой-то матрицы, на которой аминокислоты сначала располагаются в правильной последовательности, а затем соединяются. Предполагают, что такой матрицей служит РНК, а местом, где происходит соединение аминокислот, — рибосомы. [c.370]
Даже в бактериальной клетке содержится около 1000 ферментов. Если считать, что специфическая последовательность аминокислот в каждом белке обусловлена действием набора ферментов (или даже одним ферментом), то число ферментов окажется очень большим. Если же еще учесть число ферментов, необходимых для синтеза уже известных ферментов, то довольно быстро можно прийти к астрономическому числу. Поэтому необходимо допустить, что белки синтезируются с помощью какой-то матрицы, на которой аминокислоты сначала располагаются в правильной последовательности, а затем соединяются. Предполагают, что такой матрицей служит РНК, а местом, где происходит соединение аминокислот, — рибосомы. [c.370]
Биологи из МГУ выяснили, как начинает синтезироваться белок в живой клетке
Ученые из МГУ имени М.В.Ломоносова под руководством Сергея Дмитриева (НИИ физико-химической биологии имени А.Н. Белозерского МГУ) прояснили, как живая клетка решает, откуда начать синтез белка. Исследование было опубликовано в журнале Nucleic Acids Research (импакт-фактор 9.1).
Исследование было опубликовано в журнале Nucleic Acids Research (импакт-фактор 9.1).
Трудности перевода
Существенная доля нашей генетической информации, закодированной в ДНК, реализуется в живой клетке в виде белков. Для того, чтобы синтезировать нужный белок, эту информацию нужно перевести из последовательности нуклеотидов на язык аминокислот. Эта стадия преобразования называется трансляцией, и участвует в ней не ДНК, а матричная РНК — «временный носитель», на котором находится копия одного конкретного гена. Специальная молекулярная машина — рибосома — движется по матричной РНК и считывает тройки нуклеотидов, каждая из которых кодирует ту или иную аминокислоту.
Сложность заключается в том, что нуклеотиды матричной РНК просто следуют один за другим, и рибосома должна определить, с какого места ей необходимо начинать считывание. Если же первая тройка нуклеотидов будет выбрана неверно, рибосома начнет синтезировать неправильный белок, который окажется бесполезным или даже токсичным для клетки.
Сканирование и соскальзывание
«Для решения этой проблемы существует специальный механизм — рибосомное сканирование, — говорит Илья Теренин, соавтор работы. — Сначала малая субчастица рибосомы, нагруженная специальными белками, связывается с концом матричной РНК (которую можно сравнить с «ксерокопией» текста, записанного в ДНК: это как бы “инструкция” по сборке белковой молекулы). Затем рибосома начинает перемещаться по мРНК, «просматривая», как на конвейере, один за другим все встречающиеся ей тройки нуклеотидов. Как правило, в качестве точки старта используется тройка нуклеотидов «аденин-урацил-гуанин» (AUG). Когда рибосома находит его, она останавливается и начинает синтез белка. Ранее считалось, что обнаружение AUG — единственное и важнейшее событие, приводящее к началу синтеза с нужной точки, однако мы обнаружили, что это далеко не всегда так».
Когда малая субчастица встречает тройку нуклеотидов AUG, она может начать сборку белковой молекулы (инициировать трансляцию), а может и не начать.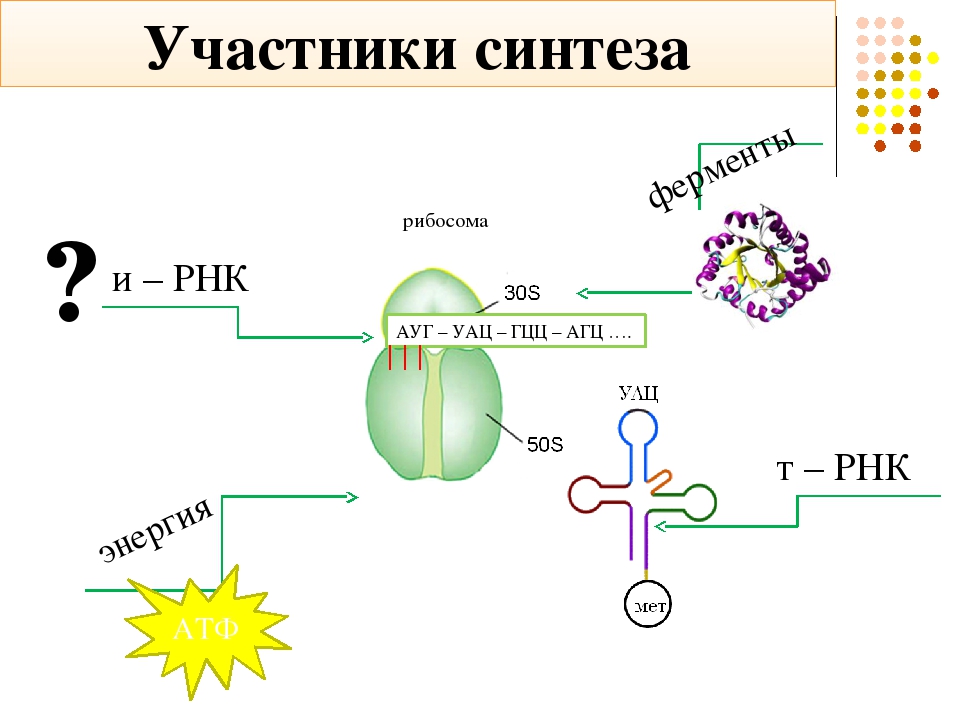 Это зависит от того, какой набор белков-помощников будет в ее распоряжении. Эти специальные белки так и называются — факторы инициации трансляции (сокращенно — eIF). Они имеют номера: так, у эукариот (организмов с ядром в клетке, к которым относимся и мы с вами) один из самых важных факторов — второй, или eIF2. Он вместе с транспортной РНК привозит первый «кирпичик» белка — аминокислоту метионин. В конце к малой субчастице рибосомы должна присоединиться еще и большая. Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
Это зависит от того, какой набор белков-помощников будет в ее распоряжении. Эти специальные белки так и называются — факторы инициации трансляции (сокращенно — eIF). Они имеют номера: так, у эукариот (организмов с ядром в клетке, к которым относимся и мы с вами) один из самых важных факторов — второй, или eIF2. Он вместе с транспортной РНК привозит первый «кирпичик» белка — аминокислоту метионин. В конце к малой субчастице рибосомы должна присоединиться еще и большая. Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
«Как оказалось, если гидролиза не произойдет, то малая субчастица проигнорирует стартовый кодон AUG и проскользнет дальше, как ни в чем не бывало. Мы назвали это слайдингом (от англ. sliding — “соскальзывание”)», — подводит итог Сергей Дмитриев.
Мы назвали это слайдингом (от англ. sliding — “соскальзывание”)», — подводит итог Сергей Дмитриев.
Слайдинг по-семейному
Вышеизложенное можно попробовать объяснить следующей аналогией. Малая субчастица рибосомы — непоседливая младшая сестра в семье, которая в выходной встала раньше всех и хочет поиграть в конструктор — пособирать белок из аминокислот-деталек.
Большая субчастица — это старшая сестра, которая знает правила игры и умеет, в отличие от младшей, читать инструкцию по сборке красивых и сложных молекул, но устала за неделю и хочет выспаться. Она понимает, что младшая сестра будет плакать, если совсем не прийти к ней, и еще вчера пообещала с ней поиграть, поэтому поставила несколько будильников (троек нуклеотидов AUG).
Однако, как и все люди, которые ставят несколько будильников, она редко просыпается с первого раза, игнорируя сигнал AUG. Чтобы она проснулась и встала от очередного будильника, нужно успеть приготовить ее любимые блинчики на завтрак (гидролизовать ГТФ), которые своим запахом выманят соню из-под теплого одеяла. Папа (eIF2) тоже встает рано, он даже сходил в магазин за мукой (присоединил ГТФ), но печь блинчики он не умеет. Зато это умеет мама (eIF5), от которой и зависит успех всей затеи.
Папа (eIF2) тоже встает рано, он даже сходил в магазин за мукой (присоединил ГТФ), но печь блинчики он не умеет. Зато это умеет мама (eIF5), от которой и зависит успех всей затеи.
Таким образом, слайдинг — это игнорирование будильника. А когда все нужные факторы присутствуют, старшая сестра просыпается, ест и идет играть (собирать белки) с младшей сестрой.
Скользит и узнает
Открытие слайдинга опровергает устоявшееся мнение о том, что процесс выбора точки начала трансляции заканчивается на моменте распознавания точки старта синтеза. Решающим событием является не узнавание AUG, а гидролиз ГТФ.
Интересно, что примерно у половины матричных РНК стартовым кодоном является не первый AUG от конца молекулы, а второй, третий и даже более удаленный. До сих пор единственным объяснением этому было явление, именуемое в англоязычной литературе «leaky scanning» — при этом рибосома «проезжает» мимо первого AUG, не узнавая его.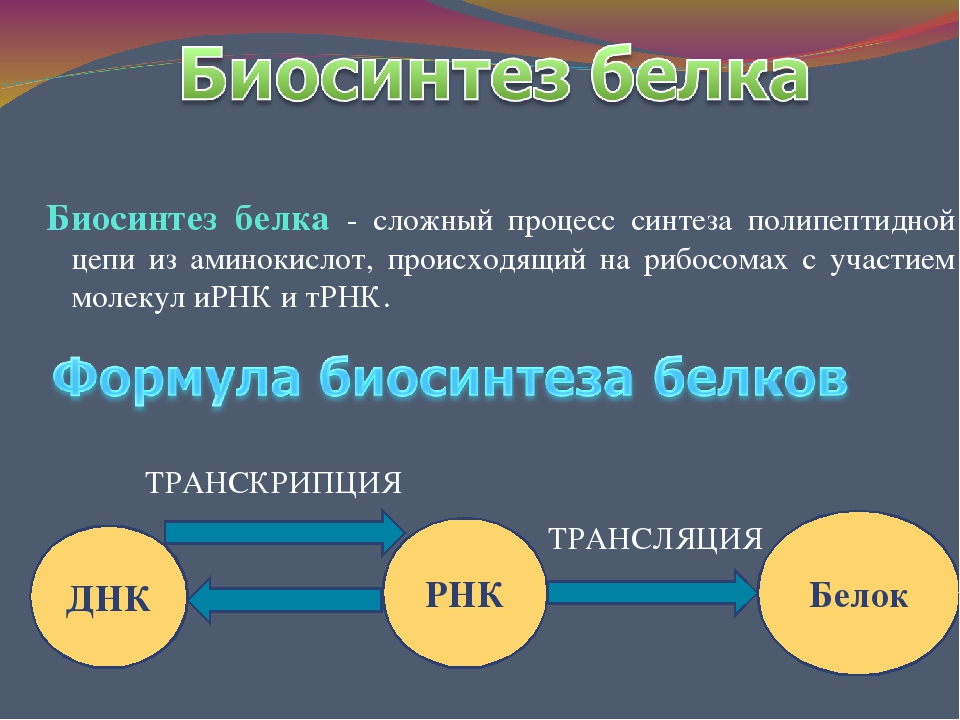 Однако leaky scanning требует, чтобы первый AUG находился в определенном нуклеотидном контексте, а это далеко не всегда так. Ученые показали, что возможно и другое объяснение: узнавание этих «преждевременных» AUG все-таки происходит, но после этого рибосома все равно оказывается на правильном стартовом кодоне благодаря открытому исследователями слайдингу.
Однако leaky scanning требует, чтобы первый AUG находился в определенном нуклеотидном контексте, а это далеко не всегда так. Ученые показали, что возможно и другое объяснение: узнавание этих «преждевременных» AUG все-таки происходит, но после этого рибосома все равно оказывается на правильном стартовом кодоне благодаря открытому исследователями слайдингу.
Синтез белка в митохондриях может происходить без ключевого компонента
Это открытие может позволить создать новые антибиотики и разобраться в причинах болезни Паркинсона.
Ученые с кафедры молекулярной биологии МГУ, под руководством
младшего научного сотрудника Антона Кузьменко, совместно с
коллегами из Швеции, обнаружили, что синтез белка в митохондриях
пекарских дрожжей может проходить без участия одного из трех
компонентов, которые до сих пор считались совершенно необходимыми
для безъядерных клеток. Об этом открытии, полные результаты
которого опубликованы в журнале Scientific
Reports, рассказывается в пресс-релизе Московского
университета.
Белки в живой клетке синтезируются в соответствии с кодом матричной РНК (рибонуклеиновой кислоты), которая, в свою очередь, является «слепком» с нужного участка ДНК. Происходит процесс синтеза белка в особой органелле клетки — рибосоме. Активируют процесс синтеза специальные белки — факторы трансляции. У прокариот, то есть у организмов, клетки которых не имеют ядер (это бактерии и археи) факторов трансляции обнаружено три: IF1, IF2 и IF3. Что же касается эукариот — организмов с ядрами в клетках, в том числе и мы с вами — число этих факторов превышает 20.
Митохондрии — органеллы, «энергетические станции» наших клеток —
теоретически должны были бы синтезировать белки как прокариоты.
Дело в том, что, согласно господствующей сейчас в науке теории,
митохондрии как раз и были когда-то самостоятельными
одноклеточными безъядерными организмами, наподобие бактерий,
которых наши опять же одноклеточные, но уже эукариотические
предки «проглотили», но, вместо того, чтобы переварить, поставили
себе на службу. (См. также наш материал
«Митохондрии: путь от паразита до благодетеля».) В
результате, у митохондрий остались многие черты самостоятельных
организмов: собственная ДНК, и даже свои рибосомы, в которых тоже
происходит синтез белка.
(См. также наш материал
«Митохондрии: путь от паразита до благодетеля».) В
результате, у митохондрий остались многие черты самостоятельных
организмов: собственная ДНК, и даже свои рибосомы, в которых тоже
происходит синтез белка.
Ранее у митохондрий было открыто три белка-фактора трасляции: mtIF1, mtIF2 и mtIF3. Казалось бы, все «шло по плану», полностью согласуясь с теорией. Однако эксперимент ученых из Московского университета, имевший своей целью доказать, что фактор mtIF3 (идентифицированный позже других) так же необходим для синтеза белка, как и первые два, дал неожиданный результат.
Молекулярные биологи «вырезали» из митохондриальной ДНК пекарских
дрожжей ген, кодирующий белок mtIF3, а на его место вставили ген
устойчивости к антибиотику, добавленному к питательной среде,
чтобы все клетки, в которых ген остался, погибли. К удивлению
ученых, митохондрии выживших клеток, не имевшие третьего фактора
трансляции, продолжали успешно синтезировать белки.
«Биосинтез белка в этих условиях шел, в целом, примерно с той же эффективностью, что и в нормальных дрожжевых митохондриях, но был сильно “разбалансирован”. Другими словами, некоторых митохондриальных белков в отсутствие mtIF3 действительно становилось меньше, зато количество других вырастало в несколько раз!» — рассказал ведущий научный сотрудник Петр Каменский, один из основных авторов исследования.
Скорее всего, предполагают теперь ученые, mtIF3 имеет и другие функции в клетке — координирует соотношение производимых в митохондриях белков. Поскольку ранее была установлена связь между нарушением такой координации и развитием болезни Паркинсона, это открытие, возможно, поможет лучше разобраться в механизмах этой болезни и разработать новые методы ее лечения.
Кроме того, открытие ученых из МГУ открывает дорогу к более
точному моделированию системы митохондриальной трансляции in
vitro ( «в пробирке»). Такие модели, разработанные для
эукариотических и бактериальных клеток, уже некоторое время
помогают ученым тестировать лекарства (включая новые антибиотики)
и ставить другие важные эксперименты.
[Публикация подготовлена Центром популяризации научных знаний МГУ им. М.В. Ломоносова]
Биология клетки/Часть 1. Клетка как она есть/9/1 — Викиучебник
Материал из Викиучебника — открытых книг для открытого мира
Рибосомы — внутриклеточные органоиды, осуществляющие синтез белков. От синтезируемого в данный момент белка зависит расположение рибосомы в клетке.
«Свободные» рибосомы плавают в цитоплазме, не прикрепляясь к мембранам. Эти рибосомы синтезируют белки, которые работают в цитоплазме или поступают из цитоплазмы в митохондрии, пластиды и ядро. Например, протонная АТФ-синтетаза — белок, работающий в митохондриях; следовательно, рибосома, которая её синтезирует- «свободная». Миозин — двигательный белок, работающий в цитоплазме клетки, также синтезируется «свободными» рибосомами. ДНК-полимераза синтезируется «свободными» рибосомами, т.к. находится в ядре.
«Сидячие» рибосомы прикреплены к мембранам шероховатой эндоплазматической сети (ЭПС).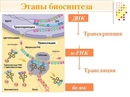 Эти рибосомы синтезируют белки, поступающие в ЭПС. Большинство из таких белков затем поступает в АГ, а оттуда — в лизосомы, на наружную мембрану или во внеклеточную среду (секреция). Например, рецептор SRP — белок, который работает на мембране ЭПС, а следовательно рибосома, синтезирующая его — «сидячая». Белок коллаген выделяется во внешнюю среду; значит, рибосома — «сидячая».
Эти рибосомы синтезируют белки, поступающие в ЭПС. Большинство из таких белков затем поступает в АГ, а оттуда — в лизосомы, на наружную мембрану или во внеклеточную среду (секреция). Например, рецептор SRP — белок, который работает на мембране ЭПС, а следовательно рибосома, синтезирующая его — «сидячая». Белок коллаген выделяется во внешнюю среду; значит, рибосома — «сидячая».
Котрансляционный транспорт в ЭПР[править]
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР.
Сигнальная (лидерная) последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленной от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой (за счет этого лидерные последовательности удаляются после завершения синтеза белка). Сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК.
В состав SRP входит шесть белков и короткая молекула РНК.
Анимация, демонстрирующая процесс котрансляционного транспорта. Общая продолжительность ролика — 2 минуты
Этапы синтеза и транспорта белков в ЭПР:
- Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
- Вместе с SRP рибосома перемещается к ЭПР и связывается с рецептором SRP (интегральным белком) на цитозольной стороне мембраны ЭПР. Этот комплекс (рибосома — SRP — рецептор SRP) связывается с порой — транслокатором белка на мембране ЭПР. Обычно с мРНК связаны несколько рибосом, и на мембране ЭПР сидят полирибосомы, причем каждая рибосома присоединена к своей поре. Дойдя до 3′-конца мРНК, рибосома возвращается в цитоплазму, однако мРНК удерживается у мембраны ЭПР за счет того, что новые рибосомы, cвязанные с SRP, присоединяются к ее 5′-концу.
- После связывания с транслокатором комплекс SRP — рецептор SRP отделяется от рибосомы, и это приводит к возобновлению трансляции.
 Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток). - После возобновления трансляции гидрофобный участок сигнальной последовательности остается связан с транслокатором, а вновь синтезируемый белок в виде петли проталкивается внутрь ЭПР. Этот процесс не требует дополнительных затрат энергии АТФ. После того, как С-конец белка отделяется от рибосомы и оказывается внутри ЭПР, протеаза сигнальной последовательности отрезает ее от белка. Белок внутри ЭПР сворачивается, приобретая нормальную конформацию, а сигнальный пептид через открывшийся в транслокаторе боковой канал перемещается в липидный бислой мембраны ЭПР, где быстро разрушается протеазами.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, а белок-шаперон BiP препятствует неправильному сворачиванию и аггрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, а белок-шаперон BiP препятствует неправильному сворачиванию и аггрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
Встраивание белков в мембраны ЭПР[править]
Похожий, но более сложный механизм обеспечивает котрансляционное встраивание трансмембранных белков в мембрану ЭПР.
[1] — Видео с описанием транслокации белка в ЭПР. Также описан процесс встраивания в мембрану. Третье издание «Молекулярной биологии клетки» Б. Альбертса и др.
Посттрансляционный транспорт в ЭПР[править]
Существует также посттранляционный транспорт белков в ЭПР (более обычный у дрожжей), при котором полностью синтезированный белок связывается в цитозоле с шаперонами, а затем переносится в ЭПР через транслокатор при участии шаперонов семейства Hsp70.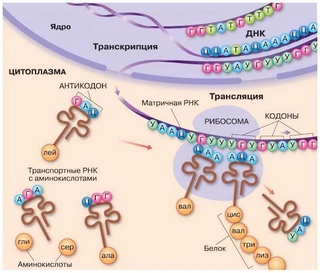 Этот вид транспорта является АТФ-зависимым. Для транспорта пептидов (длиной преимущественно в 8-16 аминокислот) из цитозоля в ЭПР для последующей их презентации в комплексе с молекулами MHC-I существует специальный транслокатор — TAP-белок.
Этот вид транспорта является АТФ-зависимым. Для транспорта пептидов (длиной преимущественно в 8-16 аминокислот) из цитозоля в ЭПР для последующей их презентации в комплексе с молекулами MHC-I существует специальный транслокатор — TAP-белок.
Синтез белков контролируется молекулярным таймером
Генетическая информация, закодированная в ДНК, сначала копируется в молекулы матричной РНК (мРНК), с которой впоследствии синтезируются соответствующие белки. Каждой аминокислоте белка соответствуют три нуклеотида (триплет или кодон) в мРНК. За синтез белка отвечает рибосома — специальная внутриклеточная молекулярная машина. Сигналом к окончанию синтеза белка служат три стоп-кодона, в большинстве организмов это UGA, UAA и UAG (U — урацил, A — аденин, G — гуанин). Длина мРНК всегда больше, чем рамка считывания — участок, который несет в себе генетическую информацию о белке. Те участки, которые не кодируют информацию о белке, называются нетранслируемыми (некодирующими) областями.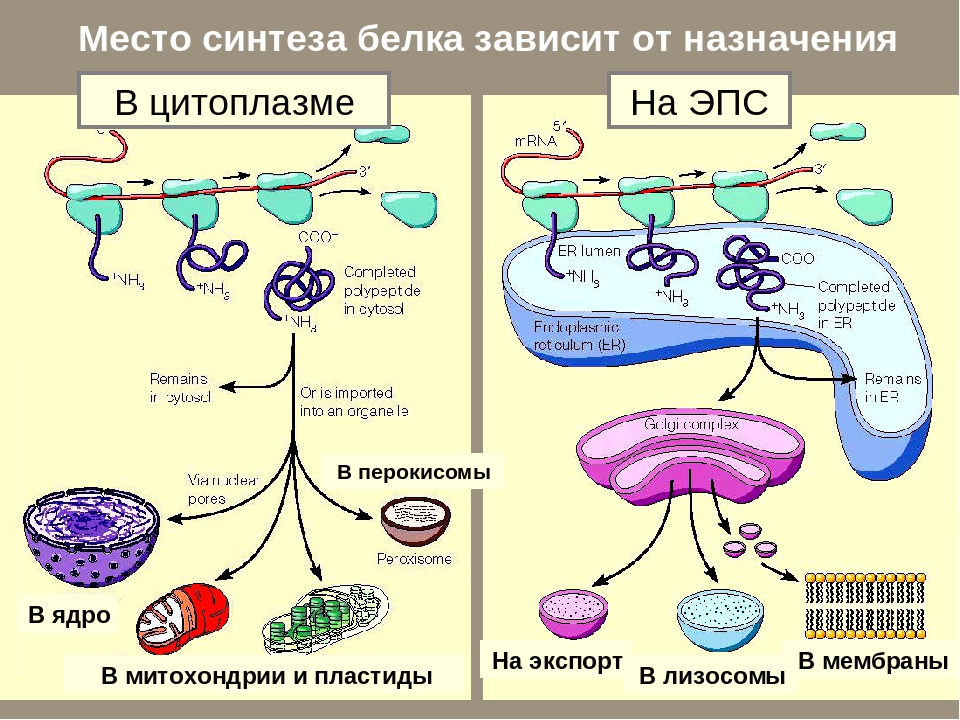 У млекопитающих часто встречаются случаи, когда размер некодирующих областей намного превышает размер рамки считывания и составляет тысячи нуклеотидов. Поскольку синтез мРНК — энергозатратный процесс, ученых давно интересует вопрос, зачем же нужны эти огромные нетранслируемые участки.
У млекопитающих часто встречаются случаи, когда размер некодирующих областей намного превышает размер рамки считывания и составляет тысячи нуклеотидов. Поскольку синтез мРНК — энергозатратный процесс, ученых давно интересует вопрос, зачем же нужны эти огромные нетранслируемые участки.
Известно, что нетранслируемые участки регулируют жизненный цикл мРНК. В отличие от ДНК, мРНК через какое-то время уничтожается в клетке. Некоторые молекулы мРНК еще долго «живут» после синтеза, а некоторые распадаются уже через несколько минут. Нетранслируемые области мРНК зачастую играют в этом решающую роль.
Еще одна важная функция: нетранслируемые участки мРНК регулируют синтез белка. Известно множество примеров, когда с нетранслируемыми областями мРНК связываются регуляторные белки (или короткие РНК), которые или подавляют, или стимулируют синтез белка. Это позволяет клетке быстро «включать» или «выключать» синтез определенных белков. Это важно, так как в зависимости от окружающих условий клетке необходим строго определенный набор белков. Нарушение регуляции синтеза может привести к бесконтрольному производству белков. Например, дерегуляция белков, отвечающих за клеточное деление, создает опасность для начала неконтролируемого роста числа клеток — одной из главных особенностей раковых клеток.
Нарушение регуляции синтеза может привести к бесконтрольному производству белков. Например, дерегуляция белков, отвечающих за клеточное деление, создает опасность для начала неконтролируемого роста числа клеток — одной из главных особенностей раковых клеток.
Изучая регуляцию трансляции мРНК фермента Amd1, ключевого на пути биосинтеза полиаминов (полимеров, содержащих аминогруппы), ученые из Университетского колледжа Корка, Медицинской школы Гарварда, МГУ имени М.В. Ломоносова и Департамента генетики человека Университета Юты обнаружили новый механизм регуляции синтеза белка.
«Давно известно, что рибосома плохо умеет синтезировать последовательности некоторых триплетов, — говорит Дмитрий Андреев, старший научный сотрудник НИИ физико-химической биологии имени А.Н. Белозерского МГУ, — поэтому, когда такая последовательность ей попадается, рибосома может прочно застрять на мРНК. Из-за этого все рибосомы, едущие вслед за ней, тоже моментально застрянут, поскольку не могут «перепрыгнуть» застрявшего товарища, и тогда продукция белка прекратится.
Исследуя регуляцию Amd1, мы обнаружили такой сигнал застревания. Но интересно оказалось то, что этот сигнал расположен после стоп кодона рамки считывания Amd1. Зачем же он там нужен?»
Дело в том, что трансляционный аппарат не должен допускать ошибки в синтезе белков, поскольку неправильные белки могут навредить клетке. Его точность имеет свои границы. Так, рибосома, дошедшая до стоп-кодона, может по ошибке прочитать его как аминокислоту и двинуться дальше, синтезируя более длинный белок. Вероятность такого события достаточно мала: по словам ученых, обычно она не превышает доли процента. Но именно прочтение стоп-кодона оказалось ключевым к пониманию нового механизма регуляции Amd1.
Ученые определили, что примерно 1 из 60 рибосом проезжает стоп-кодон Amd1, но через некоторое расстояние она очень прочно застревает на «плохой» последовательности. При этом ничего страшного не происходит, но следующая проехавшая стоп-кодон рибосома застревает в очереди за первой. И так до тех пор, пока «очередь» из застрявших рибосом не доберется до стоп кодона. Как только это произойдет, продукция белка сразу же прекратится.
И так до тех пор, пока «очередь» из застрявших рибосом не доберется до стоп кодона. Как только это произойдет, продукция белка сразу же прекратится.
«Мы назвали такой механизм регуляции синтеза белка молекулярным таймером, — рассказывает Андреев, — ведь в молекуле такой мРНК, по сути, «зашит» механизм, позволяющий точно контролировать, сколько молекул белка будет синтезировано. Даже если рибосомы начнут усиленно «садиться» на такую мРНК, прочитывание стоп-кодона с последующим застреванием — молекулярный таймер — позаботится о том, чтобы выключить синтез белка через определенное число циклов».
Стоит отметить, что Amd1 обладает онкогенными свойствами, ранее было показано, что его усиленная продукция в клетке может приводить к появлению чрезвычайно агрессивных метастазирующих опухолей. Если научиться «включать» таймер, регулирующий его синтез (например, усиливая прочтение стоп-кодона), с помощью лекарственных препаратов, то такой подход может найти применение в медицине. Сегодня уже разрабатываются препараты, действие которых основано на усилении прочтения стоп-кодонов – один из таких препаратов уже одобрен в Европе для лечения дистрофии Дюшена.
Сегодня уже разрабатываются препараты, действие которых основано на усилении прочтения стоп-кодонов – один из таких препаратов уже одобрен в Европе для лечения дистрофии Дюшена.
Ученые выяснили, как синтез белка влияет на старение
https://ria.ru/20200706/1573957800.html
Ученые выяснили, как синтез белка влияет на старение
Ученые выяснили, как синтез белка влияет на старение
Биологи из Московского государственного университета совместно с коллегами из Гарвардской школы медицины изучили, как меняется с возрастом биосинтез белка в… РИА Новости, 06.07.2020
2020-07-06T14:46
2020-07-06T14:46
2020-07-06T14:47
наука
старение
биология
здоровье
открытия — риа наука
российская академия наук
мгу имени м. в. ломоносова
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/148823/03/1488230305_0:270:5184:3186_1920x0_80_0_0_f8f200a853bd5b5b9af5d31a6908cd98. jpg
jpg
МОСКВА, 6 июл — РИА Новости. Биологи из Московского государственного университета совместно с коллегами из Гарвардской школы медицины изучили, как меняется с возрастом биосинтез белка в органах мышей. Это дает понимание одного из фундаментальных механизмов процесса старения. Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences.В основе старения лежат повреждения, которые со временем накапливаются в клетках, тканях и органах живых организмов. Биосинтез белка — важнейший метаболический процесс, на который клетка тратит большую часть вырабатываемой энергии. Его нарушения вносят большой вклад в старение организма в целом.Известно, что некоторые воздействия, снижающие эффективность белкового синтеза, увеличивают продолжительность жизни животных. Например, при отсутствии аминокислот — когда животное голодает — или в условиях, способствующих денатурации белков — при перегреве или интоксикации — уровень синтеза белка падает, и эта адаптация позволяет организму выжить в неблагоприятных условиях. Эффект замедления синтеза белка, продлевающий жизнь, возникает в организмах некоторых животных при низкокалорийной диете или применении лекарственных средств, снижающих активность одного из главных регуляторов белкового синтеза — протеинкиназы mTOR.Авторы выяснили, что с возрастом в печени и почке мышей происходит нечто похожее: стареющие клетки, как бы чувствуя накопление повреждений, снижают уровень белкового синтеза, чтобы отсрочить наступление неблагоприятных последствий. Задачей ученых было понять механизм этого процесса. Исследованием изменений, происходящих с возрастом в различных организмах — от дрожжей до человека — ученые из НИИ Физико-химической биологии имени А.Н. Белозерского МГУ занимаются с 2017 года. Главным проектом лаборатории стало изучение картины биосинтеза белка в органах мышей разного возраста методом рибосомного профайлинга. «Этот ультрасовременный метод появился относительно недавно и совершил настоящую революцию, привнеся все преимущества системной биологии в область изучения биосинтеза белка, — приводятся в пресс-релизе МГУ слова Сергея Дмитриева, одного из авторов исследования, старшего научного сотрудника НИИ ФХБ МГУ и ИМБ РАН.
Эффект замедления синтеза белка, продлевающий жизнь, возникает в организмах некоторых животных при низкокалорийной диете или применении лекарственных средств, снижающих активность одного из главных регуляторов белкового синтеза — протеинкиназы mTOR.Авторы выяснили, что с возрастом в печени и почке мышей происходит нечто похожее: стареющие клетки, как бы чувствуя накопление повреждений, снижают уровень белкового синтеза, чтобы отсрочить наступление неблагоприятных последствий. Задачей ученых было понять механизм этого процесса. Исследованием изменений, происходящих с возрастом в различных организмах — от дрожжей до человека — ученые из НИИ Физико-химической биологии имени А.Н. Белозерского МГУ занимаются с 2017 года. Главным проектом лаборатории стало изучение картины биосинтеза белка в органах мышей разного возраста методом рибосомного профайлинга. «Этот ультрасовременный метод появился относительно недавно и совершил настоящую революцию, привнеся все преимущества системной биологии в область изучения биосинтеза белка, — приводятся в пресс-релизе МГУ слова Сергея Дмитриева, одного из авторов исследования, старшего научного сотрудника НИИ ФХБ МГУ и ИМБ РАН. — В клетке белок синтезируют специальные молекулярные машины – рибосомы. Они «переводят» (транслируют) последовательности генов с языка азотистых оснований, на котором записана информация в ДНК и РНК, на язык аминокислот, из которых и состоят белки. Метод рибосомного профайлинга позволяет определить одновременно все РНК, которые в данный конкретный момент транслируются рибосомами в клетке. Для этого используется секвенирование нового поколения и сложная биоинформатическая обработка данных».Как биохимическую, так и «компьютерную» части исследования выполняли в МГУ с учетом опыта американских коллег.Выпускница факультета биоинженерии и биоинформатики МГУ Александра Анисимова, первый автор статьи, рассказывает: «Благодаря уникальному опыту, накопленному в лаборатории Вадима Гладышева в Бостоне, мы смогли применить метод рибосомного профайлинга к двум органам — печени и почке — мышей разного возраста. Это позволило детально охарактеризовать изменения в экспрессии генов на уровне биосинтеза белка при старении.
— В клетке белок синтезируют специальные молекулярные машины – рибосомы. Они «переводят» (транслируют) последовательности генов с языка азотистых оснований, на котором записана информация в ДНК и РНК, на язык аминокислот, из которых и состоят белки. Метод рибосомного профайлинга позволяет определить одновременно все РНК, которые в данный конкретный момент транслируются рибосомами в клетке. Для этого используется секвенирование нового поколения и сложная биоинформатическая обработка данных».Как биохимическую, так и «компьютерную» части исследования выполняли в МГУ с учетом опыта американских коллег.Выпускница факультета биоинженерии и биоинформатики МГУ Александра Анисимова, первый автор статьи, рассказывает: «Благодаря уникальному опыту, накопленному в лаборатории Вадима Гладышева в Бостоне, мы смогли применить метод рибосомного профайлинга к двум органам — печени и почке — мышей разного возраста. Это позволило детально охарактеризовать изменения в экспрессии генов на уровне биосинтеза белка при старении.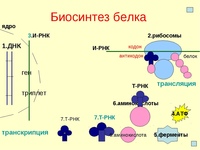 Мы обнаружили изменения в синтезе компонентов многих важных процессов и регуляторных путей, в том числе связанных с иммунитетом, воспалением, внеклеточным матриксом и метаболизмом жиров. Но самое яркое наблюдение, которое мы сделали, касается снижения темпов наработки самих компонентов белок-синтезирующего аппарата — рибосомных белков и трансляционных факторов».»Полученные результаты помогают понять фундаментальные механизмы, лежащие в основе процессов старения. Одновременно мы узнаем много нового о молекулярных механизмах биосинтеза белка», — отмечает один из руководителей работы, профессор Гарвардской школы медицины Вадим Гладышев.В настоящее время ученые продолжает исследования с целью выяснения, какие именно воздействия на организм мышей приводят к увеличению продолжительности жизни.
Мы обнаружили изменения в синтезе компонентов многих важных процессов и регуляторных путей, в том числе связанных с иммунитетом, воспалением, внеклеточным матриксом и метаболизмом жиров. Но самое яркое наблюдение, которое мы сделали, касается снижения темпов наработки самих компонентов белок-синтезирующего аппарата — рибосомных белков и трансляционных факторов».»Полученные результаты помогают понять фундаментальные механизмы, лежащие в основе процессов старения. Одновременно мы узнаем много нового о молекулярных механизмах биосинтеза белка», — отмечает один из руководителей работы, профессор Гарвардской школы медицины Вадим Гладышев.В настоящее время ученые продолжает исследования с целью выяснения, какие именно воздействия на организм мышей приводят к увеличению продолжительности жизни.
https://ria.ru/20200428/1570662373.html
https://ria.ru/20200310/1568379308.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.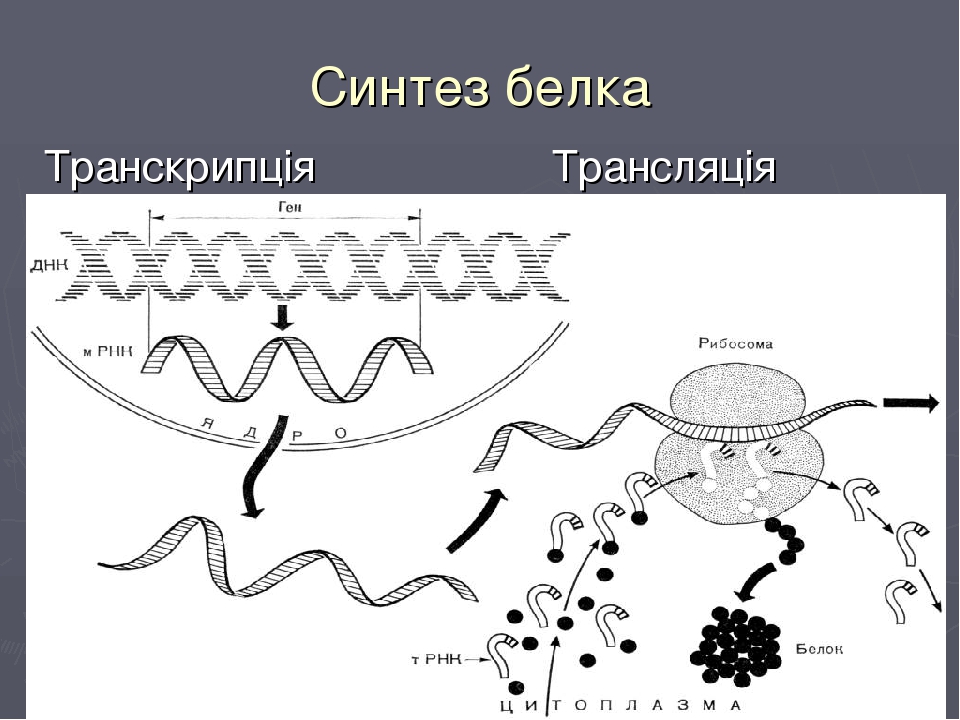 xn--p1ai/awards/
xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/148823/03/1488230305_288:0:4896:3456_1920x0_80_0_0_9c3d71e9bd6a504a98585ecacf112b2e.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
старение, биология, здоровье, открытия — риа наука, российская академия наук, мгу имени м. в. ломоносова
в. ломоносова
В основе старения лежат повреждения, которые со временем накапливаются в клетках, тканях и органах живых организмов. Биосинтез белка — важнейший метаболический процесс, на который клетка тратит большую часть вырабатываемой энергии. Его нарушения вносят большой вклад в старение организма в целом.
Известно, что некоторые воздействия, снижающие эффективность белкового синтеза, увеличивают продолжительность жизни животных. Например, при отсутствии аминокислот — когда животное голодает — или в условиях, способствующих денатурации белков — при перегреве или интоксикации — уровень синтеза белка падает, и эта адаптация позволяет организму выжить в неблагоприятных условиях.
Эффект замедления синтеза белка, продлевающий жизнь, возникает в организмах некоторых животных при низкокалорийной диете или применении лекарственных средств, снижающих активность одного из главных регуляторов белкового синтеза — протеинкиназы mTOR.
Авторы выяснили, что с возрастом в печени и почке мышей происходит нечто похожее: стареющие клетки, как бы чувствуя накопление повреждений, снижают уровень белкового синтеза, чтобы отсрочить наступление неблагоприятных последствий. Задачей ученых было понять механизм этого процесса.
Исследованием изменений, происходящих с возрастом в различных организмах — от дрожжей до человека — ученые из НИИ Физико-химической биологии имени А.Н. Белозерского МГУ занимаются с 2017 года. Главным проектом лаборатории стало изучение картины биосинтеза белка в органах мышей разного возраста методом рибосомного профайлинга.
28 апреля 2020, 09:36
Российские и литовские ученые придумали «вакцину от старения»»Этот ультрасовременный метод появился относительно недавно и совершил настоящую революцию, привнеся все преимущества системной биологии в область изучения биосинтеза белка, — приводятся в пресс-релизе МГУ слова Сергея Дмитриева, одного из авторов исследования, старшего научного сотрудника НИИ ФХБ МГУ и ИМБ РАН.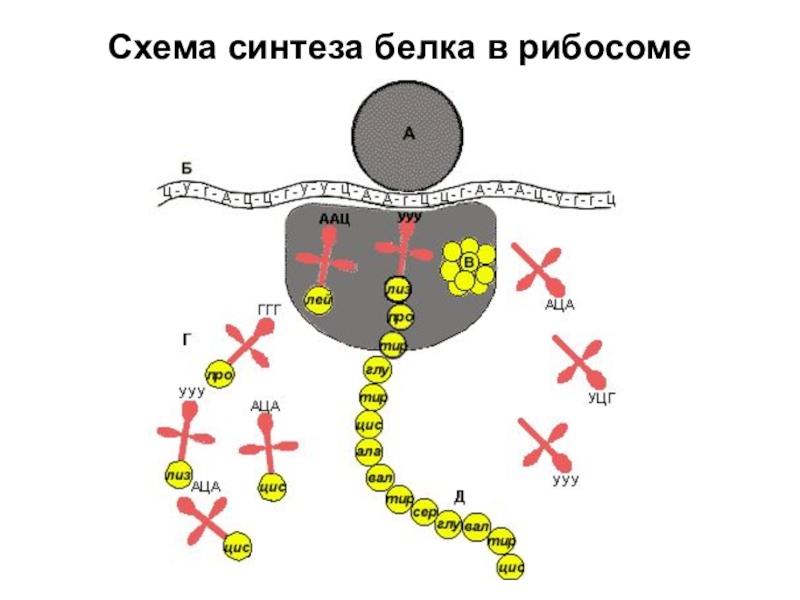 — В клетке белок синтезируют специальные молекулярные машины – рибосомы. Они «переводят» (транслируют) последовательности генов с языка азотистых оснований, на котором записана информация в ДНК и РНК, на язык аминокислот, из которых и состоят белки. Метод рибосомного профайлинга позволяет определить одновременно все РНК, которые в данный конкретный момент транслируются рибосомами в клетке. Для этого используется секвенирование нового поколения и сложная биоинформатическая обработка данных».
— В клетке белок синтезируют специальные молекулярные машины – рибосомы. Они «переводят» (транслируют) последовательности генов с языка азотистых оснований, на котором записана информация в ДНК и РНК, на язык аминокислот, из которых и состоят белки. Метод рибосомного профайлинга позволяет определить одновременно все РНК, которые в данный конкретный момент транслируются рибосомами в клетке. Для этого используется секвенирование нового поколения и сложная биоинформатическая обработка данных».Как биохимическую, так и «компьютерную» части исследования выполняли в МГУ с учетом опыта американских коллег.
Выпускница факультета биоинженерии и биоинформатики МГУ Александра Анисимова, первый автор статьи, рассказывает: «Благодаря уникальному опыту, накопленному в лаборатории Вадима Гладышева в Бостоне, мы смогли применить метод рибосомного профайлинга к двум органам — печени и почке — мышей разного возраста. Это позволило детально охарактеризовать изменения в экспрессии генов на уровне биосинтеза белка при старении. Мы обнаружили изменения в синтезе компонентов многих важных процессов и регуляторных путей, в том числе связанных с иммунитетом, воспалением, внеклеточным матриксом и метаболизмом жиров. Но самое яркое наблюдение, которое мы сделали, касается снижения темпов наработки самих компонентов белок-синтезирующего аппарата — рибосомных белков и трансляционных факторов».
Мы обнаружили изменения в синтезе компонентов многих важных процессов и регуляторных путей, в том числе связанных с иммунитетом, воспалением, внеклеточным матриксом и метаболизмом жиров. Но самое яркое наблюдение, которое мы сделали, касается снижения темпов наработки самих компонентов белок-синтезирующего аппарата — рибосомных белков и трансляционных факторов».
«Полученные результаты помогают понять фундаментальные механизмы, лежащие в основе процессов старения. Одновременно мы узнаем много нового о молекулярных механизмах биосинтеза белка», — отмечает один из руководителей работы, профессор Гарвардской школы медицины Вадим Гладышев.
В настоящее время ученые продолжает исследования с целью выяснения, какие именно воздействия на организм мышей приводят к увеличению продолжительности жизни.
10 марта 2020, 13:40НаукаРоссийские ученые открыли механизм, останавливающий старениеProtein Synthesis — обзор
Механизм действия ингибиторов синтеза белка
Синтез белка происходит в цитоплазме на рибонуклеопротеиновых частицах, рибосомах. Информационная РНК, которая содержит в своей нуклеотидной последовательности код для управления синтезом одной или нескольких полипептидных цепей, синтезируется РНК-полимеразой на матрице ДНК и транспортируется в цитоплазму, где она связывается с рибосомами и направляет размещение РНК для переноса аминоацила в правильной последовательности.Аминокислота, которая была активирована и этерифицирована до определенного вида тРНК, связана с рибосомальным акцепторным сайтом благодаря взаимодействиям кодон-антикодон. Пептидилтрансфераза, неотъемлемая часть рибосомы, катализирует образование пептидной связи между карбоксильной группой растущего пептида (связанной как пептидил-тРНК с сайтом донора рибосомы) и аминогруппой новой аминокислоты. Образовавшаяся пептидил-тРНК перемещается к донорному сайту с помощью GTP-требующего фермента, освобождая акцепторный сайт для присоединения следующей аминоацил-тРНК (Watson, 1970).
Информационная РНК, которая содержит в своей нуклеотидной последовательности код для управления синтезом одной или нескольких полипептидных цепей, синтезируется РНК-полимеразой на матрице ДНК и транспортируется в цитоплазму, где она связывается с рибосомами и направляет размещение РНК для переноса аминоацила в правильной последовательности.Аминокислота, которая была активирована и этерифицирована до определенного вида тРНК, связана с рибосомальным акцепторным сайтом благодаря взаимодействиям кодон-антикодон. Пептидилтрансфераза, неотъемлемая часть рибосомы, катализирует образование пептидной связи между карбоксильной группой растущего пептида (связанной как пептидил-тРНК с сайтом донора рибосомы) и аминогруппой новой аминокислоты. Образовавшаяся пептидил-тРНК перемещается к донорному сайту с помощью GTP-требующего фермента, освобождая акцепторный сайт для присоединения следующей аминоацил-тРНК (Watson, 1970).
Взаимосвязь между синтезом белка и физиологическим проявлением радиационного повреждения была исследована в основном с использованием ингибиторов синтеза белка. Выводы, сделанные на основе этих исследований, основаны на двух предположениях: во-первых, ингибирование влияет на одну и только одну биохимическую реакцию, а во-вторых, что эта конкретная биохимическая реакция не имеет быстрых косвенных эффектов на общий метаболизм клетки.
Выводы, сделанные на основе этих исследований, основаны на двух предположениях: во-первых, ингибирование влияет на одну и только одну биохимическую реакцию, а во-вторых, что эта конкретная биохимическая реакция не имеет быстрых косвенных эффектов на общий метаболизм клетки.
Пуромицин, который функционирует как аналог аминоацил-тРНК (Morris and Schweet, 1961; Rabinovitz and Fisher, 1962), по-видимому, ингибирует синтез белка в прокариотических и эукариотических клетках, высвобождая неполные полипептидные цепи из рибосомы (Allen and Zamecnik , 1962; Натанс, 1964). Циклогексимид может ингибировать инициацию, удлинение или прекращение синтеза белка в эукариотических клетках путем блокирования транслокации, тем самым предотвращая дальнейшее движение рибосомы вдоль информационной РНК (Obrig et al., 1971; Rajalakshmi et al., 1971). Хлорамфеникол подавляет синтез белка в бактериях и избирательно подавляет синтез белка в митохондриях и хлоропластах изученных эукариотических клеток (Sager, 1972).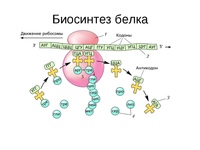 Этот антибиотик связывается с большой рибосомной субъединицей (Vazquez, 1965) и препятствует образованию пептидной связи (например, Traut and Monro, 1964). Стрептомицин специфически подавляет синтез микробных и митохондриальных белков, связываясь с малой рибосомной субъединицей (Davies, 1964; Cox et al., 1964) и вызывая неправильное прочтение генетического кода (Davies et al., 1964).
Этот антибиотик связывается с большой рибосомной субъединицей (Vazquez, 1965) и препятствует образованию пептидной связи (например, Traut and Monro, 1964). Стрептомицин специфически подавляет синтез микробных и митохондриальных белков, связываясь с малой рибосомной субъединицей (Davies, 1964; Cox et al., 1964) и вызывая неправильное прочтение генетического кода (Davies et al., 1964).
Синтез белков | Encyclopedia.com
Белки — это рабочие лошадки клетки, они контролируют практически каждую реакцию внутри клетки, а также обеспечивают структуру и служат сигналами для других клеток.Белки представляют собой длинные цепи из аминокислот и , и точная последовательность аминокислот определяет окончательную структуру и функцию белка. Инструкции для этой последовательности закодированы в генах . Чтобы создать конкретный белок, из гена создается копия рибонуклеиновой кислоты (мРНК) (в процессе, называемом транскрипцией ), и мРНК транспортируется на рибосому . Синтез белка, также называемый трансляцией , начинается, когда две рибосомные субъединицы соединяются с мРНК.За этой стадией, называемой инициацией, следует удлинение, при котором к растущей цепи добавляются следующие друг за другом аминокислоты, вводимые транспортными РНК (тРНК). На этом этапе рибосома считывает нуклеотидов мРНК три на три, в единицах, называемых кодонами , и сопоставляет каждый с тремя нуклеотидами на тРНК, называемыми антикодоном. Наконец, во время терминации рибосома отделяется от мРНК, и аминокислотная цепь подвергается процессингу и сворачиванию с образованием конечного функционального белка.
Синтез белка, также называемый трансляцией , начинается, когда две рибосомные субъединицы соединяются с мРНК.За этой стадией, называемой инициацией, следует удлинение, при котором к растущей цепи добавляются следующие друг за другом аминокислоты, вводимые транспортными РНК (тРНК). На этом этапе рибосома считывает нуклеотидов мРНК три на три, в единицах, называемых кодонами , и сопоставляет каждый с тремя нуклеотидами на тРНК, называемыми антикодоном. Наконец, во время терминации рибосома отделяется от мРНК, и аминокислотная цепь подвергается процессингу и сворачиванию с образованием конечного функционального белка.
Инициирование
На первом этапе, инициации, рибосома должна связать мРНК и найти подходящее место, чтобы начать ее трансляцию в белок. Если рибосома начнет транслировать мРНК в неправильном месте, будет синтезирован не тот белок. Это особенно сложная проблема, потому что существует три различных рамки считывания, в которых может считываться мРНК.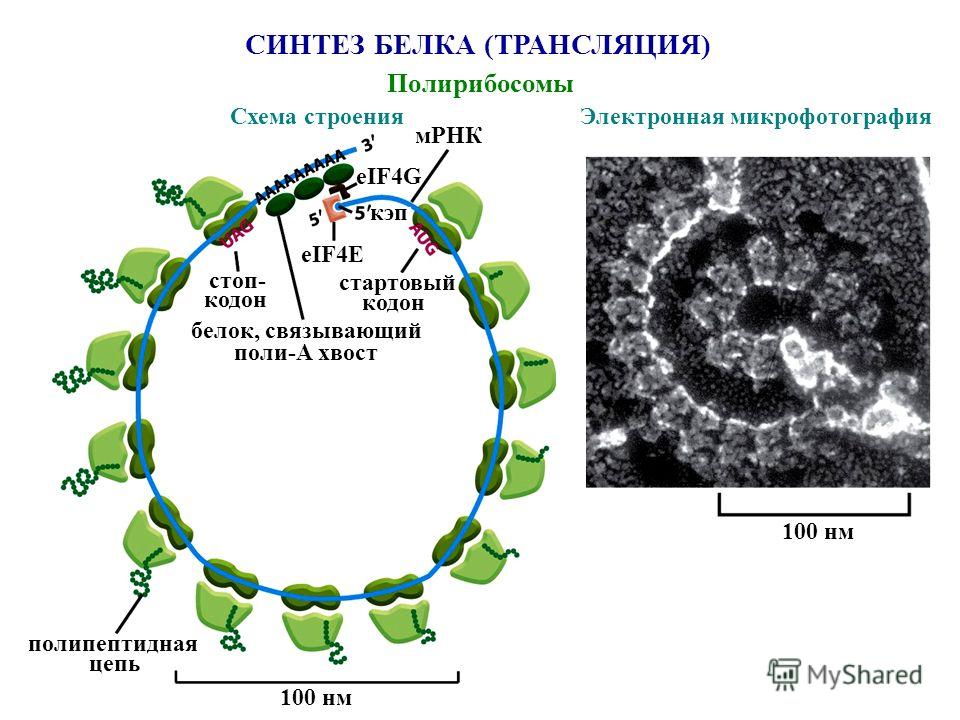 Каждая единица генетического кода , называемая кодоном, состоит из трех оснований и кодирует одну аминокислоту.Совершенно разные белковые последовательности будут считываться рибосомой, если она начинает трансляцию с начала первого кодона в основании 0, основании 1 или 2 (рисунок 1). Таким образом, легко понять, почему у рибосомы должен быть способ найти правильную отправную точку для трансляции каждой отдельной мРНК.
Каждая единица генетического кода , называемая кодоном, состоит из трех оснований и кодирует одну аминокислоту.Совершенно разные белковые последовательности будут считываться рибосомой, если она начинает трансляцию с начала первого кодона в основании 0, основании 1 или 2 (рисунок 1). Таким образом, легко понять, почему у рибосомы должен быть способ найти правильную отправную точку для трансляции каждой отдельной мРНК.
Почти в каждом известном случае трансляция начинается с трехосновного кодона, который кодирует аминокислоту метионин. Этот кодон имеет последовательность AUG. Рибосомы состоят из двух частей, называемых субъединицами, которые содержат как белковые, так и РНК-компоненты.Задача меньшей рибосомной субъединицы — найти кодон AUG, который будет использоваться в качестве отправной точки для трансляции (называемый инициирующим кодоном). Хотя всегда начинать с AUG помогает решить проблему рамки считывания, найти правильный AUG — не совсем простая задача. Часто в мРНК содержится более одного кодона AUG, и небольшая рибосомная субъединица должна найти правильную, если нужно получить правильный белок.
Инициирование у прокариот. У прокариот (бактерий) есть нуклеотидная последовательность на верхней (5-первичной или 5 ‘) стороне инициирующего кодона, которая сообщает рибосоме, что следующая последовательность AUG является правильным местом для начала трансляции мРНК.Эта последовательность называется последовательностью Шайна-Делгарно в честь ее первооткрывателей. Последовательность Шайна-Делгарно образует пары оснований с РНК в малой рибосомной субъединице, таким образом связывая рибосомную субъединицу с мРНК около инициирующего кодона.
Затем специальная тРНК образует пар оснований с последовательностью AUG инициирующего кодона. ТРНК содержит , комплементарную последовательность AUG.
как его антикодон. Эта тРНК несет модифицированную версию аминокислоты метионина (fMet-tRNA i или тРНК инициатора формилметионила) и уже связана с небольшой субъединицей рибосомы.Взаимодействие кодона и антикодона запускает серию событий, которые не совсем понятны, но которые приводят к присоединению большой субъединицы рибосомы к малой субъединице рибосомы.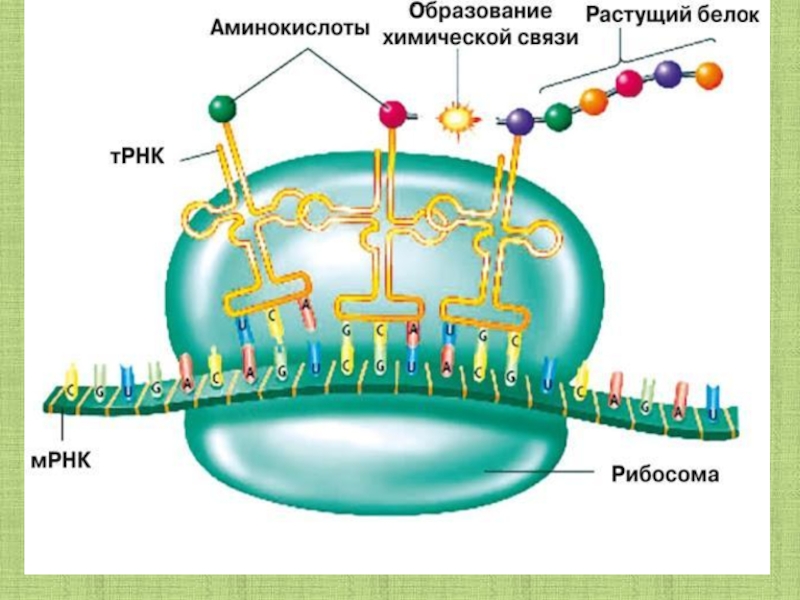 Полученный комплекс называется комплексом инициации; это целая рибосома, связанная с мРНК и инициаторной тРНК, расположенная так, чтобы из мРНК образовался правильный белок.
Полученный комплекс называется комплексом инициации; это целая рибосома, связанная с мРНК и инициаторной тРНК, расположенная так, чтобы из мРНК образовался правильный белок.
Инициирование у эукариот. У эукариот (животных, растений, грибов и простейших) последовательность Шайна-Делгарно отсутствует в РНК малой рибосомной субъединицы, и, таким образом, для определения местоположения кодона инициации используется другой механизм.Стратегия, используемая эукариотами, более сложна и менее понятна, чем стратегия, используемая прокариотами. Считается, что у эукариот малая субъединица рибосомы связывается с 5′-концом мРНК. Это связывание опосредуется специальной структурой на 5′-конце эукариотических мРНК, называемой 7-метилгуанозиновым кэпом, а также ему помогает специальный хвост из аденозиновых оснований (поли-A-хвост) на 3′-конце, оба из которых являются добавляется во время обработки РНК. Группа белков, называемых факторами инициации, связывается с 7-метилгуанозиновым кэпом и поли (А) хвостом и, по-видимому, направляет связывание малой субъединицы рибосомы с мРНК вблизи кэп-структуры.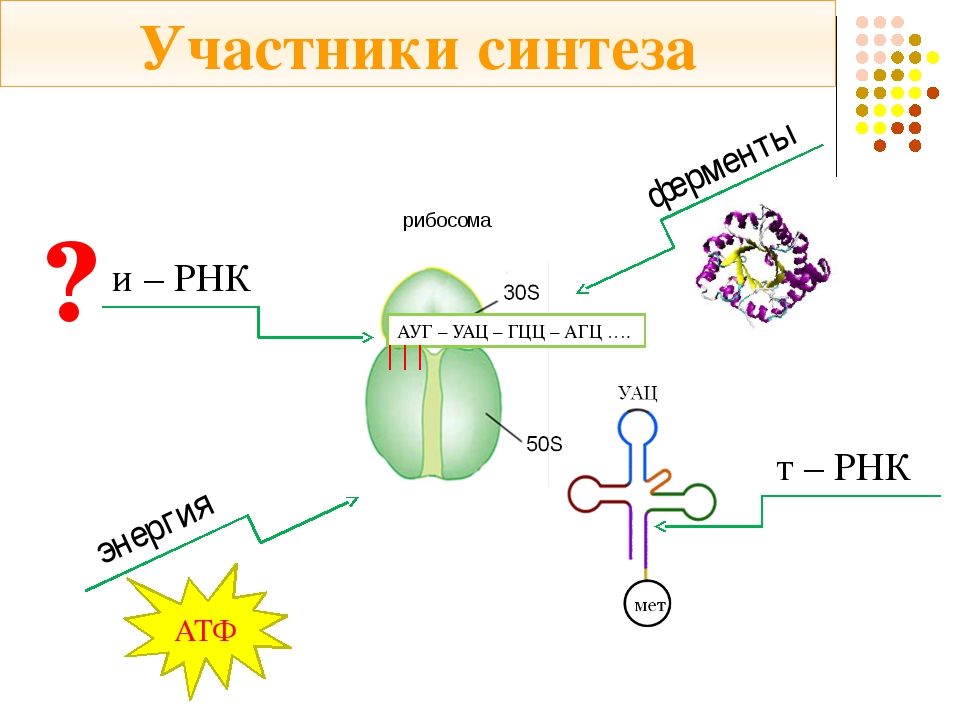
Как только это произошло, малая рибосомная субъединица может читать вдоль мРНК и искать кодон AUG. Этот процесс называется сканированием. Распознавание инициирующего кодона в значительной степени опосредовано взаимодействиями пар оснований между кодоном AUG и антикодонной последовательностью в тРНК метионильного инициатора (Met-тРНК и ; метионин не модифицируется формильной группой у эукариот, как в ). прокариоты ). Как и у прокариот, эта Met-тРНК уже связана с малой субъединицей рибосомы.
В большинстве случаев первый кодон AUG в мРНК эукариот используется в качестве кодона инициации, таким образом, малая субъединица находит правильный кодон инициации просто путем сканирования вдоль мРНК, начиная с 5′-конца, пока не достигнет первого кодона AUG. Однако инициирующий кодон AUG может фланкироваться определенными последовательностями оснований, которые не встречаются вокруг других кодонов AUG, не используемых для инициации. Этот предпочтительный набор оснований вокруг инициирующего кодона называется последовательностью Козака в честь ее первооткрывателя, Мэрилин Козак.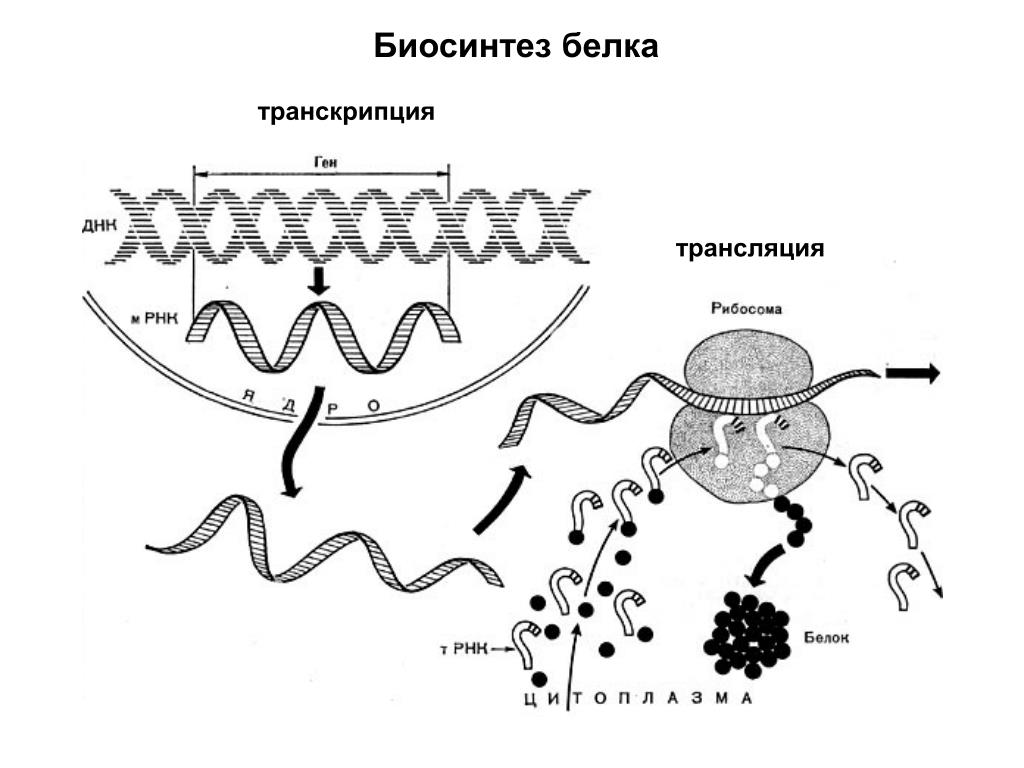 Как последовательность Козака помогает маленькой рибосомной субъединице использовать один кодон AUG вместо другого, неизвестно. Как и в случае с прокариотами, после того, как правильный кодон AUG был найден, выполняется сложная серия шагов, которые приводят к присоединению большой субъединицы рибосомы к малой субъединице рибосомы с образованием инициирующего комплекса: полной рибосомы, собранной в правильное место на мРНК со связанной с ней тРНК инициатора.
Как последовательность Козака помогает маленькой рибосомной субъединице использовать один кодон AUG вместо другого, неизвестно. Как и в случае с прокариотами, после того, как правильный кодон AUG был найден, выполняется сложная серия шагов, которые приводят к присоединению большой субъединицы рибосомы к малой субъединице рибосомы с образованием инициирующего комплекса: полной рибосомы, собранной в правильное место на мРНК со связанной с ней тРНК инициатора.
И у прокариот, и у эукариот есть белки, называемые факторами инициации, которые необходимы для правильной сборки комплекса инициации.У прокариот есть три фактора инициации, которые достаточно логично называются IF1, IF2 и IF3. IF2 помогает fMet-тРНК i связываться с малой рибосомной субъединицей. Основная роль IF3, по-видимому, заключается в том, чтобы гарантировать, что AUG, а не другой кодон, используется в качестве начального сайта трансляции. То есть IF3 контролирует точность выбора инициирующего кодона. IF1, по-видимому, предотвращает связывание тРНК инициатора с неправильным местом в малой субъединице рибосомы. У эукариот ситуация значительно сложнее, поскольку для инициирования процесса требуется по крайней мере двадцать четыре белковых компонента.
У эукариот ситуация значительно сложнее, поскольку для инициирования процесса требуется по крайней мере двадцать четыре белковых компонента.
Антибиотик тетрациклин предотвращает связывание тРНК с сайтами A.
Элонгация
На следующей фазе синтеза белка, элонгации, рибосома соединяет аминокислоты вместе в последовательности, определяемой мРНК, с образованием соответствующего белка. Аминокислоты переносятся на рибосому, прикрепленную к тРНК. тРНК представляют собой адаптерные молекулы, которые позволяют рибосоме транслировать информацию, содержащуюся в кодонной последовательности мРНК, в аминокислотную последовательность белка.Это декодирование происходит путем спаривания оснований между антикодоновыми основаниями тРНК и кодоновыми основаниями мРНК. Когда все три антикодоновых основания тРНК образуют пары оснований со следующим кодоном мРНК, рибосома с помощью белка фактора элонгации распознает, что эта тРНК имеет присоединенную к ней правильную аминокислоту, и добавляет эту аминокислоту к растущая белковая цепь. Затем процесс можно повторять до тех пор, пока весь белок не будет синтезирован.
Затем процесс можно повторять до тех пор, пока весь белок не будет синтезирован.
Как уже упоминалось, для удлинения требуется помощь белков фактора удлинения.ТРНК с присоединенными аминокислотами (называемые аминоацил тРНК) переносятся на рибосому с помощью одного такого фактора удлинения . Этот фактор называется EF-Tu у прокариот и EF1 у эукариот. Его задача — доставить аминоацил тРНК на рибосому, а затем помочь рибосоме убедиться, что к этой тРНК прикреплена правильная аминокислота. Рибосома имеет три сайта связывания аминоацил тРНК: акцепторный сайт (A), пептидильный сайт (P) и сайт выхода (E). ТРНК, к которой прикреплен растущий белок, связывается в P-сайте (отсюда и название пептидил от пептида).Поступающая аминоацил тРНК, содержащая следующую добавляемую аминокислоту, связывается в сайте A. Сайт A — это место, где происходит расшифровка генетического кода; выбирается правильная аминоацил тРНК, соответствующая следующему кодону мРНК. Израсходованные тРНК, которые больше не имеют присоединенной к ним аминокислоты или растущей пептидной цепи, оказываются в E-сайте от
| Специальные белки, участвующие в синтезе белка | ||
| Прокариоты | Эукариоты | |
| Инициирование | IF1 | не менее 24 белковых компонентов |
| IF2 | ||
| IF3 | ||
| Удлинение — | ТуEF1 | |
| EF-G | EF2 | |
| Прекращение действия | RF1 | eRF1 |
| RF2 | eRF3 | |
| RF3 | ||
| Переработка | RRF | |
, которые они выпадают с рибосомы обратно в цитоплазму , где они могут собирать новые аминокислоты.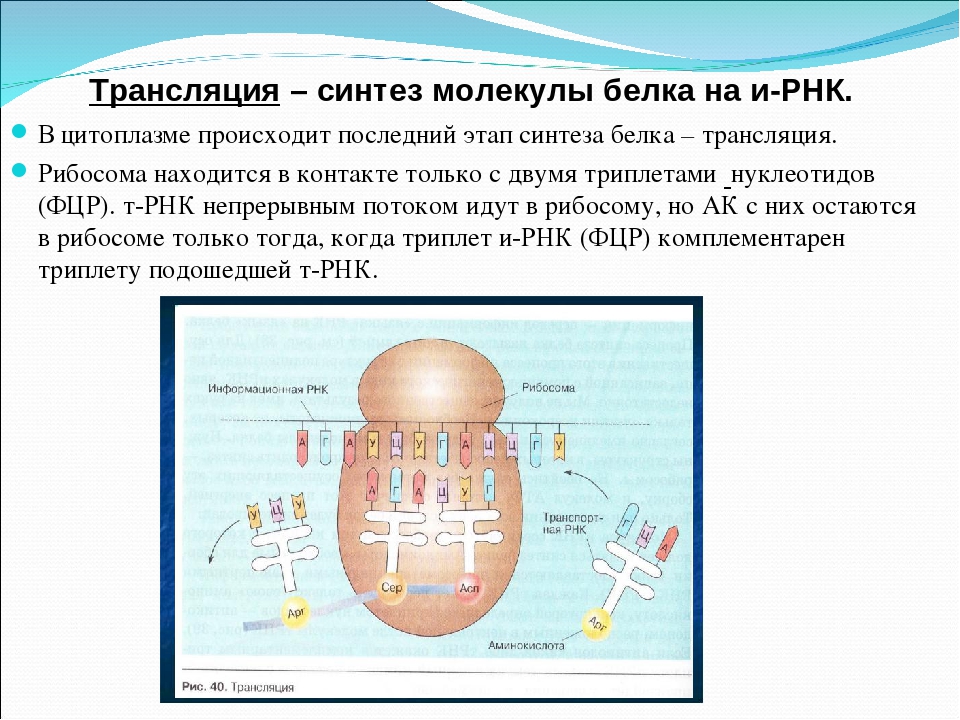
Как только сайт А занят правильной тРНК, рибосома связывает новую аминокислоту с растущей пептидной цепью. Он делает это, катализируя образование пептидной (амидной) связи между аминогруппой (NH 2 ) новой аминокислоты в сайте A и карбонильной (CO) группой, которая присоединяет растущую белковую цепь к тРНК в сайт P (рисунок 2). Это приводит к промежуточному состоянию рибосомы, называемому гибридным состоянием , в котором тРНК в P-сайте потеряла растущую белковую цепь и частично переместилась в E-сайт, а тРНК в A-сайте теперь имеет растущий Белковая цепь прикрепилась к нему и частично переместилась в Р-сайт.
Для завершения цикла удлинения необходим второй фактор удлинения, называемый EF-G у прокариот и EF2 у эукариот. Этот фактор удлинения перемещает тРНК таким образом, что израсходованная тРНК, потерявшая белковую цепь, полностью перемещается в Е-сайт, а тРНК с растущей белковой цепью полностью перемещается в Р-сайт. EF-G также сдвигает мРНК на один кодон, так что следующий кодон находится в A-сайте.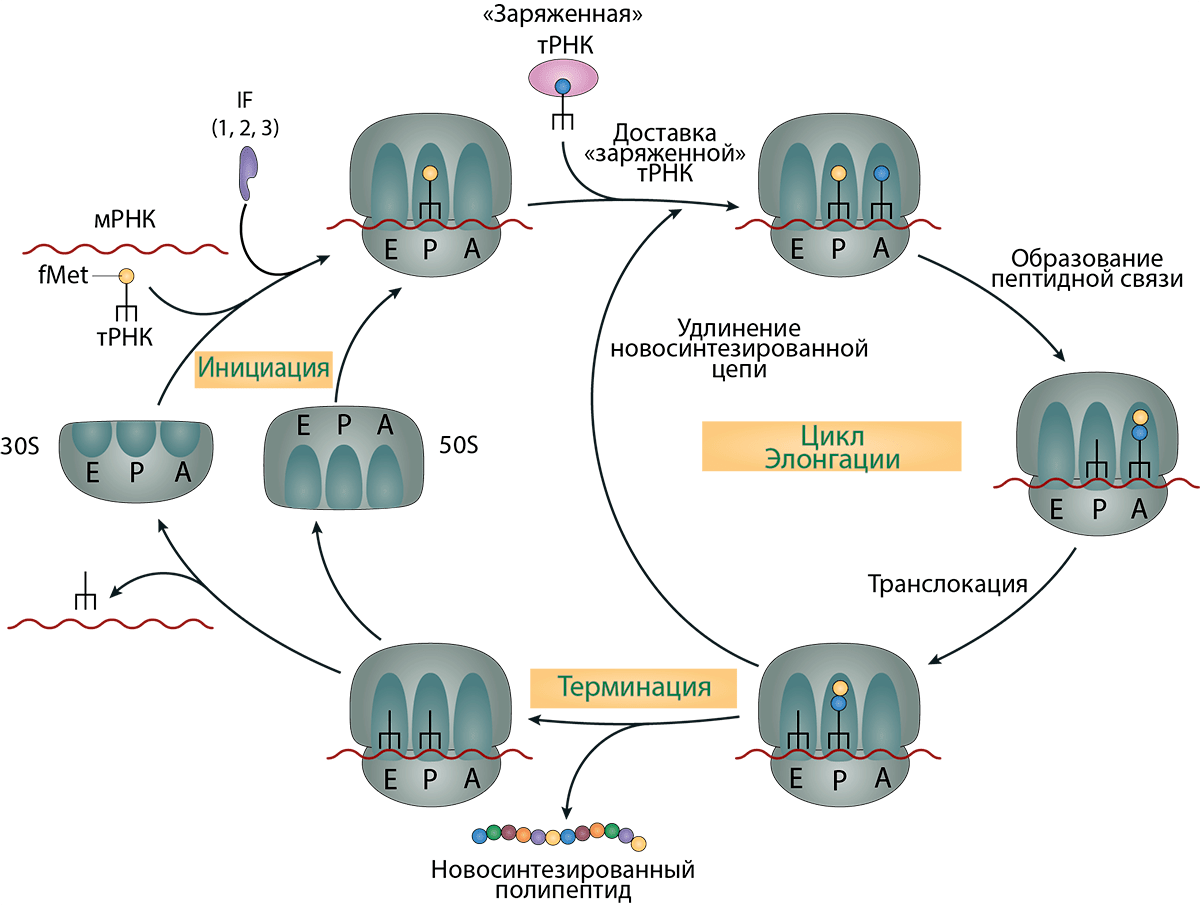 Сайт A теперь свободен от тРНК, и следующая аминоацил тРНК может быть введена в него.
Сайт A теперь свободен от тРНК, и следующая аминоацил тРНК может быть введена в него.
Многие антибиотики (препараты, убивающие бактерии) влияют на фазу элонгации прокариотической трансляции . Некоторые снижают точность (точность), с которой рибосома декодирует мРНК, и в белки попадают неправильные аминокислоты. Это снижение точности приводит к накоплению неработающих белков, что в конечном итоге убивает бактерии. Другие антибиотики предотвращают образование пептидной связи , или перемещение тРНК посредством EF-G после образования пептидной связи.Причина, по которой эти препараты эффективны в отношении бактерий, не убивая пациента, заключается в том, что прокариотические рибосомы имеют некоторые структурные особенности, отличные от эукариотических рибосом, и, таким образом, эти препараты могут связываться с прокариотическими (бактериальными) рибосомами, но не с рибосомами эукариот (то есть человека). Поскольку вирусы используют для размножения человеческие рибосомы, эти антибиотики неэффективны против них.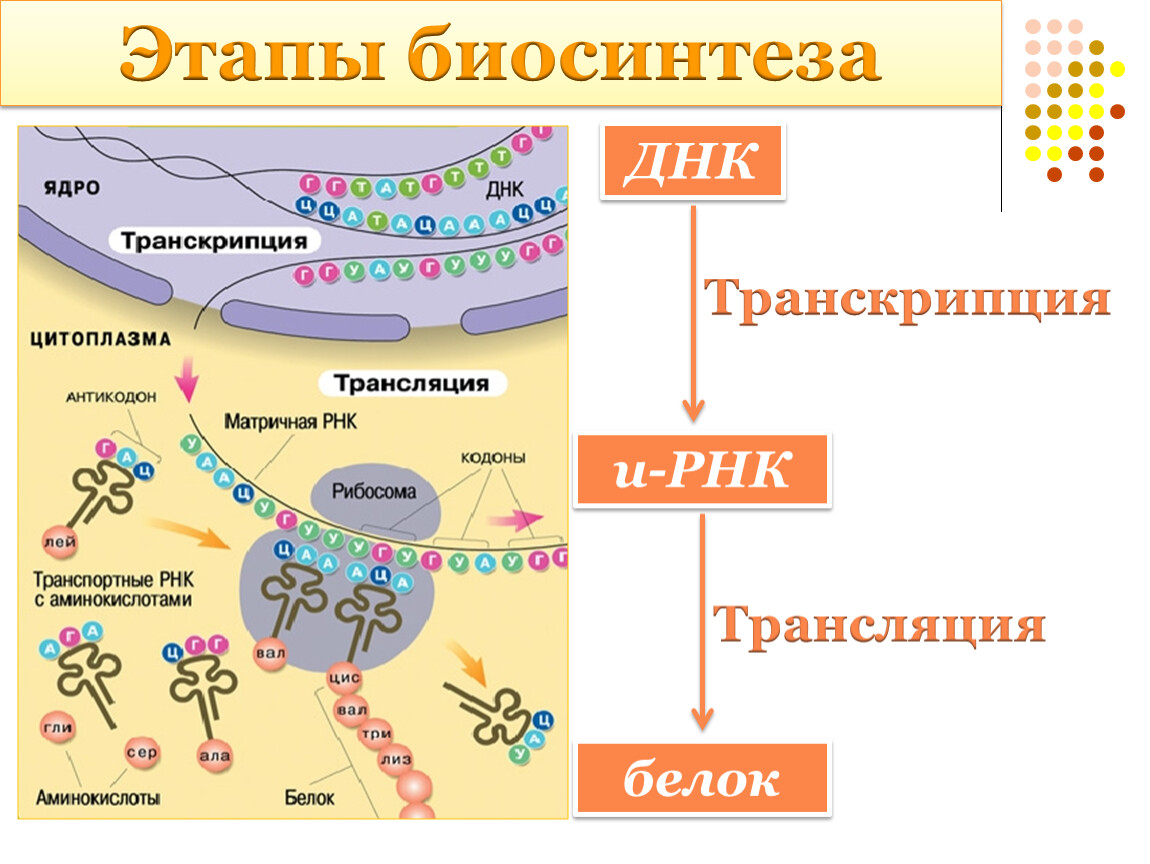
Окончание
Конец кода белка в мРНК сигнализируется одним из трех специальных кодонов, называемых стоп-кодонами.Эти стоп-кодоны имеют последовательности UAA, UAG и UGA. У прокариот стоп-кодоны связаны одним из двух белков фактора высвобождения (RF) у прокариот: RF1 или RF2. Эти факторы высвобождения заставляют рибосому отщеплять готовый белок от тРНК в P-сайте. Третий фактор высвобождения, RF3, отвечает за высвобождение RF1 и RF2 из рибосомы после того, как они распознают стоп-кодон и вызвали отщепление белка от тРНК. У эукариот есть один белок, eRF1, который выполняет функции RF1 и RF2, и второй белок, eRF3, который выполняет функцию RF3.После высвобождения белок может продолжать выполнять свою функцию в клетке.
После того, как белок был отщеплен от тРНК, две рибосомные субъединицы должны быть на диссоциированы на друг от друга, чтобы рибосома могла начать трансляцию другой мРНК. Этот процесс называется переработкой. У прокариот для рециклинга требуются три белка: один фактор инициации (IF3), один фактор удлинения (EF-G) и фактор рециклинга рибосом, называемый RRF. Как только субъединицы отделены друг от друга, весь процесс трансляции может начаться снова.
Как только субъединицы отделены друг от друга, весь процесс трансляции может начаться снова.
Сворачивание белка
Функциональный белок — это не длинная вытянутая цепь аминокислот, а сложная трехмерная структура. То есть каждый белок должен сворачиваться в определенную форму или конформацию , , чтобы выполнять свою функцию в клетке. Данные убедительно свидетельствуют о том, что вся информация, необходимая для того, чтобы белок сложился в его правильную трехмерную структуру, содержится в аминокислотной последовательности белка (а не, скажем, определяется каким-либо другим фактором в клетке).Однако, поскольку белок синтезируется на рибосоме, существует опасность того, что незаконченный белок начнет неправильно складываться, потому что остальная часть белка еще не была произведена. Также возможно, что незавершенный белок будет взаимодействовать с другими незавершенными белками, создаваемыми на других рибосомах, и формировать так называемый агрегат : сеть частично свернутых белков, которые взаимодействовали друг с другом, а не сами с собой, создавая таким образом беспорядок. внутри клетки.Такие белковые агрегаты могут быть фатальными для клетки. Задача класса белков, называемых шаперонами, — связываться с растущими белковыми цепями, поскольку они синтезируются рибосомами, и предотвращать формирование агрегатов или неправильное сворачивание белков до того, как они будут полностью синтезированы. Шапероны также могут помочь белкам эффективно складываться в правильную трехмерную структуру после завершения трансляции.
внутри клетки.Такие белковые агрегаты могут быть фатальными для клетки. Задача класса белков, называемых шаперонами, — связываться с растущими белковыми цепями, поскольку они синтезируются рибосомами, и предотвращать формирование агрегатов или неправильное сворачивание белков до того, как они будут полностью синтезированы. Шапероны также могут помочь белкам эффективно складываться в правильную трехмерную структуру после завершения трансляции.
Модификация белка
Хотя мРНК кодирует полную аминокислотную последовательность соответствующего белка, некоторые белки изменяются после их трансляции.Этот процесс называется посттрансляционной модификацией. Например, некоторые протеазы (белки, переваривающие другие белки) синтезируются рибосомой как белки-предшественники (про-белки), которые содержат дополнительную последовательность аминокислот на одном конце, которая не позволяет им переваривать любые белки, пока они не попадут в нужное место. (обычно вне камеры). Как только протеазы достигают места назначения, аминокислотные последовательности, которые мешают им быть активными (называемые про-последовательностями), удаляются (другим белком), и протеазы могут начать переваривать другие белки.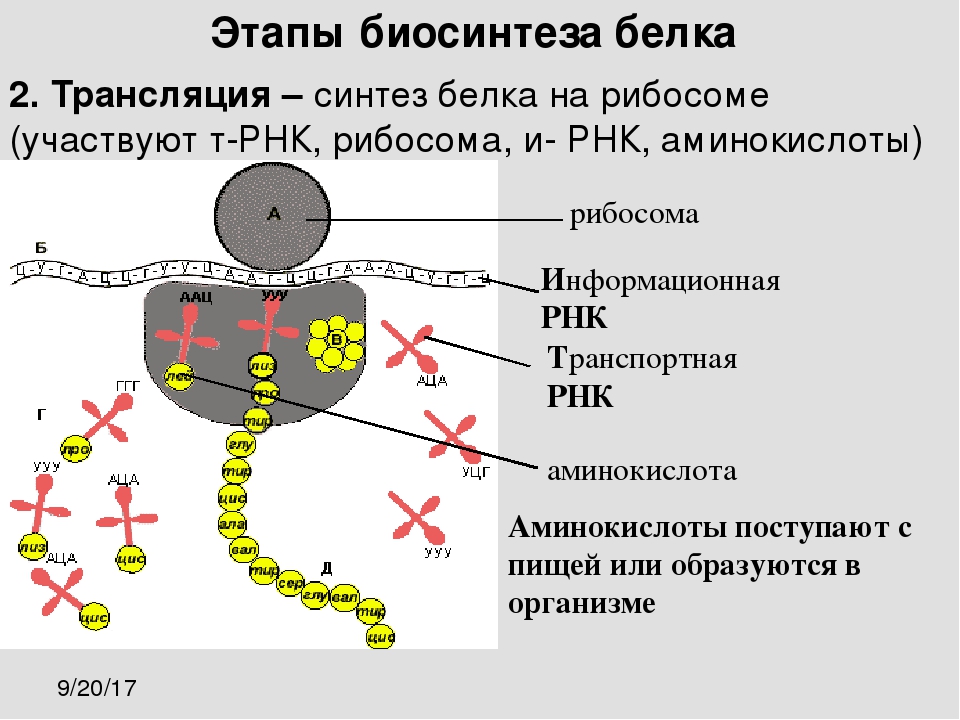 Если эти пропоследовательности не существовали,
протеазы будут переваривать все полезные белки внутри клеток, которые их создали, что было бы плохо.
Если эти пропоследовательности не существовали,
протеазы будут переваривать все полезные белки внутри клеток, которые их создали, что было бы плохо.
Многие белки, производимые эукариотическими клетками , модифицируются за счет присоединения сахаров к различным аминокислотам, этот процесс называется гликозилированием. Белки, которые должны быть экспортированы из клетки или вставлены в клеточную мембрану, попадают в эндоплазматический ретикулум (ER), поскольку они синтезируются рибосомами, которые связываются с поверхностью ER и подают новые белки в ER через мелкие поры.Внутри ER к белку добавляются сахара, которые затем отправляются в аппарат Гольджи, где некоторые из них удаляются и добавляются дополнительные сахара. Роль гликозилирования белков не совсем понятна, но поскольку многие эукариотические белки гликозилированы, это явно важно.
Существует ряд дополнительных способов модификации белков после их создания. Например, многие белки могут иметь одну или несколько фосфатных групп, добавленных к ним с помощью ферментов , называемых киназ . Эти фосфорилирования часто используются клеткой для регулирования активности определенных белков; фосфорилированная форма белка часто имеет свойства, отличные от нефосфорилированной формы.
Эти фосфорилирования часто используются клеткой для регулирования активности определенных белков; фосфорилированная форма белка часто имеет свойства, отличные от нефосфорилированной формы.
Распад белка
Когда белок изжил себя или повредился, он разрушается в клетке. У эукариот белок, который должен быть расщеплен, имеет несколько копий небольшого белка убиквитина, прикрепленных к нему с помощью ряда ферментов, добавляющих убиквитин.Убиквитин служит меткой, которая отмечает деградацию белка. Меченый белок затем всасывается в большую клеточную машину, называемую протеасомой, которая сама состоит из ряда белковых компонентов и выглядит как мусорный бак. Внутри протеасомы меченый белок расщепляется на небольшие пептидные фрагменты, которые высвобождаются в цитоплазму, где они могут далее расщепляться на свободные аминокислоты другими протеазами. Жизнь белка начинается в одной клеточной машине, называемой рибосомой, и заканчивается в другой, называемой протеасомой.
см. Также Эндоплазматический ретикулум; Генетический код; Гольджи; Структура белка; Рибосома; РНК; Обработка РНК
Джон Лорш
Библиография
Левин, Бенджамин. Гены VI. Оксфорд: Издательство Оксфордского университета, 1997.
Меррик, Уильям К. и Джон В. Б. Херши. «Путь и механизм синтеза эукариотических белков». В Translational Control. Плейнвью, Нью-Йорк: Лаборатория издательства Колд-Спринг-Харбор, 1996.
Штрайер, Люберт. Биохимия, 4-е изд. Нью-Йорк: W. H. Freeman and Company, 1995.
Синтез белка — Основные концепции генетики — Génome Québec Éducation et Formations
Синтез белка — Основные концепции генетики — Génome Québec Éducation et FormationsTop От ДНК к белку — 3D , yourgenome. org, Wellcome Genome Campus (Великобритания) — 2:42 мин.
org, Wellcome Genome Campus (Великобритания) — 2:42 мин.
Белки — это большие молекулы, которые могут выполнять множество различных задач. Они могут облегчать химические реакции (например, ферменты), обеспечивать структурную поддержку (например, цитоскелет), передавать сигналы с поверхности клетки (например, мембранные рецепторы) и многое другое. Но откуда они?
Гены в нашей ДНК похожи на рецепты, используемые для производства белков. Но поскольку рецепты кодируются с использованием азотистых оснований (ATCG), их сначала нужно перевести.Многие белки работают вместе над этой задачей перевода. Нити двойной спирали ДНК должны сначала уступить место, чтобы можно было получить доступ к целевому гену. Затем белки производят идентичную копию целевой последовательности ДНК: информационную РНК.
Эта копия рецепта, теперь транскрибируемая как мессенджер РНК, затем отправляется за пределы ядра клетки, поскольку белки производятся в другом месте клетки. Оттуда рибосомы, мелкие частицы, присутствующие в большом количестве вокруг ядра, будут служить поварами, читая рецепт приготовления белка. Аминокислоты являются основными ингредиентами, которые входят в рецепт протеина, и рибосомы используют план, предоставляемый информационной РНК, чтобы расположить аминокислоты в правильном порядке и сформировать длинную цепочку. Аминокислоты — это органические молекулы, которые содержат амин, химическое соединение, полученное из аммиака. Химики знают сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из единой цепи в сложную трехмерную структуру.
Аминокислоты являются основными ингредиентами, которые входят в рецепт протеина, и рибосомы используют план, предоставляемый информационной РНК, чтобы расположить аминокислоты в правильном порядке и сформировать длинную цепочку. Аминокислоты — это органические молекулы, которые содержат амин, химическое соединение, полученное из аммиака. Химики знают сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из единой цепи в сложную трехмерную структуру.
Бонусный материал
РНК (рибонуклеиновая кислота) почти идентична ДНК (дезоксирибонуклеиновая кислота). Его структура похожа на химическом уровне, но менее устойчива. В то время как ДНК имеет форму витой лестницы, образованной двумя комплементарными половинами, РНК чаще всего состоит из одной цепи. Это похоже на лестницу, разрезанную пополам сверху вниз. Как и ДНК, РНК состоит из четырех типов азотистых оснований, которые выстраиваются в очень определенной последовательности. В ДНК этими основаниями являются аденин (A), тимин (T), цитозин (C) и гуанин (G). Но в РНК тимин заменен урацилом (U), который также может образовывать пары с аденином (A). Но почему мы не находим урацил в ДНК? Чтобы облегчить восстановление ДНК при возникновении мутации. Иногда цитозин по ошибке превращается в урацил. Если бы ДНК состояла из урацила, а не тимина, клетке было бы сложно узнать, какие молекулы урацила являются ошибками, которые необходимо исправить. Однако эта проблема не относится к РНК из-за ее короткого срока службы.Чаще всего молекулы РНК служат своей цели всего за несколько минут, прежде чем они будут переработаны.
В ДНК этими основаниями являются аденин (A), тимин (T), цитозин (C) и гуанин (G). Но в РНК тимин заменен урацилом (U), который также может образовывать пары с аденином (A). Но почему мы не находим урацил в ДНК? Чтобы облегчить восстановление ДНК при возникновении мутации. Иногда цитозин по ошибке превращается в урацил. Если бы ДНК состояла из урацила, а не тимина, клетке было бы сложно узнать, какие молекулы урацила являются ошибками, которые необходимо исправить. Однако эта проблема не относится к РНК из-за ее короткого срока службы.Чаще всего молекулы РНК служат своей цели всего за несколько минут, прежде чем они будут переработаны.
Откройте для себя все основные концепции генетики:
5 основных стадий синтеза белка (поясняется диаграммой)
Некоторые из основных стадий синтеза белка: (а) активация аминокислот, (б) перенос аминокислоты на тРНК, (в) инициация полипептидной цепи, (г) обрыв цепи, (д) транслокация белка
Существует пять основных стадий синтеза белка, на каждой из которых требуется наличие ряда компонентов в E.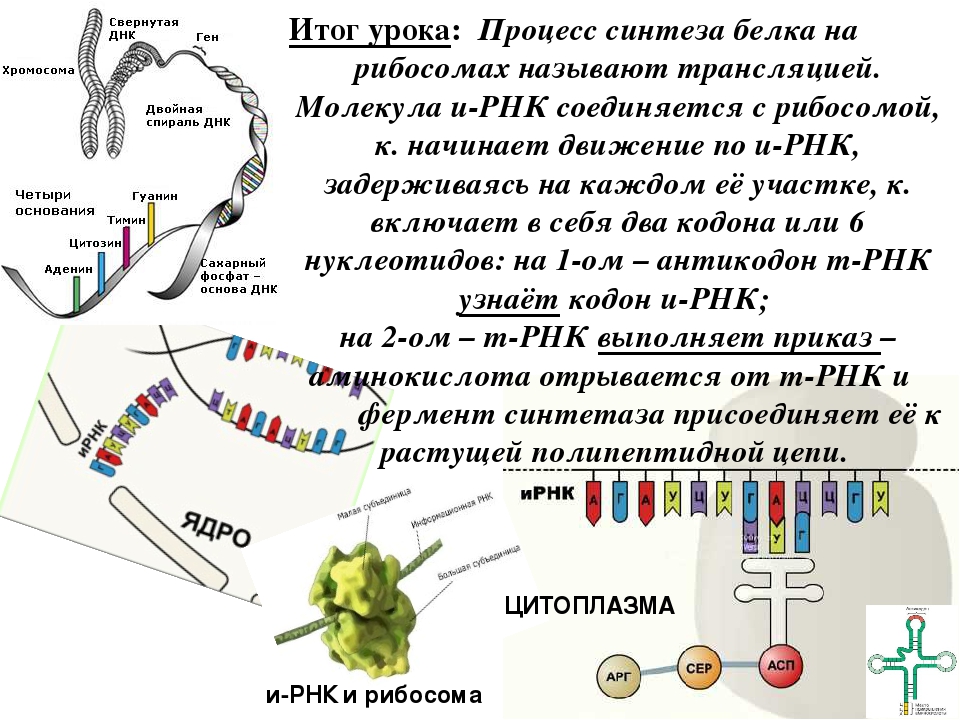 coli и другие прокариоты.
coli и другие прокариоты.
Синтез белка в эукариотических клетках происходит по той же схеме с некоторыми отличиями.
Основные шаги:
(а) Активация аминокислот:
Эта реакция вызвана связыванием аминокислоты с АТФ. На этом этапе требуются ферменты, называемые аминоацил-РНК-синтетазами. Благодаря этой реакции аминокислоты (АК) и аденозинтрифосфата (АТФ), опосредованной указанным выше ферментом, образуется комплекс аминоацил — АМФ — фермент (рис.6.40).
AA + ATP Фермент -AA — AMP — комплекс ферментов + PP
Следует отметить, что аминоацил РНК-синтетазы специфичны для различных аминокислот.
(b) Перенос аминокислоты на тРНК:
Образовавшийся комплекс АК — АМФ — фермент реагирует со специфической тРНК. Таким образом аминокислота переносится на тРНК. В результате высвобождаются фермент и АМФ.
AA — AMP — комплекс ферментов + тРНК- AA — тРНК + фермент AMP
(c) Инициирование полипептидной цепи:
Заряженная тРНК переходит на рибосому (рис. 6.41). Рибосома состоит из структурных РНК и 80 различных белков. Рибосома — это место, где происходит синтез белка. МРНК связывается с субъединицей SOS рибосомы 70S типа.
6.41). Рибосома состоит из структурных РНК и 80 различных белков. Рибосома — это место, где происходит синтез белка. МРНК связывается с субъединицей SOS рибосомы 70S типа.
Уже обсуждалось, что рибосомы состоят из рРНК (рибосомальной РНК) и белков. Рибосома также действует как катализатор (23sРНК у бактерий — это фермент — рибозим) для образования пептидной связи. Рибосомы состоят из двух частей: большего и меньшего.
Информация о последовательности аминокислот присутствует в последовательности азотистых оснований мРНК.Каждая аминокислота кодируется трехбуквенным словом нуклеиновая кислота. Инициирование полипептидной цепи у прокариот всегда вызывается аминокислотой метионином, который регулярно кодируется кодоном AUG, но редко также и GUG (для валина) в качестве также инициирующего кодона. Для прокариот составление инициирующей аминокислоты метионина является важным требованием.
Рибосомы имеют два сайта для связывания аминоацил-тРНК.
(i) Аминоацил или сайт А (акцепторный сайт).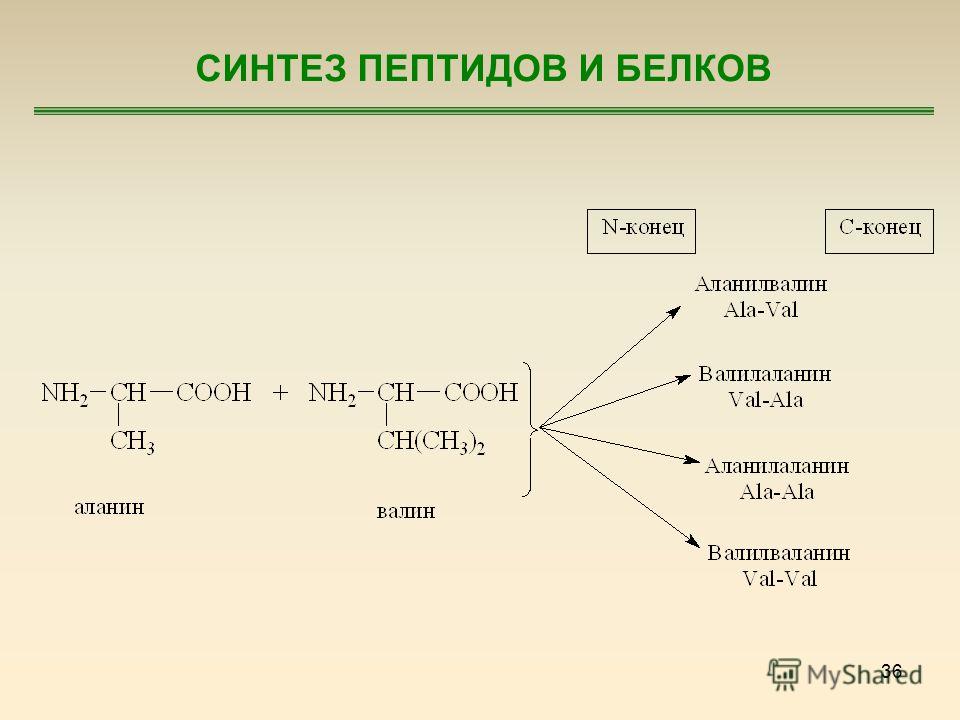
(ii) Пептидильный сайт или Р-сайт (донорный сайт). Каждый сайт состоит из определенных частей SOS и подразделений 30S. Инициирующая тРНК формилметионина, т.е. (тРНК AA, f Met), может связываться только с сайтом P (рис. 6.41).
Однако это исключение. Все другие вновь поступающие аминоацил-тРНК (AA 2 , AA 3 — тРНК) связываются с сайтом A. Таким образом, P-сайт — это сайт, из которого уходит пустая тРНК и с которым связывается растущая пептидил-тРНК.
На первом этапе следующая аминоацил-тРНК связывается с комплексом фактора элонгации Tu, содержащим молекулу связанного GTP. Полученный комплекс аминоацил-тРНК-Tu-GTP теперь связан с комплексом инициации 70S. GTP гидролизуется, и комплекс Tu-GDP высвобождается из рибосомы 70S (рис. 6.42). Новая аминоацил тРНК теперь связана с аминоацилом или сайтом А на рибосоме.
На второй стадии элонгации новая пептидная связь образуется между аминокислотами, тРНК которых расположены на сайтах A и P на рибосомах. Этот этап происходит путем переноса инициирующей ацильной группы формилметионина с его тРНК на аминогруппу новой аминокислоты, которая только что вошла в сайт A.
Этот этап происходит путем переноса инициирующей ацильной группы формилметионина с его тРНК на аминогруппу новой аминокислоты, которая только что вошла в сайт A.
Образование пептида катализируется пептидилтрансферазой, рибосомным белком в 50 S субъединице. Дипептидил тРНК образуется на сайте A, и теперь пустая тРНК остается связанной с сайтом P.
На третьем этапе удлинения рибосома перемещается вдоль мРНК к ее 3′-концу на расстояние кодона (т. Е., Кодоны с 1-го по 2-й и со 2-го по 3-й на мРНК). Поскольку дипептидил тРНК все еще прикреплен ко второму кодону (рис. 6.43), движение рибосом сдвигает дипептидил тРНК с сайта A на сайт P. Это смещение вызывает высвобождение пустой тРНК.
Теперь третий кодон мРНК находится на A-сайте, а второй кодон на P-сайте. Этот сдвиг рибосом вдоль мРНК называется этапом транслокации. На этом этапе требуется фактор элонгации G (также называемый транслоказой).А также одновременно происходит гидролиз другой молекулы GTP. Гидролиз GTP обеспечивает энергию для транслокации.
Гидролиз GTP обеспечивает энергию для транслокации.
Рибосома с присоединенной дипетидил-тРНК и мРНК готова к следующему циклу элонгации для присоединения третьей аминокислоты (рис. 6.44). Происходит так же, как и прибавление секунды.
В результате этого повторяющегося действия по удлинению цепи полипептидная цепь удлиняется. По мере того как рибосома перемещается от кодона к кодону вдоль мРНК по направлению к ее 3′-концу, должна быть вставлена полипептидная цепь последней аминокислоты.
(d) Обрыв цепи:
Об окончании полипептида сигнализирует один из трех концевых триплетов (кодонов) мРНК. Три терминальных кодона — это UAG (янтарь), UAA (охра) и UGA (опал). Их еще называют стоп-сигналами.
В момент терминации терминальный кодон следует сразу за последним аминокислотным кодоном. После этого высвобождается полипептидная цепь, тРНК, мРНК. Субъединицы рибосом диссоциируют.
Прекращение также требует действий трех факторов прерывания или освобождения, названных R 1 , R и S.
(e) Транслокация белка:
Было идентифицировано два класса полирибосом (рис. 6.45).
(i) Свободные полирибосомы
(ii) Полирибосомы, связанные с мембраной.
Для свободных рибосом прекращение синтеза белка приводит к высвобождению завершенного белка в цитоплазму. Некоторые из этих специфических белков перемещаются в митохондрии и ядро с помощью особых механизмов.
С другой стороны, в полирибосомах, связанных с мембраной, полипептидная цепь, которая растет на мРНК, вставляется в просвет мембраны ER.Некоторые из этих белков становятся неотъемлемой частью мембраны.
Тем не менее, немного белков высвобождается в просвет и включается в пузырьки тела Гольджи. Они могут дополнительно модифицироваться как гликозилирование, то есть добавление остатков сахара. Таким образом образовавшиеся везикулы сливаются с плазматической мембраной, и, наконец, эти белки высвобождаются.
Синтез белков — Химическая энциклопедия
Автор фотографии: mark huls
Для функционирования живых клеток нет более важной задачи, чем синтез белков. Поскольку белки выполняют так много разных задач,
механизм их синтеза сложен. Есть несколько этапов
участвует в процессе синтеза, включая транскрипцию и
перевод.
Поскольку белки выполняют так много разных задач,
механизм их синтеза сложен. Есть несколько этапов
участвует в процессе синтеза, включая транскрипцию и
перевод.
Транскрипция
Основная роль дезоксирибонуклеиновой кислоты ( ДНК ) направлять синтез белков. Однако ДНК находится в ядро клетки, и
Рисунок 1.Синтез белка требует транскрипции (показано слева сторону рисунка) и перевод (показан на правой стороне рисунок).
синтез белка происходит в клеточных структурах, называемых рибосомы , обнаруженный вне ядра. Процесс, посредством которого генетическая информация
передача из ядра в рибосомы называется транскрипцией.
Во время транскрипции синтезируется цепь рибонуклеиновой кислоты (РНК).Эта информационная РНК (мРНК) комплементарна той части ДНК, которая
направил его — он имеет дополнительный нуклеотид в каждой точке
цепь.
Специализированный белок, называемый ферментом, контролирует транскрипцию. Фермент под названием РНК-полимераза присутствует во всех ячейках; эукариотические клетки есть три типа этого фермента. В ДНК есть участок, называемый промотором. регион, который определяет сайты, где начинается транскрипция, и должен быть распознается одной субъединицей РНК-полимеразы, называемой сигма (σ) фактор.Признание между промоутером и σ-фактор помогает регулировать, как часто конкретный ген расшифровано. После связывания полимераза инициирует построение мРНК. (или другие молекулы РНК).
Инициирование синтеза новой молекулы РНК не всегда приводит к
полный синтез. После того, как нанизано примерно десять нуклеотидов
вместе, происходит непрерывное добавление дополнительных пар оснований
легче в процессе, называемом удлинением.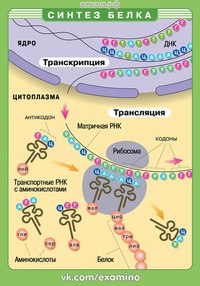 Скорость добавления новых
нуклеотидов примечательны — от двадцати до пятидесяти нуклеотидов на
вторую можно добавлять при температуре тела.
Скорость добавления новых
нуклеотидов примечательны — от двадцати до пятидесяти нуклеотидов на
вторую можно добавлять при температуре тела.
В конце концов, процесс удлинения должен остановиться. Есть определенные последовательности нуклеотидов, которые останавливают удлинение, процесс, называемый прекращением. Часто, завершение происходит, когда вновь образованный участок РНК возвращается обратно на Сама в плотном образовании называется шпилькой. Как только структура шпильки сформировался, последний компонент представляет собой строку урацил остатки.
После того, как произошла транскрипция, продуцируемая мРНК не обязательно
готов направить последующий синтез белка. В зависимости от типа
клетки, сегменты нуклеотидов могут быть удалены или добавлены перед
собственно процесс синтеза имеет место. Этот тип
посттранскрипционный процессинг часто происходит в клетках человека.
Перевод
После того, как мРНК синтезирована и, возможно, модифицирована, следующий шаг: белковый синтез, трансляция.Для этого этапа дополнительно формы РНК необходимы.
РНК переноса (тРНК) играет роль переноса аминокислоты к
сайт синтеза на рибосоме. Молекулы тРНК относительно малы, с
около семидесяти пяти нуклеотидов в одной цепи. Они образуют несколько
петли, одна из которых является антикодоном, серия из трех остатков,
комплементарен кодону, присутствующему в мРНК (рис. 2). Противоположный
конец тРНК — это место, где связана аминокислота.Правильная привязка
аминокислота для конкретной тРНК не менее важна, чем антикодон
чтобы гарантировать, что правильная аминокислота включена в полипептид что синтезируется. Существуют разные молекулы тРНК для каждого из
двадцать аминокислот, присутствующих в живых системах; некоторые аминокислоты
имеют более одной тРНК, несущей их к сайту синтеза.
Когда начинается трансляция, мРНК образует комплекс с рибосомой, чтобы сформировать сборочная площадка.Этот комплекс требует помощи белков, называемых факторы инициации, поэтому наличие мРНК не означает, что белок всегда будет синтезироваться. Первая тРНК, участвующая в инициация всегда несет одну и ту же аминокислоту, метионин. Когда белок полностью синтезируется, этот исходный метионин часто удалено.
При наличии исходного метионина другая тРНК с ее аминокислотой
присоединяется к сайту сборки, как это диктуется кодоном на мРНК.С двумя
присутствуют аминокислоты, может быть образована пептидная связь, и полипептид может
начать формирование. Новая аминокислота добавляется к углеродному концу
полипептид (C-конец) с пептидной связью, образующейся между C-O
полипептида и амина новой аминокислоты. Эта структурная
специфичность обеспечивается природой связывания между амино
кислота и тРНК. Несвязанная часть аминокислоты
Комплекс тРНК представляет собой амин.
Несвязанная часть аминокислоты
Комплекс тРНК представляет собой амин.
В конечном итоге удлинение требует повторения нескольких шагов: (1) Комплексы тРНК-аминокислоты должны быть образованы. (2) Этот комплекс должен связывать к сайту сборки мРНК-рибосомы. Правильная аминокислота обеспечивается соответствие антикодона тРНК кодону мРНК. (3) A пептидная связь образуется между новой аминокислотой и растущим полипептидная цепь. (4) Аминокислота расколотый из тРНК, которая может быть возвращена в цикл с образованием другого комплекса с аминокислота для последующего синтеза.(5) Растущий полипептид образует волокнистый усик. (6) Рибосома по существу движется по мРНК, повторное открытие сайта инициации для дополнительного синтеза белка. В этом Таким образом, белки синтезируются несколькими рибосомами, действующими на одну и ту же мРНК. молекула.
Структура рибосомы играет важную роль в этом удлинении. обработать. Для проведения синтеза должно быть два доступных сайта. Один
сайт, называемый P-сайтом (для пептида), является местом роста (или зарождения)
полипептид расположен.Рядом с этим местом находится другое место, где
тРНК с
обработать. Для проведения синтеза должно быть два доступных сайта. Один
сайт, называемый P-сайтом (для пептида), является местом роста (или зарождения)
полипептид расположен.Рядом с этим местом находится другое место, где
тРНК с
Рисунок 2. Молекула тРНК. тРНК переносит аминокислоту на синтез сайт на рибосоме.
его новая аминокислота может связываться. Этот сайт называется сайтом A (для амино кислота, которая доставляется туда вместе с тРНК).
Как и в случае с удлинением мРНК, отмеченным ранее, каким-то образом возникающий полипептид должен перестать добавлять аминокислоты.Прекращение Фактически часть кодирования присутствует в кодонах. Три специфических кодона известны как стоп-коды, и когда они присутствуют в мРНК, удлинение остановлен.
Несмотря на общую сложность этого процесса, он происходит с поразительной
точность.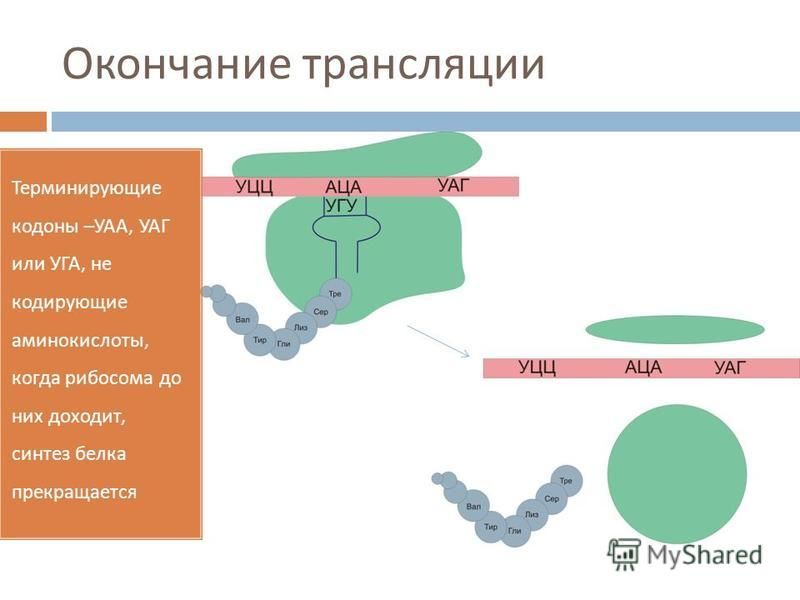 Уровень ошибки составляет примерно одну на каждые 10 000 аминокислот.
Используя процессы транскрипции и перевода, тело создает
удивительное количество и разнообразие белков.
Уровень ошибки составляет примерно одну на каждые 10 000 аминокислот.
Используя процессы транскрипции и перевода, тело создает
удивительное количество и разнообразие белков.
Процессы транскрипции и перевода обеспечивают правильную первичную структура белка. Белок должен сворачиваться, чтобы получить правильный вторичные и третичные структуры. Сворачивание белков остается активным область исследования.
Медицинские приложения
Синтез белка имеет решающее значение для роста клеток; лекарства, которые работают
убивая клетки, часто нацелены на этот процесс. Большинство антибиотиков работают
нарушив процесс перевода.Тетрациклин — это антибиотик, который
ингибирует связывание тРНК с сайтом сборки. Стрептомицин работает, заставляя процесс перевода делать больше ошибок, чем
обычно — одна ошибка на каждые 100 аминокислот. Белки
при этом многие ошибки не способны выполнять свои задачи, и
клетки (в данном случае бактерии) погибают. Стрептомицин также подавляет
инициирование процесса синтеза.
Стрептомицин также подавляет
инициирование процесса синтеза.
Список используемой литературы
Адамс, Р.L. P .; Knowler, J. T .; и лидер, Д. П. (1992). Биохимия нуклеиновых кислот. Нью-Йорк: Чепмен и Холл.
Дарнелл, Дж. Э. младший (1985). «РНК». Scientific American 253 (4): 68–78.
Лейк, Дж. А. (1981). «Рибосома». Scientific American 245 (2): 84–97.
Другие статьи, которые могут вам понравиться:
переводов | Описание, процесс и расположение
Перевод , синтез белка из РНК.Наследственная информация содержится в нуклеотидной последовательности ДНК в коде. Закодированная информация из ДНК точно копируется во время транскрипции в форму РНК, известную как информационная РНК (мРНК), которая затем транслируется в цепочки аминокислот. Цепи аминокислот складываются в спирали, зигзаги и другие формы для образования белков и иногда связаны с другими цепями аминокислот.
Цепи аминокислот складываются в спирали, зигзаги и другие формы для образования белков и иногда связаны с другими цепями аминокислот.
Подробнее по этой теме
наследственность: перевод
Процесс трансляции требует взаимодействия не только большого количества белковых факторов трансляции, но и специфических…
Конкретные количества аминокислот в белке и их последовательность определяют уникальные свойства белка; например, мышечный белок и белок волос содержат одни и те же 20 аминокислот, но последовательности этих аминокислот в двух белках совершенно разные. Если представить себе нуклеотидную последовательность мРНК как письменное сообщение, можно сказать, что это сообщение считывается аппаратом трансляции «словами» из трех нуклеотидов, начиная с одного конца мРНК и продолжаясь по длине молекулы. .Эти трехбуквенные слова называются кодонами. Каждый кодон обозначает определенную аминокислоту, поэтому, если сообщение в мРНК имеет длину 900 нуклеотидов, что соответствует 300 кодонам, оно будет транслировано в цепочку из 300 аминокислот.
Трансляция происходит на рибосомах — сложных частицах в клетке, которые содержат РНК и белок. У прокариот (организмов, лишенных ядра) рибосомы загружаются на мРНК, в то время как транскрипция все еще продолжается. Последовательность мРНК считывается по три основания за раз от ее 5 ’конца к ее 3’ концу, и одна аминокислота добавляется к растущей цепи из ее соответствующей транспортной РНК (тРНК), пока не будет собрана полная белковая цепь.Трансляция останавливается, когда рибосома встречает кодон терминации, обычно UAG, UAA или UGA (где U, A и G представляют собой основания РНК урацил, аденин и гуанин, соответственно). Особые факторы высвобождения связываются с рибосомой в ответ на эти кодоны, и вновь синтезированный белок, тРНК и мРНК диссоциируют. Затем рибосома становится доступной для взаимодействия с другой молекулой мРНК.
Любая мРНК транслируется несколькими рибосомами по своей длине, каждая из которых находится на разной стадии трансляции.У эукариот (организмов, обладающих ядром) рибосомы, производящие белки для использования в одной и той же клетке, не связаны с мембранами. Однако белки, которые должны быть экспортированы в другое место в организме, синтезируются на рибосомах, расположенных за пределами плоских мембранных камер, называемых эндоплазматическим ретикулумом (ER). Завершенная аминокислотная цепь выдавливается во внутреннюю полость ER. Впоследствии ER транспортирует белки через маленькие пузырьки к другой цитоплазматической органелле, называемой аппаратом Гольджи, который, в свою очередь, отрастает больше пузырьков, которые в конечном итоге сливаются с клеточной мембраной.Затем белок высвобождается из клетки.
Однако белки, которые должны быть экспортированы в другое место в организме, синтезируются на рибосомах, расположенных за пределами плоских мембранных камер, называемых эндоплазматическим ретикулумом (ER). Завершенная аминокислотная цепь выдавливается во внутреннюю полость ER. Впоследствии ER транспортирует белки через маленькие пузырьки к другой цитоплазматической органелле, называемой аппаратом Гольджи, который, в свою очередь, отрастает больше пузырьков, которые в конечном итоге сливаются с клеточной мембраной.Затем белок высвобождается из клетки.
3.4 Синтез белков — анатомия и физиология
Цели обучения
Основная цель
- Объясните процесс, с помощью которого клетка строит белки, используя код ДНК
К концу этого раздела вы сможете:
- Объясните, как генетический код в ДНК определяет образующиеся белки
- Опишите процесс транскрипции
- Объясните процесс перевода
- Обсудить функцию рибосом
Ранее упоминалось, что ДНК обеспечивает «план» структуры и физиологии клетки.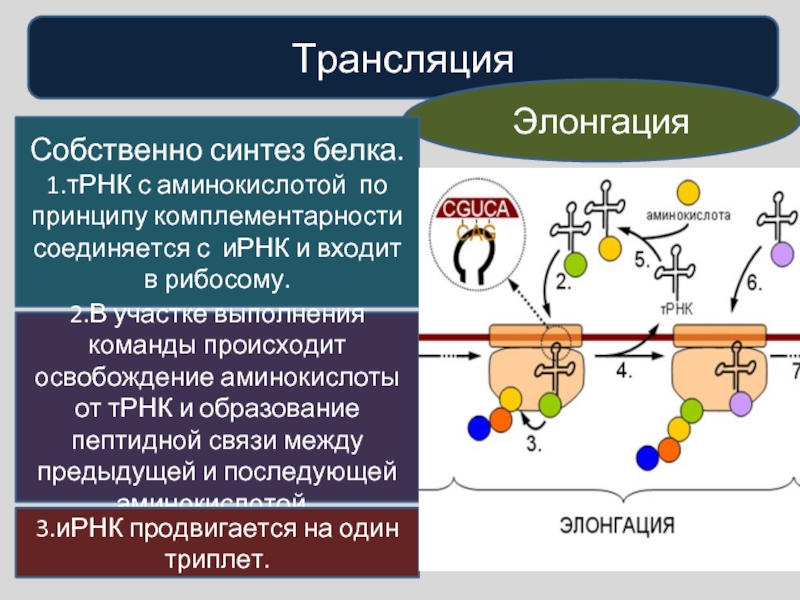 Это относится к тому факту, что ДНК содержит информацию, необходимую клетке для построения одного очень важного типа молекулы: белка. Большинство структурных компонентов клетки, по крайней мере частично, состоят из белков, и практически все функции, которые выполняет клетка, выполняются с помощью белков. Один из наиболее важных классов белков — это ферменты, которые помогают ускорить необходимые биохимические реакции, происходящие внутри клетки. Некоторые из этих критических биохимических реакций включают создание более крупных молекул из более мелких компонентов (например, то, что происходит во время репликации ДНК или синтеза микротрубочек) и разрушение более крупных молекул на более мелкие компоненты (например, при сборе химической энергии из молекул питательных веществ).Каким бы ни был клеточный процесс, в нем почти наверняка участвуют белки. Подобно тому, как геном клетки описывает полный набор ДНК, протеом клетки представляет собой полный набор белков. Синтез белка начинается с генов.
Это относится к тому факту, что ДНК содержит информацию, необходимую клетке для построения одного очень важного типа молекулы: белка. Большинство структурных компонентов клетки, по крайней мере частично, состоят из белков, и практически все функции, которые выполняет клетка, выполняются с помощью белков. Один из наиболее важных классов белков — это ферменты, которые помогают ускорить необходимые биохимические реакции, происходящие внутри клетки. Некоторые из этих критических биохимических реакций включают создание более крупных молекул из более мелких компонентов (например, то, что происходит во время репликации ДНК или синтеза микротрубочек) и разрушение более крупных молекул на более мелкие компоненты (например, при сборе химической энергии из молекул питательных веществ).Каким бы ни был клеточный процесс, в нем почти наверняка участвуют белки. Подобно тому, как геном клетки описывает полный набор ДНК, протеом клетки представляет собой полный набор белков. Синтез белка начинается с генов.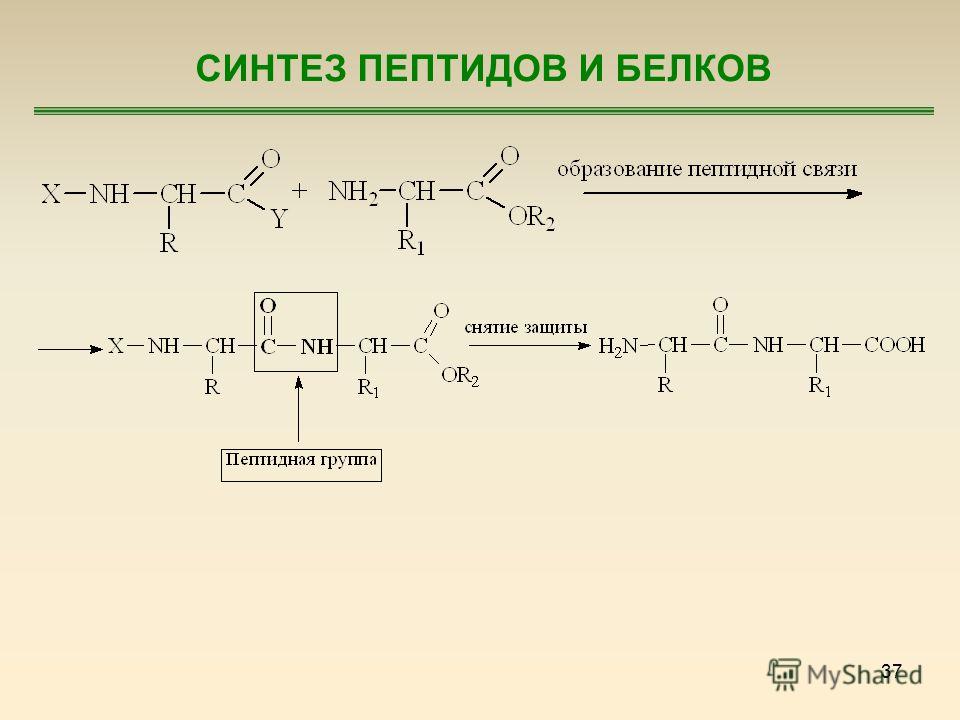 Ген — это функциональный сегмент ДНК, который обеспечивает генетическую информацию, необходимую для создания белка. Каждый конкретный ген обеспечивает код, необходимый для создания определенного белка. Экспрессия гена , которая преобразует информацию, закодированную в гене, в конечный продукт гена, в конечном итоге определяет структуру и функцию клетки, определяя, какие белки сделаны.
Ген — это функциональный сегмент ДНК, который обеспечивает генетическую информацию, необходимую для создания белка. Каждый конкретный ген обеспечивает код, необходимый для создания определенного белка. Экспрессия гена , которая преобразует информацию, закодированную в гене, в конечный продукт гена, в конечном итоге определяет структуру и функцию клетки, определяя, какие белки сделаны.
Интерпретация генов работает следующим образом. Напомним, что белки представляют собой полимеры или цепи многих строительных блоков аминокислот. Последовательность оснований в гене (то есть его последовательность нуклеотидов A, T, C, G) переводится в аминокислотную последовательность. Триплет — это участок из трех оснований ДНК в ряду, который кодирует определенную аминокислоту. Например, триплет ДНК CAC (цитозин, аденин и цитозин) определяет аминокислоту валин. Следовательно, ген, состоящий из нескольких триплетов в уникальной последовательности, обеспечивает код для построения целого белка с несколькими аминокислотами в правильной последовательности (рисунок 3. 4.1). Механизм, с помощью которого клетки превращают код ДНК в белковый продукт, представляет собой двухэтапный процесс с молекулой РНК в качестве промежуточного звена.
4.1). Механизм, с помощью которого клетки превращают код ДНК в белковый продукт, представляет собой двухэтапный процесс с молекулой РНК в качестве промежуточного звена.
От ДНК к РНК: транскрипция
ДНКразмещается в ядре, а синтез белка происходит в цитоплазме, поэтому должен быть какой-то промежуточный посредник, который покидает ядро и управляет синтезом белка.Этим промежуточным мессенджером является матричная РНК (мРНК) (рис. 3.29), одноцепочечная нуклеиновая кислота, которая несет копию генетического кода одного гена из ядра в цитоплазму, где она используется для производства белков. .
Существует несколько различных типов РНК, каждая из которых выполняет свои функции в клетке. Структура РНК похожа на ДНК, за некоторыми небольшими исключениями. Во-первых, в отличие от ДНК, большинство типов РНК, включая мРНК, являются одноцепочечными и не содержат комплементарной цепи.Во-вторых, сахар рибозы в РНК содержит дополнительный атом кислорода по сравнению с ДНК. Наконец, вместо основного тимина РНК содержит основной урацил. Это означает, что аденин всегда соединяется с урацилом в процессе синтеза белка.
Структура РНК похожа на ДНК, за некоторыми небольшими исключениями. Во-первых, в отличие от ДНК, большинство типов РНК, включая мРНК, являются одноцепочечными и не содержат комплементарной цепи.Во-вторых, сахар рибозы в РНК содержит дополнительный атом кислорода по сравнению с ДНК. Наконец, вместо основного тимина РНК содержит основной урацил. Это означает, что аденин всегда соединяется с урацилом в процессе синтеза белка.
Экспрессия гена начинается с процесса, называемого транскрипцией , который представляет собой синтез цепи мРНК, комплементарной интересующему гену. Этот процесс называется транскрипцией, потому что мРНК похожа на транскрипт или копию кода ДНК гена.Транскрипция начинается примерно так же, как репликация ДНК, когда участок ДНК раскручивается и две нити разделяются, однако только небольшая часть ДНК будет разделена. Тройки внутри гена на этом участке молекулы ДНК используются в качестве матрицы для транскрипции комплементарной цепи РНК (рис. 3. 4.2). Кодон представляет собой последовательность из трех оснований мРНК, названную так потому, что они непосредственно кодируют аминокислоты. Как и в случае репликации ДНК, транскрипция состоит из трех стадий: инициация, удлинение и завершение.
4.2). Кодон представляет собой последовательность из трех оснований мРНК, названную так потому, что они непосредственно кодируют аминокислоты. Как и в случае репликации ДНК, транскрипция состоит из трех стадий: инициация, удлинение и завершение.
На первом из двух этапов создания белка из ДНК ген в молекуле ДНК транскрибируется в комплементарную молекулу мРНК.
Этап 1: Инициирование. Область в начале гена, называемая промотором, — определенная последовательность нуклеотидов — запускает начало транскрипции.
Этап 2: удлинение. Транскрипция начинается, когда РНК-полимераза раскручивает сегмент ДНК. Одна цепь, называемая кодирующей цепью, становится матрицей с генами, которые нужно кодировать. Затем полимераза выравнивает правильную нуклеиновую кислоту (A, C, G или U) с ее комплементарным основанием на кодирующей цепи ДНК. РНК-полимераза — это фермент, который добавляет новые нуклеотиды к растущей цепи РНК. В результате этого процесса строится цепь мРНК.
РНК-полимераза — это фермент, который добавляет новые нуклеотиды к растущей цепи РНК. В результате этого процесса строится цепь мРНК.
Этап 3: Прекращение действия. Когда полимераза достигает конца гена, один из трех специфических триплетов (UAA, UAG или UGA) кодирует «стоп-сигнал», который запускает ферменты для прекращения транскрипции и высвобождения транскрипта мРНК.
Процесс транскрипции регулируется классом белков, называемых факторами транскрипции , которые связываются с последовательностью гена и либо способствуют, либо ингибируют их транскрипцию. (переместите сюда Рисунок 3.35).
Прежде чем молекула мРНК покинет ядро и перейдет к синтезу белка, она модифицируется несколькими способами. По этой причине на этой стадии ее часто называют пре-мРНК. Например, ваша ДНК и, следовательно, комплементарная мРНК, содержит длинные области, называемые некодирующими областями, которые не кодируют аминокислоты.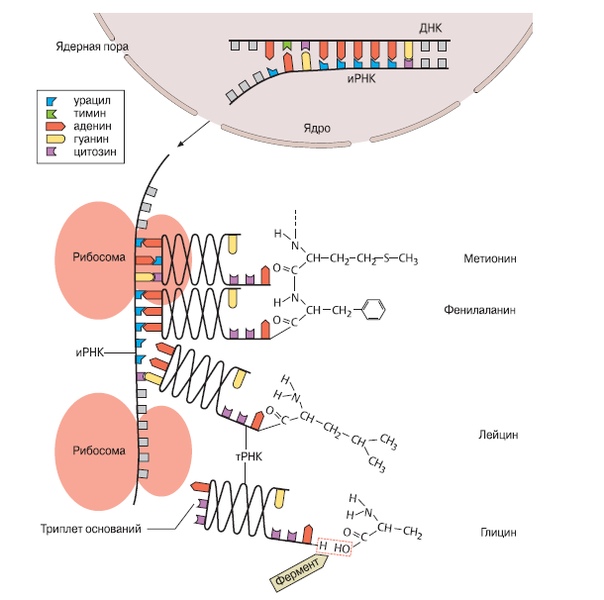 Их функция до сих пор остается загадкой, но процесс, называемый сплайсингом , удаляет эти некодирующие области из транскрипта пре-мРНК (рис. 3.4.3). Сплайсосома — структура, состоящая из различных белков и других молекул — прикрепляется к мРНК и «сращивает» или вырезает некодирующие области. Удаленный сегмент транскрипта называется интроном . Остальные экзоны склеены. Экзон — это сегмент РНК, который остается после сплайсинга.Интересно, что некоторые интроны, удаленные из мРНК, не всегда являются некодирующими. Когда различные кодирующие области мРНК сплайсируются, в конечном итоге возникают разные вариации белка с различиями в структуре и функции. Этот процесс приводит к гораздо большему разнообразию возможных белков и функций белков. Когда транскрипт мРНК готов, он выходит из ядра в цитоплазму.
Их функция до сих пор остается загадкой, но процесс, называемый сплайсингом , удаляет эти некодирующие области из транскрипта пре-мРНК (рис. 3.4.3). Сплайсосома — структура, состоящая из различных белков и других молекул — прикрепляется к мРНК и «сращивает» или вырезает некодирующие области. Удаленный сегмент транскрипта называется интроном . Остальные экзоны склеены. Экзон — это сегмент РНК, который остается после сплайсинга.Интересно, что некоторые интроны, удаленные из мРНК, не всегда являются некодирующими. Когда различные кодирующие области мРНК сплайсируются, в конечном итоге возникают разные вариации белка с различиями в структуре и функции. Этот процесс приводит к гораздо большему разнообразию возможных белков и функций белков. Когда транскрипт мРНК готов, он выходит из ядра в цитоплазму.
Внешний веб-сайт
Это видео покажет вам важные ферменты и биомолекулы, участвующие в процессе транскрипции, процессе создания молекулы мРНК из ДНК.
От РНК к белку: трансляция
Подобно переводу книги с одного языка на другой, кодоны цепи мРНК должны быть переведены в аминокислотный алфавит белков. Перевод — это процесс синтеза цепочки аминокислот, называемой полипептидом.Для перевода требуются два основных вспомогательных средства: во-первых, «транслятор», молекула, которая будет осуществлять трансляцию, и, во-вторых, субстрат, на котором цепь мРНК транслируется в новый белок, как «стол переводчика». Оба эти требования выполняются другими типами РНК. Субстратом, на котором происходит трансляция, является рибосома.
Помните, что многие рибосомы клетки связаны с грубым ER и осуществляют синтез белков, предназначенных для аппарата Гольджи. Рибосомная РНК (рРНК) — это тип РНК, которая вместе с белками составляет структуру рибосомы. Рибосомы существуют в цитоплазме в виде двух отдельных компонентов, маленькой и большой субъединицы. Когда молекула мРНК готова к трансляции, две субъединицы объединяются и прикрепляются к мРНК. Рибосома обеспечивает субстрат для трансляции, объединяя и выравнивая молекулу мРНК с молекулярными «трансляторами», которые должны расшифровать ее код.
Рибосомы существуют в цитоплазме в виде двух отдельных компонентов, маленькой и большой субъединицы. Когда молекула мРНК готова к трансляции, две субъединицы объединяются и прикрепляются к мРНК. Рибосома обеспечивает субстрат для трансляции, объединяя и выравнивая молекулу мРНК с молекулярными «трансляторами», которые должны расшифровать ее код.
Другое важное требование для синтеза белка — это молекулы-трансляторы, которые физически «читают» кодоны мРНК. Трансферная РНК (тРНК) — это тип РНК, которая переносит соответствующие соответствующие аминокислоты на рибосому и присоединяет каждую новую аминокислоту к последней, создавая полипептидную цепь одна за другой. Таким образом, тРНК переносит определенные аминокислоты из цитоплазмы в растущий полипептид. Молекулы тРНК должны быть способны распознавать кодоны на мРНК и сопоставлять их с правильной аминокислотой. ТРНК модифицирована для этой функции. На одном конце его структуры находится сайт связывания определенной аминокислоты. На другом конце находится последовательность оснований, которая соответствует кодону, определяющему его конкретную аминокислоту. Эта последовательность из трех оснований в молекуле тРНК называется антикодоном . Например, тРНК, отвечающая за перемещение аминокислоты глицина, содержит сайт связывания глицина на одном конце. С другой стороны, он содержит антикодон, который дополняет кодон глицина (GGA является кодоном для глицина, и поэтому антикодон тРНК будет читать CCU). Оборудованная своим конкретным грузом и подходящим антикодоном, молекула тРНК может считывать свой распознанный кодон мРНК и переносить соответствующую аминокислоту в растущую цепь (рис.4.4).
На другом конце находится последовательность оснований, которая соответствует кодону, определяющему его конкретную аминокислоту. Эта последовательность из трех оснований в молекуле тРНК называется антикодоном . Например, тРНК, отвечающая за перемещение аминокислоты глицина, содержит сайт связывания глицина на одном конце. С другой стороны, он содержит антикодон, который дополняет кодон глицина (GGA является кодоном для глицина, и поэтому антикодон тРНК будет читать CCU). Оборудованная своим конкретным грузом и подходящим антикодоном, молекула тРНК может считывать свой распознанный кодон мРНК и переносить соответствующую аминокислоту в растущую цепь (рис.4.4).

Подобно процессам репликации и транскрипции ДНК, трансляция состоит из трех основных стадий: инициации, элонгации и терминации. Инициирование происходит при связывании рибосомы с транскриптом мРНК.Стадия элонгации включает распознавание антикодона тРНК со следующим кодоном мРНК в последовательности. Как только последовательности антикодона и кодона связаны (помните, что они являются комплементарными парами оснований), тРНК представляет свой аминокислотный груз, и растущая полипептидная цепь присоединяется к этой следующей аминокислоте. Это прикрепление происходит с помощью различных ферментов и требует энергии. Затем молекула тРНК высвобождает цепь мРНК, цепь мРНК сдвигает один кодон в рибосоме, и следующая подходящая тРНК прибывает с соответствующим ей антикодоном.Этот процесс продолжается до тех пор, пока не будет достигнут последний кодон на мРНК, который выдает «стоп» сообщение, сигнализирующее о прекращении трансляции и запускающее высвобождение полного, вновь синтезированного белка. Таким образом, ген в молекуле ДНК транскрибируется в мРНК, которая затем транслируется в белковый продукт (рис. 3.4.5).
Таким образом, ген в молекуле ДНК транскрибируется в мРНК, которая затем транслируется в белковый продукт (рис. 3.4.5).
Внешний веб-сайт
Это видео покажет вам важные ферменты и биомолекулы, участвующие в процессе трансляции, который использует мРНК для кодирования белка.
Рисунок 3.4.5 — От ДНК к белку: транскрипция через трансляцию: Транскрипция в ядре клетки производит молекулу мРНК, которая модифицируется и затем отправляется в цитоплазму для трансляции. Транскрипт расшифровывается в белок с помощью рибосомы и молекул тРНК. Обычно транскрипция мРНК транслируется одновременно несколькими соседними рибосомами. Это увеличивает эффективность синтеза белка. Одна рибосома может транслировать молекулу мРНК примерно за одну минуту; таким образом, несколько рибосом на борту одного транскрипта могут производить в несколько раз больше одного и того же белка за одну минуту.Полирибосома — это цепочка рибосом, транслирующая одну цепь мРНК.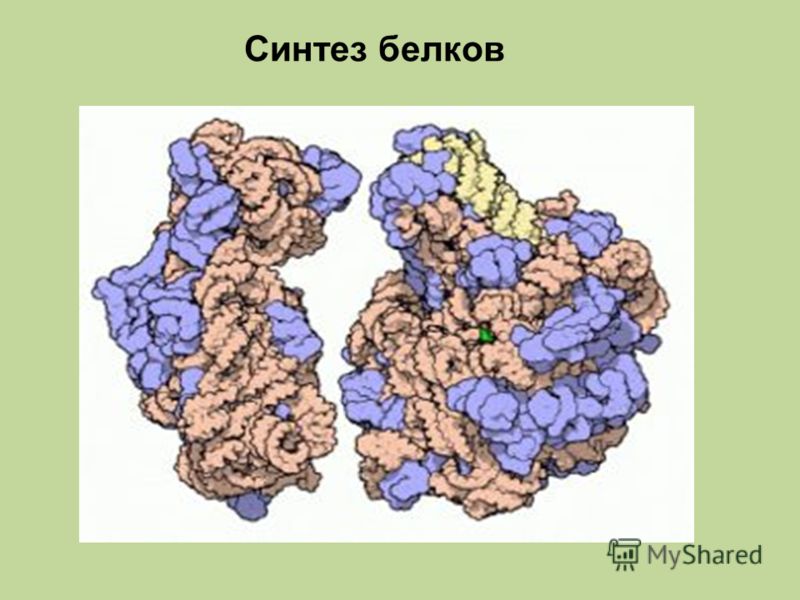
Внешний веб-сайт
Посмотрите это видео, чтобы узнать о рибосомах. Рибосома связывается с молекулой мРНК, чтобы начать трансляцию своего кода в белок. Что происходит с малыми и большими субъединицами рибосом в конце трансляции?
Обзор главы
ДНК хранит информацию, необходимую для того, чтобы дать клетке команду выполнять все свои функции.Клетки используют генетический код, хранящийся в ДНК, для создания белков, которые в конечном итоге определяют структуру и функцию клетки. Этот генетический код заключается в определенной последовательности нуклеотидов, составляющих каждый ген в молекуле ДНК. Чтобы «прочитать» этот код, ячейка должна выполнить два последовательных шага. На первом этапе транскрипции код ДНК преобразуется в код РНК. Молекула информационной РНК, комплементарная определенному гену, синтезируется в процессе, аналогичном репликации ДНК.Молекула мРНК обеспечивает код для синтеза белка.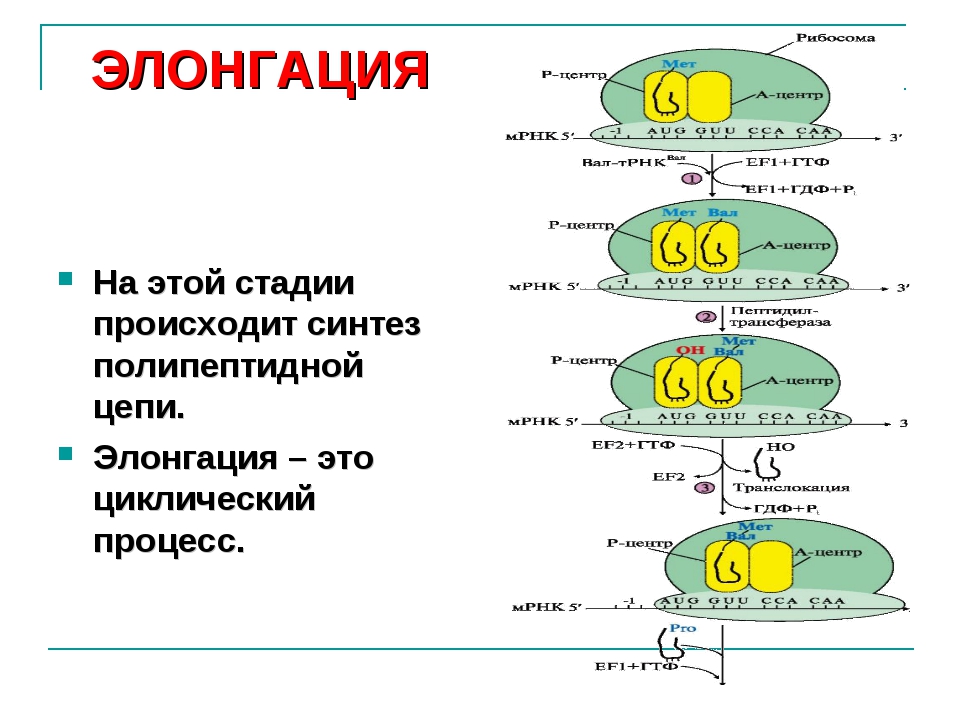 В процессе трансляции мРНК прикрепляется к рибосоме. Затем молекулы тРНК перемещают соответствующие аминокислоты к рибосоме, одна за другой, кодируемые последовательными триплетными кодонами на мРНК, до тех пор, пока белок не будет полностью синтезирован. По завершении мРНК отделяется от рибосомы, и белок высвобождается. Как правило, несколько рибосом прикрепляются к одной молекуле мРНК одновременно, так что из мРНК можно производить несколько белков одновременно.
В процессе трансляции мРНК прикрепляется к рибосоме. Затем молекулы тРНК перемещают соответствующие аминокислоты к рибосоме, одна за другой, кодируемые последовательными триплетными кодонами на мРНК, до тех пор, пока белок не будет полностью синтезирован. По завершении мРНК отделяется от рибосомы, и белок высвобождается. Как правило, несколько рибосом прикрепляются к одной молекуле мРНК одновременно, так что из мРНК можно производить несколько белков одновременно.
Контрольные вопросы
Вопросы о критическом мышлении
Кратко объясните сходство между транскрипцией и репликацией ДНК.
И транскрипция, и репликация ДНК включают синтез нуклеиновых кислот. Эти процессы имеют много общих черт, в частности, схожие процессы инициирования, удлинения и завершения. В обоих случаях молекула ДНК должна быть раскручена и разделена, а кодирование (т. е.е., sense) прядь будет использоваться в качестве шаблона. Также полимеразы служат для добавления нуклеотидов к растущей цепи ДНК или мРНК. Оба процесса получают сигнал о завершении после завершения.
е.е., sense) прядь будет использоваться в качестве шаблона. Также полимеразы служат для добавления нуклеотидов к растущей цепи ДНК или мРНК. Оба процесса получают сигнал о завершении после завершения.
Контрастная транскрипция и перевод. Назовите хотя бы три различия между двумя процессами.
Транскрипция — это на самом деле процесс «копирования», а трансляция — это на самом деле процесс «интерпретации», потому что транскрипция включает копирование сообщения ДНК в очень похожее сообщение РНК, тогда как перевод включает преобразование сообщения РНК в совершенно другое аминокислотное сообщение.Эти два процесса также различаются по своему расположению: транскрипция происходит в ядре, а трансляция — в цитоплазме. Механизмы, с помощью которых выполняются эти два процесса, также полностью различны: транскрипция использует ферменты полимеразы для создания мРНК, тогда как трансляция использует различные виды РНК для создания белка.
.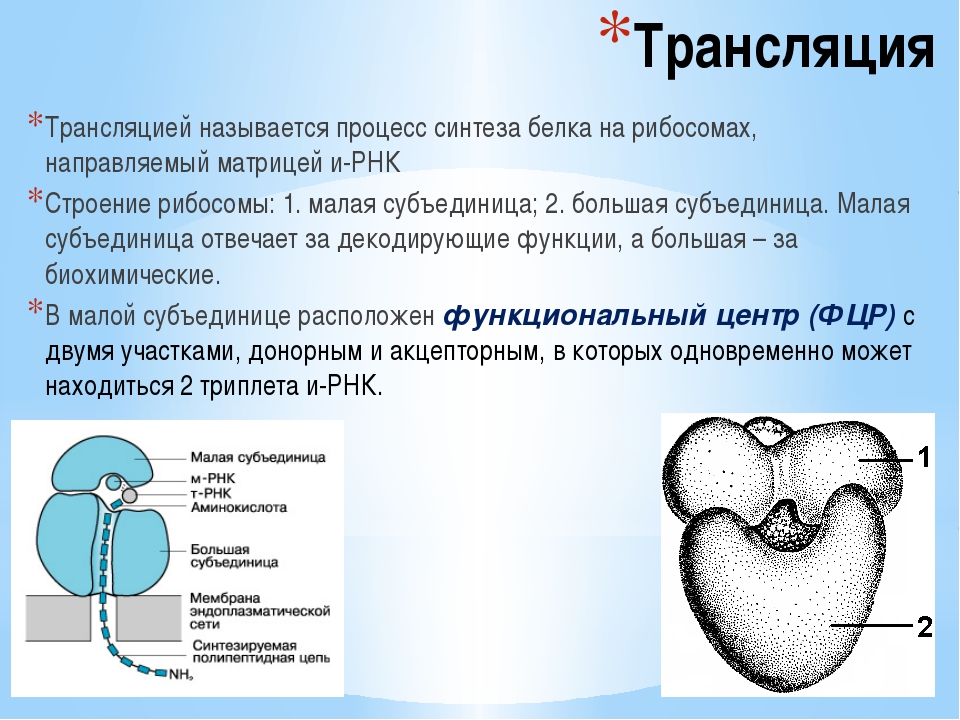

 Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток). Исследуя регуляцию Amd1, мы обнаружили такой сигнал застревания. Но интересно оказалось то, что этот сигнал расположен после стоп кодона рамки считывания Amd1. Зачем же он там нужен?»
Исследуя регуляцию Amd1, мы обнаружили такой сигнал застревания. Но интересно оказалось то, что этот сигнал расположен после стоп кодона рамки считывания Amd1. Зачем же он там нужен?» org, Wellcome Genome Campus (Великобритания) — 2:42 мин.
org, Wellcome Genome Campus (Великобритания) — 2:42 мин.  Аминокислоты являются основными ингредиентами, которые входят в рецепт протеина, и рибосомы используют план, предоставляемый информационной РНК, чтобы расположить аминокислоты в правильном порядке и сформировать длинную цепочку. Аминокислоты — это органические молекулы, которые содержат амин, химическое соединение, полученное из аммиака. Химики знают сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из единой цепи в сложную трехмерную структуру.
Аминокислоты являются основными ингредиентами, которые входят в рецепт протеина, и рибосомы используют план, предоставляемый информационной РНК, чтобы расположить аминокислоты в правильном порядке и сформировать длинную цепочку. Аминокислоты — это органические молекулы, которые содержат амин, химическое соединение, полученное из аммиака. Химики знают сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из единой цепи в сложную трехмерную структуру. В ДНК этими основаниями являются аденин (A), тимин (T), цитозин (C) и гуанин (G). Но в РНК тимин заменен урацилом (U), который также может образовывать пары с аденином (A). Но почему мы не находим урацил в ДНК? Чтобы облегчить восстановление ДНК при возникновении мутации. Иногда цитозин по ошибке превращается в урацил. Если бы ДНК состояла из урацила, а не тимина, клетке было бы сложно узнать, какие молекулы урацила являются ошибками, которые необходимо исправить. Однако эта проблема не относится к РНК из-за ее короткого срока службы.Чаще всего молекулы РНК служат своей цели всего за несколько минут, прежде чем они будут переработаны.
В ДНК этими основаниями являются аденин (A), тимин (T), цитозин (C) и гуанин (G). Но в РНК тимин заменен урацилом (U), который также может образовывать пары с аденином (A). Но почему мы не находим урацил в ДНК? Чтобы облегчить восстановление ДНК при возникновении мутации. Иногда цитозин по ошибке превращается в урацил. Если бы ДНК состояла из урацила, а не тимина, клетке было бы сложно узнать, какие молекулы урацила являются ошибками, которые необходимо исправить. Однако эта проблема не относится к РНК из-за ее короткого срока службы.Чаще всего молекулы РНК служат своей цели всего за несколько минут, прежде чем они будут переработаны.