Мышечные белки: Мышечные белки. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
А.Я. Данилевский впервые разделил экстрагируемые из мышц белки на 3 класса: растворимые в воде, экстрагируемые 8–12 % раствором хлорида аммония и белки, извлекаемые разбавленными растворами кислот и щелочей. В настоящее время белки мышечной ткани делят на три основные группы: саркоплазматические, миофибриллярные и белки стромы. На долю первых приходится около 35%, вторых – 45% и третьих – 20% от всего количества мышечного белка. Эти группы белков резко отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Белки, входящие в состав саркоплазмы, относятся к протеинам, растворимым в солевых средах с
низкой ионной силой. Принятое ранее подразделение саркоплазматических белков на
миоген, глобулин X, миоальбумин и белки-пигменты в значительной мере утратило
смысл, поскольку существование глобулина X и миогена как индивидуальных белков
в настоящее время отрицается. Установлено, что глобулин X представляет собой
смесь различных белковых веществ со свойствами глобулинов. Термин «миоген»
также является собирательным понятием. В частности, в состав белков группы
миогена входит ряд протеинов, наделенных ферментативной активностью: например,
ферменты гликолиза. К числу саркоплазмати-ческих белков относятся также
дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные
главным образом в митохондриях и катализирующие процессы тканевого дыхания,
окислительного фосфорилирования, а также многие стороны азотистого и липидного
обмена. Недавно была открыта группа саркоплазматических белков –
пар-вальбумины, которые способны связывать ионы Са
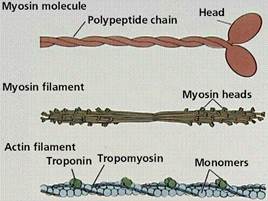
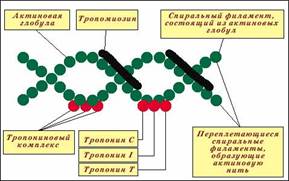
К группе миофибриллярных белков относятся миозин, актин и актомио-зин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
Рис. 20.3. Строение молекулы миозина. Объяснение в тексте.
Миозин
составляет 50–55% от сухой массы миофибрилл. Представление о миозине как о
главном белке миофибрилл сложилось в результате работ А.Я. Данилевского, О.
Фюрта, Э. Вебера и ряда других исследователей. Однако всеобщее внимание к
миозину было привлечено лишь после опубликования работ В.А. Энгельгардта и М.Н.
Любимовой (1939– 1942). В этих работах впервые было показано, что миозин
обладает АТФазной активностью, т.е. способностью катализировать расщепление АТФ
на АДФ и Н
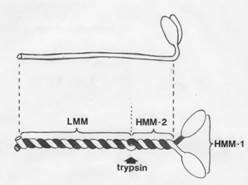
Кратковременная обработка трипсином расщепляет молекулу миозина на два фрагмента. Из хвостового
участка (С-концевой участок молекулы) образуется легкий меромиозин (ЛММ) -
фрагмент длиной 90 нм, а из остальной части, включающей «головки»,- тяжелый
меромиозин (ТММ). ЛММ, подобно миозину, образует нити, однако он не обладает
АТФазной активностью и не связывает актин. ТММ катализирует гидролиз АТФ и
связывает актин. ТММ можно расщепить далее путем более длительной обработки
трипсином или папаином, в результате чего получается один S
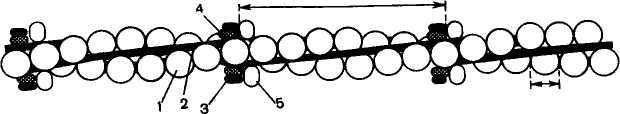
Толстые нити (толстые миофиламенты) в саркомере надо понимать как образование, полученное путем соединения большого числа определенным образом ориентированных в пространстве молекул миозина (рис. 20.4).
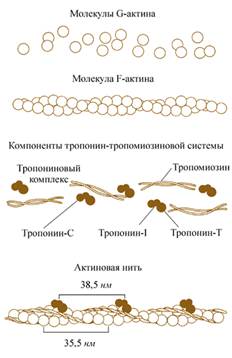
Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в обра-
Рис. 20.4.
зовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полиме-ризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 20.5).
Актомиозин
образуется при соединении миозина с F-актином. Ак-томиозин, как естественный,
так и искусственный, т.е. полученный путем соединения in
vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной
активностью, которая отличается от таковой миозина, АТФазная активность миозина
значительно возрастает в присутствии стехиометрических количеств F-актина.
Фермент актомиозин активируется ионами Mg
Как отмечалось, кроме рассмотренных основных белков, в миофибрил-лах содержатся также тропомиозин, тропонин и некоторые другие ре-гуляторные белки.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл.
Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г.; его мол. масса 80000. В
скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь
около 2% от всех миофибриллярных белков. В его состав входят три субъединицы
(Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность,
ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т
(тропомиозин-связывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь
с тропомиозином, образует комплекс, названный нативным тропомиози-ном. Этот
комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных
мышц позвоночных чувствительность к ионам Са
Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ. Вопрос о том, имеет ли отношение фосфорилирование тропонина in vitro к регуляции мышечного сокращения, остается пока открытым.
Белки стромы в поперечно-полосатой мускулатуре представлены в основном коллагеном и эластином. Известно, что строма скелетных мышц, остающаяся после исчерпывающей экстракции мышечной кашицы солевыми растворами с высокой ионной силой, состоит в значительной мере из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур.
Рис. 20.6. Структура тонкого филамента.
1 — актин; 2 - тропомиозин; 3 — тропонин С; 4 — тропонин I; 5 — тропонин Т.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Мышечные белки
Впервые А. Я. Данилевский (1881) разделил экстрагируемые из мышц белки на три класса: растворимые в воде, экстрагируемые 8 — 12% раствором хлорида аммония и белки, извлекаемые разбавленными растворами кислот и щелочей. В настоящее время белки мышечной ткани делят на три основные группы: саркоплазматические белки, миофибриллярные белки, белки стромы. На долю первых приходится около 35%, вторых —45% и третьих-20% всего мышечного белка. Эти группы белков резко отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Белки, входящие в состав саркоплазмы, принадлежат к числу протеинов, растворимых в солевых средах с низкой ионной силой.
К числу саркоплазматических белков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обменов. Недавно была открыта группа саркоплазматических белков — парвальбумины, которые способны связывать ионы кальция.
К группе миофибриллярных белков относятся миозин, актин и актомиозин — белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
 Толстые
нити (толстые
миофиламенты) в саркомере получены
путем соединения большого ппчисла
определенным образом ориентированных
в ппппппппппппппппппппппппппппппппппппространстве
молекул миозина.
Толстые
нити (толстые
миофиламенты) в саркомере получены
путем соединения большого ппчисла
определенным образом ориентированных
в ппппппппппппппппппппппппппппппппппппространстве
молекул миозина.
Актин, составляющий ~20% от сухой массы миофибрилл. Известны две формы актина: глобулярный (Г-актин) и фибриллярный (Ф-актин) актин. Молекула Г-актина состоит из одной полипептидной цепочки, в образовании которой принимают участие 374 аминокислотных остатка. Ф-актин является продуктом полимеризации Г-актина и имеет структуру двухцепочечной спирали.
Актомиозин образуется при соединении миозина с Ф-актином. Актомиозин, как обладает АТФазной активностью. Однако АТФазная активность актомиозина отличается от АТФазной активности миозина. Фермент актомиозин активируется ионами магния и ингибируется этилен-диаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2 +, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня. На долю тропомиозина приходится около 4 — 7% всех белков миофибрилл.
 Т
Т
Структура тонкого филамента.
1 — актин; 2 — тропомиозин; 3 — тропонин С;
4 — тропонин
I; 5 — тропонин Тропонин — глобулярный белок, открытый С. Эбаси в 1963 г. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, Тн-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция.Белки стромы в поперечнополосатой мускулатуре представлены в основном коллагеном и эластином.
Небелковые азотистые экстрактивные вещества
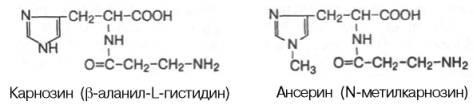
В скелетных мышцах содержится ряд важных азотистых экстрактивных веществ: адениновые нуклеотиды (АТФ, АДФ и АМФ), нуклеотиды неаденинового ряда, креатин-фосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др.
На долю креатина и креатинфосфата приходится до 60% небелкового азота мышц. Креатинфосфат и креатин относятся к тем азотистым экстрактивным веществам мышц, которые участвуют в химических процессах, связанных с мышечным сокращением.
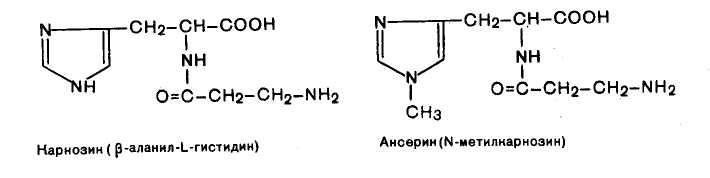
Карнозин и ансерин — специфические азотистые вещества скелетной мускулатуры позвоночных — увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Имидазолсодержащие дипептиды не влияют непосредственно на сократительный аппарат, но увеличивают эффективность работы ионных насосов мышечной клетки.
Среди свободных аминокислот в мышцах наиболее высокую концентрацию имеет глутаминовая кислота (до 1,2 г/кг) и ее амид — глутамин (0,8-1,0 г/кг). В состав различных клеточных мембран мышечной ткани входит ряд фосфоглицеридов: фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и др. Другие азотсодержащие вещества: мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин — встречаются в мышечной ткани в небольшом количестве.

© Mae Mu/Unsplash
Автор Ирина Рудевич
08 апреля 2020
Для роста мышечных клеток необходимы белки и аминокислоты. Этот список легкоусваиваемых продуктов поможет разнообразить рацион, если вы хотите увеличить мышечную массу, повысить силу и выносливость организма.
Последние исследования показали, что вегетарианский рацион может стать основой здорового образа жизни при соблюдении некоторых правил. Вопреки распространенному мнению, отсутствие мяса не мешает наращивать мышечную массу, в том числе спортсменам-тяжеловесам. Важно лишь подобрать альтернативные источники белка, такие как зерна, бобовые и семена растений. Кроме того, нужно учесть степень усвояемости протеина из различных продуктов. Для оценки последней используют коэффициент PDCAAS (Protein Digestibility Corrected Amino Acid Score). Он дает понять, насколько полноценно вещества насыщают организм. Самый высокий показатель по шкале — 1; пища c таким коэффициентном идеально подходит для наращивания и поддержания мышечной массы. Однако потребление таких продуктов без занятий спортом, в частности индивидуально подобранных силовых тренировок, не приведет к росту мышц.

В 100 г коровьего молока 1% жирности содержатся 43 ккал и больше 3 г белка. Его коэффициент усвояемости равен 1. Молоко способствует восстановлению мышечных тканей и усиливает синтез белка. По итогам исследований, натуральное цельное молоко снабжает организм фениламином в среднем на 80% больше, чем обезжиренные аналоги; эта аминокислота входит в состав белков тела. Также в полноценном молоке в 2,8 раза больше треонина — аминокислоты, участвующей в образовании белков.

100 г яиц содержат 158 ккал и 13 г белка. При этом в продукте около 1300 мг лейцина — аминокислоты, которая не синтезируется в организме, может поступать только с продуктами и используется для лечения анемии. Яйца поддерживают рост мышц и при этом отличаются высокой усвояемостью: их коэффициент PDCAAS равен 1. Лейцин также снижает скорость распада белка и поддерживает высокий аналитический ответ скелетных мышц, а значит, помогает сохранить форму в течение долгого времени. Спортсмены добавляют яйца в рацион по еще одной причине: они содержат много цинка, который провоцирует рост мускулатуры за счет инсулиноподобного фактора, что доказали ученые.
Молочные продукты

В кисломолочным продуктах, образованных благодаря свертыванию, содержится казеин — медленно усваиваемый белок. В 100 г творога 1% жирности более 16 г белка и 79 ккал. Сыр также богат казеином, но менее полезен с точки зрения правильного питания: большинство сортов содержат много жира. Тем не менее оба продукта помогают поддерживать мышечную массу: казеин медленно поднимает уровень аминокислот в крови, и он остается высоким в течение нескольких часов. Это свойство делает многие кисломолочные продукты очень сытными, а поэтому идеальными для перекуса, если полноценный обед еще не скоро. Не все продукты из молока содержат много белка. В греческом йогурте его вдвое больше по сравнению с обычным.

Интересно, что мясо считают главным помощником в росте мышц, хотя его коэффициент PDCAAS ниже, чем у творога и молока, и равен 0,92. Но говядина содержит аминокислоты, которые эффективны для увеличения мускулатуры. В продукте много креатина, который также способствует набору мышечной массы, повышает выносливость и подходит для диетического питания. Говядина низкокалорийна по сравнению со многими другими видами мяса: 100 г содержат 187 ккал и 18,9 г белка и 12,4 г жира. Исследования подтверждают, что ее усвояемость в сочетании с физическими упражнениями провоцирует синтез белка и рост мышц у людей любого возраста.
Куриная грудка

Причина, по которой некоторые спортивные диетологи советуют употреблять курицу, а не говядину, в низком содержании жира — 1,9 г на 100 г. Плюс небольшая калорийность — 165 ккал. Интересно, что и белка в курице больше, чем в говядине — 23,6 г в 100 г. Ученые выяснили, что гидролизат натурального куриного белка служит отличным фундаментом для роста мышц без увеличения веса из-за жира. Как и говядина, этот вид мяса в сочетании с тренировками позволяет повысить выносливость и улучшить показатели силовых занятий. Важно выбирать именно грудку, а не другие части птицы, у них не такой полезный состав. Например, в бедре содержится почти 83 мг холестерина, в то время как в грудке — 53 мг.

Вопреки стереотипам, для наращивания мышечной массы подходит не только дорогой лосось. Примерно тем же показателем усвояемости отличаются треска, форель, тунец, кета, горбуша и скумбрия. PDCAAS большинства сортов рыбы равен 0,78. Особый плюс продукта в содержании ненасыщенных Омега-3 и Омега-6. Ученые утверждают, что эти жирные кислоты могут повысить продолжительность жизни. Исследования показали, что они способны увеличить концентрацию белка в мышцах и его медленный распад. Если нужен минимум калорий — выбирайте тунец. Но чем жирнее рыба, тем больше в ней Омега-3 и Омега-6. В 100 г тунца их будет всего 0,2 г, а в лососе — больше 2,5 г. Учитывайте, что в крупной рыбе, которая жила несколько лет, скапливаются тяжелые металлы и токсины, поэтому большой тунец или лосось не могут быть основой рациона.

Эти морепродукты — практически чистый белок. 100 г креветок содержат 95 ккал, почти 19 г белка и всего 2,2 г жира. Их добавление в рацион — простой способ восполнить норму белка без лишних калорий. Аминокислотный коэффициент усвояемости равен 1, что ставит продукт на один уровень с яйцами и молоком. Кроме того, креветки содержат Омега-3 и Омега-6, антиоксидант астаксантин и множество витаминов. Стоит учитывать, что в составе продукта есть тропомиозин, который в некоторых случаях вызывает аллергию. Если вы только планируете добавить креветки в рацион, начните с маленьких порций и проконсультируйтесь с терапевтом.

В вопросе усвояемости турецкий горох не уступает рыбе: его коэффициент PDCAAS также равен 0,78. Но он долго готовится и у некоторых вызывает проблемы с желудком. Оптимально употреблять нут в виде хумуса — пюре из готового вареного нута с добавлением масла и специй. В 100 г менее 166 ккал, 10 г жира и 8 г белка. При этом в нуте много аминокислот: валина, изолейцина и лейцина. Многие считают, что последний есть только в яйцах и других животных продуктах. К тому же в этих бобовых содержатся цинк, глицин, метионин и аргинин, который в процессе распада образует креатин, нужный для роста мускулатуры.
Функциональные свойства мышечных белков / Статьи
В продуктах из мяса птицы белки выполняют множество различных функций. Свойства, характерные для определенных изделий, в частности выход, качество и органолептические показатели, зависят от успешного использования функциональных свойств белков в процессе переработки.
Под функциональными свойствами понимают физические и химические свойства белков, которые определяют их поведение в пищевых продуктах в процессе переработки, хранения и потребления. Они зависят от молекулярного строения и биохимических особенностей белка. Функциональные свойства белков оказывают влияние на многие показатели качества и органолептические характеристики продукта, ощущаемые и воспринимаемые потребителем. Понимание особенностей белков птицы, их свойств и функций необходимо для эффективного использования ингредиентов, разработки новых и модификации существующих продуктов, снижения количества отходов и контроля потребления энергии в ходе технологического процесса. Наиболее важные для конечного продукта функциональные свойства можно классифицировать на три общие категории: * взаимодействия белок-вода;
* взаимодействия белок-жир;
* взаимодействия белок-белок.
Важность какого-либо функционального свойства может меняться в зависимости от вида продукта, мясного сырья, вида и концентрации немясных добавок, используемого технологического оборудования, условий и степени переработки. Функциональные свойства мышечных белков зависят от содержания в рецептуре других ингредиентов и от условий переработки. Любые их изменения в рецептуре продукта или технологическом процессе требуют оценки возможного влияния этих изменений на структуру мышечных белков. Например, изменения в рецептуре могут повлиять на pH, концентрацию соли и белка в продукте, что наряду с другими факторами вызывает изменение биохимических, а следовательно и функциональных свойств мышечных белков. Изменения условий переработки, особенно температуры продукта или степени измельчения, также могут повлиять на биохимические свойства белков. Все это отражается на их структуре и, следовательно, оказывает непосредственное влияние на качество конечного продукта. Зачастую потребность в определенном функциональном свойстве изменяется в процессе переработки. Так, растворимость, способность к связыванию воды и жира являются наиболее важными функциональными свойствами сырых продуктов из мяса птицы. Способность к удержанию воды и жира и к гелеобразованию крайне важны для мясных продуктов в процессе термообработки. Чаще всего необходима многофункциональность белков, то есть предполагается, что любой белок проявляет не одно, а несколько функциональных свойств либо одновременно, либо последовательно в процессе переработки.
Мышечные белки
Мясо птицы содержит примерно 20-23% белков. Мышечные белки по их растворимости можно разделить на три группы: миофибриллярные, саркоплазматические и белки стромы.
Таблица 1. Белки скелетных мышц птицы
I
Миофибриллярные белки (55% от общего количества белков)
Сократительные белки
Пример: миозин, актин
Регуляторные белки
Пример: тропомиозин, тропонин
Цитоскелетные белки
Пример: тайтин, небулин
II
Саркоплазматические белки (35% от общего количества белков)
Гликолитические ферменты
Митохондриальные и окислительные ферменты
Лизосомальные ферменты
Миоглобин и другие гемовые ферменты
III
Белки стромы (3-5% от общего количества белков)
Коллаген
Эластин
Ретикулин
Миофибриллярные, или солерастворимые белки нерастворимы в воде, но большинство растворяется в растворах поваренной соли концентрацией более 1%. Эта группа состоит примерно из 20 отдельных белков, входящих в состав миофибрилл сократительной мышцы. Миофибриллярные белки могут быть разделены на три группы в зависимости от выполняемой функции: сократительные, которые ответственны за мышечные сокращения, регуляторные, участвующие в управлении процессом сокращения, и цитоскелетные, скрепляющие миофибриллы и способствующие сохранению их структурной целостности.
Сократительные белки миозин и актин оказывают большое влияние на функциональность мышечного белка. Поскольку в окоченевшей мышце актин и миозин находятся в виде актомиозинового комплекса, изменяется функциональность миозина как в эмульгированных, так и в формованных продуктах из мяса птицы. Свойства продуктов зависят также от общего соотношения актина и миозина и соотношения миозина и актина в свободном состоянии. Саркоплазматические белки и белки стромы, в свою очередь, влияют на функциональные свойства миофибриллярных белков.
Саркоплазматические белки растворимы в воде или в растворах с малой ионной силой (
Белки стромы, часто называемые белками соединительной ткани, служат каркасом, поддерживающим структуру мышцы. Основным белком стромы является коллаген. Эластин и ретикулин составляют небольшую часть стромы. Все эти белки нерастворимы в воде и солевых растворах. Нежность мяса, как правило, уменьшается с увеличением возраста животных благодаря образованию поперечных связей и другим изменениям коллагена.
Кожа птицы является основным источником коллагена в рецептурах продуктов из мяса птицы. Хотя этот вид сырья обычно используют в качестве источника жира, его добавление приводит к увеличению содержания коллагена. При высоких концентрациях в рецептурах коллаген может оказывать влияние на функциональные свойства миофибриллярных белков. Он способен вызвать уменьшение размеров (усадку) продуктов из измельченного мяса, особенно при высокотемпературной обработке, а также влиять на связывание кусков мяса в формованных продуктах.
Роль белков в эмульгированных и формованных продуктах
При изготовлении эмульгированных продуктов из мяса птицы мясо, вода, соль, фосфаты и другие ингредиенты измельчают или перемалывают до образования пастообразной массы – мясной эмульсии. Эмульсией заполняют оболочку желаемой формы и подвергают термообработке.
Мясная эмульсия представляет собой сложную систему, состоящую из гидратированных мышечных белков, мышечных волокон, фрагментов миофибрилл, жировых клеток, капель жира, воды, соли, фосфатов и других компонентов. Эмульгированные продукты, такие как сосиски, копченые и вареные колбасы, содержат примерно 17-20% белка, 0-20% жира и 60-80% воды. Таким образом, относительно небольшое количество белка должно связать достаточно большое количество воды и жира. В рецептурах мясных продуктов для экстракции и гидратации миофибриллярных белков используется обычно 1,5-2,0% соли.
В процессе эмульгирования происходит измельчение мышечной ткани, то есть ее физическое разрушение путем повреждения сарколеммы (оболочки мышечной клетки) и внутренней сети из соединительной ткани. В присутствии соли мышечные волокна набухают, миофибриллы разделяются на более короткие части, миофибриллярные белки экстрагируются и гидратируются. Эти явления приводят к образованию вязкой пастообразной массы, которая удерживает воду и стабилизирует жир. Под воздействием тепловой обработки экстрагированные и гидратированные мышечные белки эмульсии образуют поперечно-связанную матрицу геля, которая удерживает внутри себя воду и жир, а также формирует текстуру, характерную для готовых эмульгированных продуктов.
Формованные продукты из птицы изготавливают из ломтиков или кусков мяса, связанных или склеенных друг с другом. Рулеты из мяса грудок индейки и куриное мясо ломтями (chickencoldcuts) являются типичными примерами таких продуктов. При производстве эмульгированных и формованных продуктов происходят одни и те же явления. Главное различие заключается в том, что при производстве формованных продуктов большинство изменений происходит на поверхности кусков мяса. Для разрушения мышечных клеток, расщепления мышечных волокон и извлечения миофибриллярных белков с поверхности кусков мяса применяют тумблирование, массирование или перемешивание в присутствии соли. На поверхности кусков мяса при этом образуется склеивающий слой из выделившихся миофибриллярных белков. При тепловой обработке этот белковый раствор превращается в гель, который действует подобно клею и удерживает куски мяса вместе. Считается, что наибольший вклад в скрепляющую способность белкового раствора вносит миофибриллярный белок миозин. Было установлено, что в присутствие коллагена на поверхности снижает сцепление между кусками мяса.
Взаимодействие белок-вода
В целом все функциональные свойства белков зависят от их взаимодействия с водой. Однако три свойства, зависящие от взаимодействия белок-вода, особенно важны для сырых продуктов из мяса птицы: извлечение (экстракция) и гидратация белков, влагоудерживающая способность, вязкость.
Термин «экстрагируемость» используется для описания того количества белка, которое освобождается или извлекается из миофибриллярной структуры в процессе обработки. При определенных внешних условиях экстрагированный мышечный белок растворим в водной фазе. Растворимость непосредственно зависит от распределения гидрофильных и гидрофобных аминокислот на поверхности молекул белка и термодинамики взаимодействий белок-вода. Экстрагируемость и растворимость мышечных белков зависят от рН, концентрации соли, вида солей и температуры.
Влагоудерживающая способность, как следует из названия, характеризует способность белкового матрикса удерживать влагу или абсорбировать добавленную воду при внешних воздействиях, таких как варка, центрифугирование и прессование. Вода может быть химически связана с белком, удерживаться за счет капиллярных сил или быть физически заключенной внутри белковой структуры. В высокоорганизованной миофибриллярной структуре белки химически связывают воду. Кроме того, вода удерживается физически в пространстве между волокнами. Влагоудерживающая способность также зависит от рН, от концентрации и вида присутствующей соли и температуры.
Вязкость, которая определяется в реологии как сопротивление течению, оказывает сильное влияние на стабильность сырого продукта перед тепловой обработкой. Вязкость мясного фарша увеличивается в процессе измельчения (куттерования), которое сопровождается набуханием мышечных волокон и абсорбцией ими воды. Экстрагированные белки, особенно крупные фибриллярные и хорошо растворимые, например миозин, могут увеличить вязкость растворов даже при очень малой концентрации. Вязкость фарша, с одной стороны, должна быть достаточно большой для обеспечения устойчивости сырого продукта, с другой стороны, не должна затруднять процессы перекачки и промежуточного накопления продукта на предприятии.
Добавление соли уменьшает электростатические взаимодействия между молекулами белка, что способствует увеличению экстрагируемости, растворимости и влагосвязывающей способности. Измельчение, или тумблирование мяса в присутствии соли приводит к разрушению мышечной ткани, способствует поглощению воды и набуханию мышечных волокон и в результате к увеличению вязкости мясного фарша. Вследствие солюбилизации и экстракции миофибриллярных белков происходит также разрушение структуры тонких и толстых нитей саркомера. Отдельные миофибриллы высвобождаются из мышечных волокон и дробятся на более короткие части. Экстрагированные белки, особенно миозин, также связывают воду и увеличивают вязкость фарша из мяса птицы, что способствует повышению устойчивости диспергированного жира. По этой причине в большинстве рецептур продуктов из мяса птицы дозировка соли составляет примерно 1,5-2,0%. Более высокая концентрация соли может увеличить влагоудерживающую способность фарша, однако это приводит к излишне соленому вкусу продукта.
На экстрагируемость, растворимость и влагоудерживающую способность мышечных белков влияет также рН фарша. В производстве продуктов из мяса птицы широко используются щелочные фосфаты, позволяющие повышать рН мясного фарша на 0,1-0,4 единиц рН, что приводит к увеличению влагосвязывающей способности мышечных белков.
В процессе переработки необходимо тщательно контролировать продолжительность и температуру измельчения для эмульсионных продуктов и тумблирования – для формованных продуктов. Избыточное измельчение или тумблирование могут привести к денатурации белка, а также к избыточному разрушению мышечных волокон и уменьшению вязкости фарша, что сопровождается снижением качества пространственной структуры белкового геля после тепловой обработки. Параметры измельчения и тумблирования должны быть подобраны таким образом, чтобы максимально увеличить степень экстракции белка, избегая при этом его денатурации.
Взаимодействие белок-жир
В грубо измельченных продуктах, таких как формованные продукты и многие колбасы, жир в основном сохраняется внутри неповрежденных жировых клеток. При их изготовлении обычно не возникает проблем, связанных с отделением жира в процессе переработки и тепловой обработки, так как он заключен внутри клеточных оболочек. Вязкость фарша и неповрежденные оболочки жировых клеток препятствуют появлению проблем, связанных с недостаточной связанностью жира.
В тонкоизмельченных эмульгированных продуктах, таких как колбасы и сосиски, жировые клетки разрушены, и жир находится в виде капель, образуя одну из фаз в эмульсиях. В эмульгированных продуктах капли жира образуют дисперсионную фазу, а непрерывная фаза состоит из воды, белков и солей. Для образования эмульсии необходима энергия, которая передается фаршу в процессе измельчения. Как правило, чем больше подводится энергии, тем меньше по размеру и многочисленнее образующиеся капли жира дисперсионной фазы фарша.
При высоких температурах и при достаточно большом поступлении энергии мембраны жировых клеток разрушаются, твердый жир плавится и эмульгируется, образуя жидкие капли. Основная часть жира птицы начинает плавиться при 13 °C, однако вследствие сложного липидного состава он плавится полностью лишь около 33 °С.
Капли жидкого жира нестабильны и со временем легко коалесцируют – маленькие жировые капли объединяются в крупные. Процесс этот крайне нежелателен, поскольку приводит к ряду дефектов качества эмульгированных продуктов. При достаточно низкой температуре жировые частицы могут находиться в частично кристаллизованном состоянии, и вероятность коалесценции в этом случае уменьшается.
Капли жидкого жира в тонкоизмельченных эмульгированных продуктах необходимо стабилизировать, чтобы избежать нежелательных изменений при переработке, перекачке и тепловой обработке. Этого можно достичь двумя способами. Во-первых, коалесценции препятствует высокая вязкость фарша. Во-вторых, наличие вокруг жировых капель белковой оболочки уменьшает межфазовое поверхностное натяжение между жиром и водой (то есть между диспергированной и непрерывной фазами) и стабилизирует капли.
Концентрация белка должна быть достаточно высокой, чтобы его молекулы могли взаимодействовать друг с другом и образовывать устойчивую непрерывную пленку на поверхности жировой капли. Общее количество растворимого белка также должно быть большим, чтобы образовать оболочки вокруг всех жировых капель. Существует еще одна причина возможной нестабильности тонкоизмельченных эмульгированных продуктов – мелкие жировые капли имеют большую площадь поверхности и для образования вокруг них стабильной белковой оболочки необходимо большее количество гидратированного белка. Миозин является главным компонентом оболочки, окружающей жировые капли, и считается, что он играет ключевую роль для обеспечения устойчивости жировых капель в процессе хранения и на ранних стадиях тепловой обработки.
Взаимодействие белок-белок
В процессе тепловой обработки взаимодействие молекул белка друг с другом приводит к формированию матрикса из белкового геля. Белковый гель образуется при нагревании в результате разворачивания и агрегирования мышечных белков, образующих прочную непрерывную поперечно связанную пространственную сеть, или матрикс. Образование непрерывной структуры белкового геля существенно влияет на текстурные и органолептические свойства, а также на выход продуктов из мяса птицы при тепловой обработке. Миофибриллярные белки образуют гель при термообработке как эмульгированных, так и формованных продуктов, и, по-видимому, гелеобразование является наиболее важным для готовых мясных продуктов, подвергаемых тепловой обработке, функциональным свойством белков. Однако на способность миофибриллярных белков образовывать прочный гель могут влиять саркоплазматические белки и соединительная ткань.
Миофибриллярные белки образуют термически необратимые гели. Это означает, что поперечная сшивка за счет химических связей, образующихся между белками в процессе нагрева, практически не изменяется при охлаждении или повторном нагреве.
Белковые гели удерживают в сетчатой структуре большое количество воды, связанной как в результате химических реакций, так и механически захваченной в ячейки. Матрикс белкового геля физически предотвращает коалесценцию жира в термообработанном мясном фарше. Под воздействием нагревания образуются также поперечные связи между белковой пленкой, окружающей жировую каплю, и непрерывным матриксом белкового геля.
В зависимости от рН и концентрации соли могут образовываться гели со структурой разного типа, что обуславливает получение продуктов с разными текстурными и влагоудерживающими свойствами. Как правило, при рН от 6 до 6,5 получаются эмульгированные продукты с максимально прочной текстурой и приемлемой упругостью. При более низких значениях рН, близких к pIмышечных белков, получаются гели с мягкой текстурой и слабой влагоудерживающей способностью, так как белки переходят в нерастворимое состояние и сильно агрегируются.
В общем случае миофибриллярные белки птицы начинают денатурировать при температуре примерно 40 °С, точка их гелеобразования достигается при температуре около 55 °С. Прочность геля и влагоудерживающая способность в процессе тепловой обработки повышаются до температуры 65-70 °С. Нагревание свыше 70 °С зачастую плохо влияет на качество гомогенизированных продуктов вследствие избыточной агрегации белка внутри сетки геля, что приводит к синерезису – отделению воды из продукта. Причиной синерезиса и выделения влаги при температурах свыше 70 °С может также быть желатинизация белка стромы – коллагена. На структуру образующегося геля и соответственно на качество готовых продуктов из мяса птицы может также влиять скорость нагрева. Считается, что при низкой скорости формируются гели с более упорядоченной структурой и соответственно с большей влагоудерживающей способностью. Например, для образования структуры белкового геля с высокой влагоудерживающей способностью сосиски с низким содержанием жира следует прогревать с меньшей скоростью, чем такой же продукт, содержащий больше жира.
Модельные системы в исследовании функциональных свойств белка
С увеличением ассортимента продуктов из мяса птицы все большую важность приобретает необходимость изменения и контроля функциональных свойств белка. Изучение этих свойств может привести к более глубокому пониманию изменений, происходящих в процессе изготовления и термообработки эмульгированных и формованных продуктов из мяса птицы. Целенаправленная модификация функциональных свойств белков может применяться в целях использования более дешевых или нетрадиционных источников мясного сырья, улучшения качества существующих продуктов и более эффективного использования немясных компонентов. Кроме того, изменение функциональных свойств белков мяса птицы позволяет снизить энергетические и технологические затраты, а также количество отходов производства.
Для исследования функциональных свойств белков мяса птицы было разработано множество различных модельных систем. Наиболее простым решением является использование определенной мышцы в тонкоизмельченном виде. Однако в такой системе зачастую бывает очень сложно выявить действительные причины и следствия из-за огромного количества составных частей и возможных взаимодействий. Поэтому в целях ограничения числа ингредиентов и снижения уровня сложности применяются более простые. Так, для установления функций белков в продуктах из мяса птицы использовались модельные системы на основе фракционированных белков, включающих в себя миофибриллы, миофибриллярные белки, солерастворимые белки, актомиозин и даже миозин.
Так как состав белков в конкретной фракции зависит от способа подготовки, то зачастую сложно сравнивать результаты, полученные в разных исследованиях модельных систем. Например, фракция солерастворимых белков состоит из смеси 15 и более белков, взаимодействующих при нагревании. Известно, что состав солерастворимой фракции может меняться в зависимости от условий экстракции и исходного материала. Таким образом, разные количества общего миозина или различное соотношение актина и миозина в солерастворимой фракции могут влиять на получаемые результаты исследований. С учетом этих факторов выбор испытательной системы следует осуществлять с особой тщательностью. При проведении исследований по разработке продукта наилучшее решение – работать с реальным продуктом или выбрать систему, как можно более близкую к нему. При проведении более фундаментальных исследований лучше начинать с упрощенной системы, например с чистого миозина, а затем переходить к более сложным, что позволит проверить, сохраняются ли закономерности, установленные для простой системы, при добавлении других компонентов.
Мышечные белки — Студопедия
Впервые А. Я. Данилевский (1881) разделил экстрагируемые из мышц белки на три класса: растворимые в воде, экстрагируемые 8 — 12% раствором хлорида аммония и белки, извлекаемые разбавленными растворами кислот и щелочей. В настоящее время белки мышечной ткани делят на три основные группы: саркоплазматические белки, миофибриллярные белки, белки стромы. На долю первых приходится около 35%, вторых —45% и третьих-20% всего мышечного белка. Эти группы белков резко отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Белки, входящие в состав саркоплазмы, принадлежат к числу протеинов, растворимых в солевых средах с низкой ионной силой.
К числу саркоплазматических белков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обменов. Недавно была открыта группа саркоплазматических белков — парвальбумины, которые способны связывать ионы кальция.
К группе миофибриллярных белков относятся миозин, актин и актомиозин — белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
|
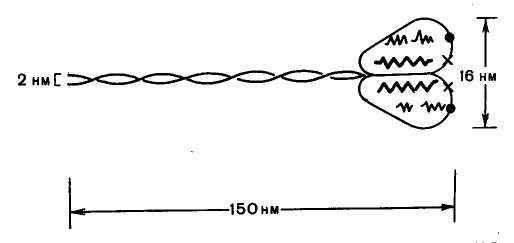
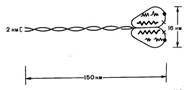
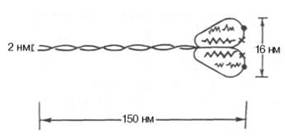
Миозинсоставляет 50-55% от сухой массы миофибрилл. Миозин обладает АТФазной активностью, т. е. способностью катализировать расщепление АТФ на АДФ и Н3РО4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи и несколько коротких легких цепей. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головку» молекулы), способную соединяться с актином. Эти головки выдаются из основного стержня молекулы.
 Толстые нити (толстые миофиламенты) в саркомере получены путем соединения большого ппчисла определенным образом ориентированных в ппппппппппппппппппппппппппппппппппппространстве молекул миозина.
Толстые нити (толстые миофиламенты) в саркомере получены путем соединения большого ппчисла определенным образом ориентированных в ппппппппппппппппппппппппппппппппппппространстве молекул миозина.
Актин,составляющий ~20% от сухой массы миофибрилл. Известны две формы актина: глобулярный (Г-актин) и фибриллярный (Ф-актин) актин. Молекула Г-актина состоит из одной полипептидной цепочки, в образовании которой принимают участие 374 аминокислотных остатка. Ф-актин является продуктом полимеризации Г-актина и имеет структуру двухцепочечной спирали.
Актомиозинобразуется при соединении миозина с Ф-актином. Актомиозин, как обладает АТФазной активностью. Однако АТФазная активность актомиозина отличается от АТФазной активности миозина. Фермент актомиозин активируется ионами магния и ингибируется этилен-диаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2 +, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
Тропомиозинбыл открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня. На долю тропомиозина приходится около 4 — 7% всех белков миофибрилл.

 Тропонин — глобулярный белок, открытый С. Эбаси в 1963 г. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, Тн-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция.
Тропонин — глобулярный белок, открытый С. Эбаси в 1963 г. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, Тн-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция.
Белки стромы в поперечнополосатой мускулатуре представлены в основном коллагеном и эластином.
МЫШЕЧНЫЕ БЕЛКИ — Студопедия
САРКОПЛАЗМАТИЧЕСКИЕ БЕЛКИ:протеины, растворимые в солевых средах с низкой ионной силой
1)дыхательный пигмент миоглобин
2)разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена
3)парвальбумины, которые способны связывать ионы Са2+.
МИОФИБРИЛЛЯРНЫЕ БЕЛКИ:белки, растворимые в солевых средах с высокой ионной силой
1) Миозин-составляет 50–55% от сухой массы миофибрилл. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи (Н) с мол. массой 205000–210000 и несколько коротких легких цепей (L,)мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы).Эти «головки» выдаются из основного стержня молекулы. «Головка» миозина имеет сайт связывания с актином и сайт связывания АТФ. Количество легких цепей в молекуле миозина у различных видов животных и в разных типах мышц неодинаково. По количеству «головок» миозины делятся на «традиционные» (convention myosin)- 2 головки, и нетрадиционные (unconvention myosin) — одна «головка». Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные — не могут.
При расщеплении кратковременным действием трипсина образуются два фрагмента, к-рые наз. легким и тяжелым меромиозинами (обозначаются соотв. LMM и НММ). LMM представляет собой фрагмент стержневой части молекулы М. длиной ок. 80 нм и с мол.м. 150 тыс. НММ содержит головку М. и часть хвоста, его длина 60-70 нм, мол. м. ок. 340 тыс.
2) Актин.Две формы актина:
· глобулярный актин (G-актин)
· фибриллярный актин (F-актин).
Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полиме-ризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой
3) Актомиозин-образуется при соединении миозина с F-актином. Ак-томиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ.
Регуляторные белки:
1) Тропомиозин-состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл.
2) Тропонин- составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+
БЕЛКИ СТРОМЫ:
1) Коллаген
2) Эластин
НЕБЕЛКОВЫЕ АЗОТИСТЫЕ ЭКСТРАКТИВНЫЕ ВЕЩЕСТВА:
1) адениновые нуклеотиды (АТФ, АДФ и АМФ)
2) нуклеотиды неаде-нинового ряда
3) 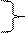
 креатинфосфат
креатинфосфат
4) креатин
5)
|
6) 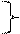 карнозин
карнозин
7) ансерин
8) свободные аминокислоты: глутаминовая кислота, глутамин
9) мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин – встречаются в мышечной ткани в небольшом количестве и, как правило, являются либо промежуточными, либо конечными продуктами азотистого обмена.
БЕЗАЗОТИСТЫЕ ВЕЩЕСТВА:
1) Гликоген-концентрация колеблется от 0,3 до 2% и выше
2) Глюкоза, гексозофосфаты- следовые количества
Химический состав мышечной ткани — Студопедия
В мышечной ткани человека содержится 72–80% воды и 20–28% сухого остатка от массы мышцы. Вода входит в состав большинства клеточных структур и служит растворителем для многих веществ. Большую часть сухого остатка образуют белки и другие органические соединения (табл. 2).
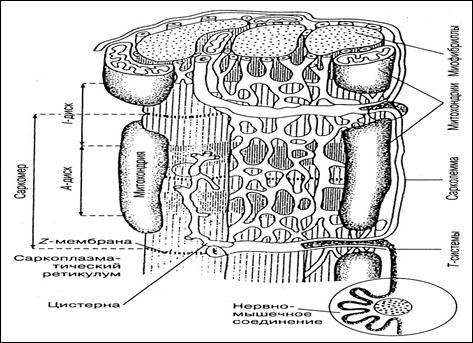
Рис. 4. Схема расположения Т-систем и саркоплазматического
ретикулума в мышечном волокне
Таблица 2
Химический состав скелетных мышц млекопитающих
| Компонент | % на сырую массу | Компонент | % на сырую массу |
| Вода | 72–80 | АТФ | 0,25–0,40 |
| Сухой остаток: | 20–28 | карнозин | 0,20–0,30 |
| белки | 16,50–20,90 | карнитин | 0,02–0,05 |
| гликоген | 0,30–3,00 | ансерин | 0,09–0,15 |
| фосфолипиды | 0,40–1,00 | свободные аминокислоты | 0,10–0,70 |
| холестерин | 0,06–0,20 | молочная кислота | 0,01–0,02 |
| креатинфосфат | 0,20–0,55 | зола | 1,00–1,50 |
| креатин | 0,003–0,005 |
Основные белки мышц
Среди белков мышечной ткани выделяют три основные группы: саркоплазматические белки, на долю которых приходится около 35%, миофибриллярные белки, составляющие около 45%, и белки стромы, количество которых достигает 20%.
Саркоплазматические белки растворимы в воде и слабых солевых растворах. Основную массу их составляют белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы окислительного фосфорилирования, а также многие ферменты гликолиза, азотистого и липидного обменов, находящиеся в саркоплазме. К этой группе относится также белок миоглобин, который связывает кислород с большим сродством, чем гемоглобин, и депонирует молекулярный кислород в мышцах. В последнее время открыта группа саркоплазматических белков парвальбуминов, которые способны связывать ионы кальция, однако их физиологическая роль остается не выясненой.
Миофибриллярные белки включают сократительные белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин, тропонин, α- и β-актинины. Миофибриллярные белки обеспечивают сократительную функцию мышц.
Миозин является одним из основных сократительных белков мышц и составляет около 55% общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл. Молекулярная масса этого белка – около 470 000. В молекуле миозина различают длинную фибриллярную часть и глобулярные структуры (головки). Фибриллярная часть молекулы миозина имеет двуспиральную структуру (рис. 5).
В составе молекулы выделяют шесть субъединиц: две тяжелые полипептидные цепи (молекулярная масса 200 000) и четыре легкие цепи (молекулярная масса 1500–2700), расположенные в глобулярной части. Основной функцией фибриллярной части молекулы миозина является способность образовывать хорошо упорядоченные пучки миозиновых филаментов или толстые протофибриллы (см. рис. 5). На головках молекулы миозина расположены активный центр АТФ-азы и актинсвязывающий центр, поэтому они обеспечивают гидролиз АТФ и взаимодействие с актиновыми филаментами.
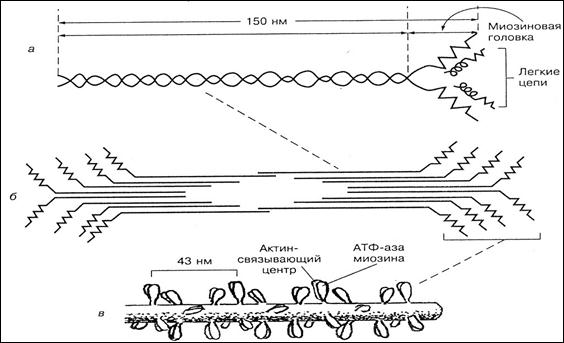
Рис. 5. Схема строения молекулы миозина (а), миозинового пучка (б)
и миозиновой толстой нити (в)
Молекула миозина содержит значительное количество глутаминовой аминокислоты и имеет большой отрицательный заряд, что усиливает связывание свободных ионов Са2+ и Мg2+. В присутствии ионов Са2+ повышается АТФ-азная активность миозина и скорость гидролиза АТФ согласно уравнению
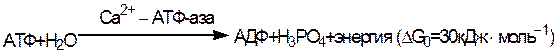
Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, используется для изменения конформации белка миозина и генерации напряжения между толстыми и тонкими нитями миозина в сокращающейся мышце. Посредством ионов Mg2+ миозин способен присоединять молекулы АТФ и АДФ, а также взаимодействовать с молекулами актина, находящимися в составе тонких нитей миофибрилл.
Актин – второй сократительный белок мышц, который составляет основу тонких нитей (рис. 6). Известны две его формы – глобулярный G-актин и фибриллярный F-актин. Глобулярный актин – это шарообразный белок с молекулярной массой 42 000. На его долю приходится около 25% общей массы мышечного белка.
В присутствии Мg2+ актин подвергается нековалентной полимеризации с образованием нерастворимого филамента в виде спирали, получившего название F-актин. Обе формы актина не обладают ферментативной активностью. Каждая молекула G-актина способна связывать один ион Ca2+, который играет важную роль в инициировании сокращения. Кроме того, молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ G-актином обычно сопровождается его полимеризацией с образованием F-актина и одновременным расщеплением АТФ до АДФ и фосфата. АДФ остается связанной с фибриллярным актином. Процесс полимеризации актина можно описать следующим уравнением:
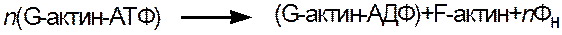
F-актин активирует АТФ-азу миозина, что создает движущую силу процессу сокращения.
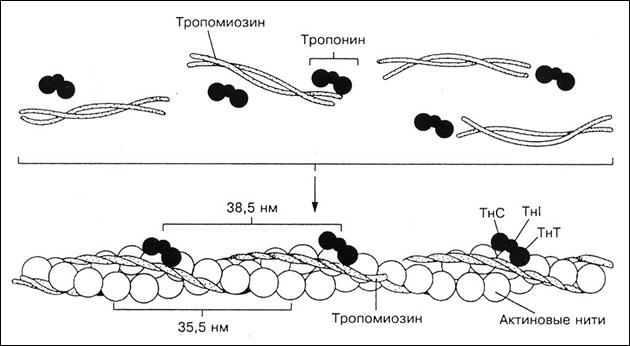
Рис. 6. Схема строения актиновой, или тонкой нити
Актин способен взаимодействовать с миозином, образуя актомиозиновый комплекс. Молярное соотношение актина и миозина в актомиозиновом комплексе – примерно 1:1. Нить F-актина может связывать большое число молекул миозина. Существенным свойством актомиозинового комплекса является диссоциация его в присутствии АТФ и Мg2+.
В состав тонких нитей наряду с актином входят и другие минорные белки – тропомиозин, тропонины, актинины.
Тропомиозин (Тм) – это структурный белок актиновой нити, представляющий собой вытянутую в виде тяжа молекулу. Две его полипептидные цепи как бы обвивают актиновые нити (см. рис. 6). На концах каждой молекулы тропомиозина расположены белки тропониновой системы, наличие которой характерно только для поперечно-полосатых мышц.
Тропонин (Тн) является регуляторным белком актиновой нити. Он состоит из трех субъединиц – ТнТ, ТнI и ТнС. Тропонин Т(ТнТ) обеспечивает связывание этих белков с тропомиозином. Тропонин I (ТнI) блокирует (ингибирует) взаимодействие актина с миозином.
Тропонин С (ТнС) – это Са2+— связывающий белок, структура и функции которого подобны широко распространенному в природе белку кальмодулину. Тропонин С, как и кальмодулин, связывает четыре иона Са2+ на молекулу белка и имеет молекулярную массу 17 000. В присутствии Са2+ изменяется конформация тропонина С, что приводит к изменению положения Тн по отношению к актину, в результате чего открывается центр взаимодействия актина с миозином.
Таким образом, тонкий филамент миофибриллы поперечно-полосатой мышцы состоит из F-актина, тропомиозина и трех тропониновых компонентов – ТнС, ТнI и ТнТ. Кроме этих белков, в мышечном сокращении участвует белок актинин. Обнаруживается он в зоне Z-линии, к которой крепятся концы F-актиновых молекул тонких нитей миофибрилл.
Белки мышечной стромы в скелетной мышце представлены в основном коллагеном и эластином, которые входят в состав сарколеммы и Z-линий миофибрилл. Эти белки обладают эластичностью, большой упругостью, что имеет существенное значение для процесса сокращения и расслабления мышцы.
Небелковые компоненты мышц
В состав сухого остатка мышц наряду с белками входят и другие вещества, среди которых выделяют азотсодержащие, безазотистые экстративные вещества и минеральные вещества.
К азотсодержащим веществам скелетных мышц относятся АТФ и продукты ее расщепления – АДФ и АМФ, а также креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др.
АТФ, содержащаяся в количестве 0,25-0,40%, и креатинфосфат, количество которого колеблется в пределах 0,4-1,0%, являются источниками энергии мышечного сокращения. Продукты их распада – АДФ, АМФ и креатин – оказывают регулирующее действие на обмен веществ в мышцах. Карнозин является дипептидом и участвует в переносе фосфатных групп, стимулирует работу ионных насосов, увеличивает амплитуду мышечного сокращения, которые снижаются при утомлении и этим способствуют восстановлению работоспособности. Карнитин участвует в переносе жирных кислот – важных энергетических источников – через мембраны митохондрий и тем самым способствует их окислению и энергообразованию.
В состав различных клеточных мембран мышечной ткани входит ряд азотсодержащих фосфолипидов: фосфатидилхолин (лецитин), фосфатидилэтаноламин (кефалин), фосфатидилсерин и др. фосфолипиды участвуют в обменных процессах, являясь поставщиками холина и жирных кислот – субстратов тканевого дыхания. Другие азотсодержащие вещества – мочевина, мочевая кислота, пуриновые основания (аденин, гуанин) – являются промежуточными или конечными продуктами азотистого обмена и встречаются в мышцах в небольших количествах.
К безазотистым соединениям мышечной ткани относится гликоген, который находится в саркоплазме в свободном или связанном с белками состоянии и используется в мышцах как основной энергетический субстрат при напряженной работе. Количество его в зависимости от пищевого рациона питания и степени тренированности колеблется от 0,3 до 3,0% общей массы мышц. При тренировке увеличивается главным образом количество свободного гликогена.
В мышце содержится ряд промежуточных продуктов обмена углеводов – гексозофосфаты, пировиноградная и молочная кислоты.
Из липидов в мышечной ткани обнаруживаются триглицериды в виде капелек жира, а также холестерин.
Минеральные вещества составляют 1–1,5% общей массы мышцы. Состав их разнообразен. Основными катионами являются Na+, К+, Mg2+, Са2+. Катионы К+ сосредоточены в основном внутри мышечных волокон, а Na+ – преимущественно в межклеточной жидкости. Они участвуют в процессах возбуждения мышц, запуске их сокращения. Среди анионов преобладают Сl–, Н2РО4–, НРО42–, SO42–, НСО3–.
В мышечной ткани содержится ряд микроэлементов: кобальт, железо, никель, бор, цинк и др. Они являются либо структурными компонентами сложных белковых молекул, либо активаторами ферментов. Все минеральные вещества играют важную роль в регуляции различных биохимических процессов в мышцах.
белка | Определение, структура и классификация
Белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую пищевую ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19-го века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году придумал термин белок , слово, производное от греческого prōteios , что означает «занимать первое место».«Белки являются видоспецифичными; белки одного вида отличаются от белков другого вида. Они также специфичны для органов; Например, в одном организме мышечные белки отличаются от белков мозга и печени.
синтез белка Синтез белка. Encyclopædia Britannica, Inc.Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями.Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для дальнейшего использования у животных. Когда животное потребляет избыточные белки, они превращаются в жиры (глюкоза или триглицериды) и используются для снабжения энергией или создания энергетических резервов. Если животное не потребляет достаточного количества белка, организм начинает разрушать богатые белком ткани, такие как мышцы, что приводит к истощению мышц и в конечном итоге к смерти, если дефицит серьезный.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной деятельности. Белковые ферменты катализируют подавляющее большинство химических реакций, которые происходят в клетке. Белки обеспечивают многие структурные элементы клетки, и они помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных вместе для образования длинных цепей, подобно тому, как шарики расположены на веревочке. Есть около 20 различных аминокислот, которые встречаются в природе в белках. Белки схожей функции имеют сходный аминокислотный состав и последовательность. Хотя до сих пор невозможно объяснить все функции белка по его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, составляющих белки.
пептид Молекулярная структура пептида (небольшой белок) состоит из последовательности аминокислот. © raimund14 / FotoliaРастения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе во время процесса фотосинтеза с образованием органических соединений, таких как углеводы.Животные, однако, должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений низкое, животным требуются очень большие количества растительного материала, такие как жвачные животные (например, коровы), которые едят только растительный материал, чтобы удовлетворить свои потребности в аминокислотах. Животные, не являющиеся жвачными, включая людей, получают белки главным образом от животных и их продуктов, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белками ( см. питание человека).
бобовых; аминокислота Бобовые, такие как бобы, чечевица и горох, содержат много белка и содержат много незаменимых аминокислот. © Elenathewise / FotoliaСодержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных намного меньше, чем количество белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняВысокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые из наиболее важных белков, таких как ферменты и гормоны, встречаются в очень небольших количествах. Важность белков связана главным образом с их функцией. Все идентифицированные до настоящего времени ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни — белки, нуклеиновые кислоты, углеводы и липиды — чтобы превращать их в другие вещества и разлагать их.Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями. У всех позвоночных гемоглобин дыхательного белка действует как переносчик кислорода в крови, транспортируя кислород из легких в органы и ткани организма. Большая группа структурных белков поддерживает и защищает структуру организма животного.
гемоглобин Гемоглобин представляет собой белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ).Каждая цепь присоединена к гемовой группе, состоящей из порфирина (органического кольцеобразного соединения), присоединенного к атому железа. Эти железо-порфириновые комплексы обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в транспорте кислорода в крови. Encyclopædia Britannica, Inc. .6 лучших добавок для наращивания мышечной массы
Если вы регулярно занимаетесь спортом, вам наверняка захочется быть уверенным, что вы получите от этого максимум пользы.
Одним из важных преимуществ упражнений является наращивание мышечной массы и силы. Наличие здорового количества мышц позволяет вам делать все возможное во время упражнений и повседневной жизни.
Для максимального прироста мышц должны быть соблюдены три основных критерия: есть больше калорий, чем вы сжигаете, потреблять больше белка, чем разрушаете, и программа упражнений, которая бросает вызов вашим мышцам (1, 2, 3).
Несмотря на то, что все эти критерии можно выполнить, не принимая пищевых добавок, некоторые добавки могут помочь вам достичь ваших целей.
6 добавок, перечисленных ниже, могут помочь вам увеличить мышечную массу с помощью программы упражнений.
Креатин — это молекула, которая естественным образом вырабатывается в вашем организме. Это обеспечивает энергию для ваших мышц и других тканей.
Однако, принимая его в качестве пищевой добавки, можно увеличить содержание креатина в мышцах до 40% по сравнению с его нормальным уровнем (4, 5, 6).
Это влияет на ваши мышечные клетки и производительность упражнений, способствуя увеличению мышечной массы. Фактически, большое количество исследований показывает, что креатин улучшает мышечную силу (7, 8, 9).
Это хорошая новость, если вы пытаетесь нарастить мышечную массу. Большая сила позволяет вам лучше выполнять во время упражнений, что приводит к увеличению мышечной массы с течением времени (10).
Креатин также может увеличить содержание воды в мышечных клетках. Это может привести к тому, что ваши мышечные клетки будут слегка набухать и генерировать сигналы для роста мышц (11).
Кроме того, эта добавка может повышать уровень гормонов, участвующих в росте мышц, таких как IGF-1 (12).
Более того, некоторые исследования показывают, что креатин может уменьшить распад белков в мышцах (13).
В целом, многие исследователи изучали креатиновые добавки и упражнения, и ясно одно — креатин может помочь увеличить мышечную массу (14, 15).
Креатин также был тщательно изучен и обладает выдающимся профилем безопасности (14).
Если вы ищете добавку, которая поможет вам набрать мышечную массу, сначала подумайте о креатине.
Интернет-магазин креатиновых добавок.
Резюме: Креатин, пожалуй, лучшая добавка для увеличения мышечной массы. Многие исследования подтвердили, что это может помочь увеличить мышечную массу.
Получение достаточного количества белка имеет решающее значение для наращивания мышечной массы.
В частности, чтобы нарастить мышечную массу, вам нужно потреблять больше белка, чем ваш организм разрушает в результате естественных процессов (16).
Несмотря на то, что из продуктов, богатых белком, можно получить весь необходимый белок, некоторые люди изо всех сил пытаются это сделать.
Если это звучит как вы, вы можете рассмотреть вопрос о принятии белковой добавки.
Существует много различных белковых добавок, но некоторые из самых популярных — сывороточный, казеин и соевый белок. Другие белковые добавки содержат белок, выделенный из яиц, говядины, курицы или других источников (17).
Исследования показывают, что добавление дополнительного белка с помощью добавок вызывает увеличение мышечной массы у людей, которые занимаются спортом, чем добавление дополнительных углеводов (18, 19, 20).
Тем не менее, эффекты, вероятно, являются самыми большими для людей, которые не получают достаточно белка в своей обычной диете.
Фактически, некоторые исследования показывают, что употребление очень большого количества белковых добавок не помогает увеличить мышечную массу, если вы уже придерживаетесь диеты с высоким содержанием белка (21, 22, 23, 24).
Многие люди задаются вопросом, сколько белка есть ежедневно. Если вы активный человек, пытающийся нарастить мышечную массу, лучше всего подойдет 0,5–0,9 г белка на фунт (1,2–2,0 г на кг) массы тела (25, 26, 27).
Интернет-магазин белковых добавок.
Резюме: Потребление достаточного количества белка абсолютно необходимо для оптимального наращивания мышечной массы. Однако, если вы получаете достаточно белка в своем рационе, принимать белковые добавки не нужно.
Гейнеры — это добавки, разработанные для того, чтобы помочь вам получить больше калорий и белка. Они, как правило, используются людьми, которые пытаются нарастить мышечную массу.
Некоторым людям трудно нарастить мышечную массу, даже когда они потребляют большое количество калорий и поднимают вес (28).
Несмотря на то, что содержание калорий в добавках для набора веса варьируется, они нередко содержат более 1000 калорий на порцию.
Многие думают, что эти калории происходят из белка, так как это очень важно для наращивания мышечной массы. Тем не менее, большинство калорий на самом деле поступают из углеводов.
В одной порции этих высококалорийных добавок часто содержится 75–300 г углеводов и 20–60 г белка.
Хотя эти продукты могут помочь вам потреблять больше калорий, важно понимать, что в добавках для увеличения веса нет ничего волшебного.
Некоторые исследования среди физически неактивных взрослых показали, что резкое увеличение калорий может увеличить мышечную массу, например, мышц, если вы потребляете достаточно белка (29).
Тем не менее, исследования среди взрослых, которые тренировали вес, показали, что потребление добавки для увеличения веса может быть неэффективным для увеличения мышечной массы (28).
В целом, гейнеры рекомендуются только в том случае, если вы изо всех сил пытаетесь съесть достаточно пищи, и вам легче выпить коктейль для гейнеров, чем есть больше настоящей пищи.
Интернет-магазин добавок для набора веса.
Резюме: Гейнеры являются высококалорийными продуктами, разработанными, чтобы помочь вам потреблять больше калорий и белка. Тем не менее, они рекомендуются, только если вы изо всех сил пытаетесь получить достаточно калорий из пищи.
Бета-аланин — это аминокислота, которая снижает утомляемость и может повысить работоспособность (30, 31).
Кроме того, бета-аланин может помочь увеличить мышечную массу, если вы следуете программе упражнений.
Одно исследование показало, что прием 4 г бета-аланина в день в течение восьми недель увеличивал мышечную массу тела больше, чем плацебо у борцов колледжа и футболистов (32).
В другом исследовании сообщалось, что добавление бета-аланиновой добавки в шестинедельную высокоинтенсивную программу интервальных тренировок увеличило мышечную массу примерно на 1 фунт (0,45 кг) больше, чем плацебо (33).
Несмотря на то, что необходимы дополнительные исследования бета-аланина и мышечной массы, эта добавка может помочь поддержать мышечную массу в сочетании с программой упражнений.
Интернет-магазин бета-аланиновых добавок.
Резюме: Бета-аланин — это аминокислота, которая может улучшить физическую работоспособность.Некоторые данные показывают, что это также может помочь увеличить мышечную массу в ответ на физические упражнения, но требуется больше информации.
Аминокислоты с разветвленной цепью (BCAA) состоят из трех отдельных аминокислот: лейцина, изолейцина и валина.
Они встречаются в большинстве источников белка, особенно животного происхождения, таких как мясо, птица, яйца, молочные продукты и рыба.
BCAA критически важны для роста мышц и составляют около 14% аминокислот в мышцах (34, 35).
Каждый человек потребляет BCAA из пищи каждый день, но также очень популярно принимать BCAA в качестве добавки.
Небольшое количество исследований показало, что BCAA могут улучшать мышечную массу или уменьшать мышечную потерю по сравнению с плацебо (36, 37).
Тем не менее, другие исследования показывают, что BCAA могут не приводить к увеличению мышечной массы у тех, кто следует программе упражнений (38).
Вполне вероятно, что добавки BCAA могут принести вам пользу только в том случае, если вы не употребляете достаточное количество высококачественного белка в своем рационе.
Хотя они могут быть полезны, если ваша диета неадекватна, требуется больше информации, прежде чем BCAA будут рекомендованы в качестве дополнительного дополнения для наращивания мышечной массы.
Магазин для дополнений BCAA онлайн.
Резюме: Аминокислоты с разветвленной цепью важны для роста мышц. Они содержатся во многих продуктах, и неясно, полезно ли принимать их в качестве добавки, когда вы уже потребляете достаточно белка.
Бета-гидрокси бета-метилбутират (HMB) — это молекула, которая вырабатывается, когда ваш организм перерабатывает аминокислоту лейцин.
HMB отвечает за некоторые полезные эффекты белка и лейцина в рационе (39).
Это может быть особенно важно для уменьшения распада мышечных белков (40).
Хотя HMB естественным образом вырабатывается вашим организмом, использование его в качестве добавки позволяет повысить его уровень и может принести пользу вашим мышцам (40, 41).
Несколько исследований, проведенных на ранее не обученных взрослых, показали, что прием 3–6 граммов ГМБ в день может улучшить прирост мышечной массы тела от силовых тренировок (42, 43, 44).
Однако другие исследования показывают, что аналогичные дозы ГМБ, вероятно, не эффективны для увеличения мышечной массы у взрослых с опытом силовых тренировок (45, 46, 47).
Это может означать, что HMB наиболее эффективен для тех, кто начинает заниматься физическими упражнениями или увеличивает интенсивность своих тренировок.
Магазин для дополнения HMB онлайн.
Резюме: HMB может помочь увеличить мышечную массу у тех, кто начинает программу тренировок с отягощениями, но, по-видимому, она менее эффективна для людей с опытом тренировок.
Некоторые другие добавки утверждают, чтобы увеличить мышечную массу. К ним относятся конъюгированная линолевая кислота, бустеры тестостерона, глютамин и карнитин.
Однако доказательства неоднозначны.
- Конъюгированная линолевая кислота (CLA): CLA относится к группе омега-6 жирных кислот, которые оказывают несколько воздействий на организм. Исследования CLA для увеличения мышечной массы дали неоднозначные результаты, и неясно, является ли это полезным (48, 49, 50, 51).
- Усилители тестостерона: Добавки, повышающие уровень тестостерона, включают D-аспарагиновую кислоту, Tribulus Terrestris, пажитник, DHEA и ашвагандху.Вероятно, эти соединения приносят пользу только тем, у кого низкий уровень тестостерона (52, 53, 54, 55, 56).
- Глютамин и карнитин: Они, вероятно, не эффективны для увеличения мышечной массы у молодых людей или людей среднего возраста. Тем не менее, исследования показали, что карнитин может иметь некоторые преимущества для мышечной массы у пожилых людей (57, 58, 59, 60).
Резюме: Многие виды добавок утверждают, что увеличивают мышечную массу, но мало доказательств того, что они эффективны для здоровых, активных людей.
Добавки не могут дать вам максимальный прирост мышц, если ваши программы питания и физических упражнений отсутствуют.
Чтобы нарастить мышечную массу, вам нужно съесть достаточно калорий и белка, а также упражнения, в идеале с гирями. После того, как ваше питание и физические упражнения будут проверены, вы можете рассмотреть вопрос о пищевых добавках.
Креатин и белковые добавки, вероятно, являются наиболее эффективным выбором для наращивания мышечной массы, но другие добавки могут быть полезны для определенных людей.
лучших протеиновых порошков на рынке
Протеиновые порошки являются самой продаваемой добавкой на рынке сегодня. В конце концов, для наращивания мышечной массы требуется много белка, а порошок — это удобный способ получить дополнительный белок, который вам нужен, особенно когда он вам нужен больше всего — во время тренировок. Исследование за исследованием подтверждает, что использование белковых порошков, особенно содержащих сыворотку, наряду с программой силовых тренировок, способствует росту мышц и увеличению силы.
Но если вы собираетесь бросать бумагу на продукт, вам нужно быть более проницательным.Любой протеиновый порошок, стоящий в кувшине, содержит три ключевых компонента: сыворотку, лейцин и пищеварительные ферменты. Вы можете научиться быть ястребом-лейблом с информацией, которая следует ниже, но мы также предоставим вам несколько быстрых выборов, если вы предпочитаете отгадывать догадки.
Существует много типов протеинов, из которых можно выбирать, и у всех есть свои преимущества, но сыворотка — бесспорный король протеинов для поклонников физкультурно-ориентированного спорта. Он быстро усваивается, что означает, что вы будете получать столь необходимую дозу составляющих его аминокислот в спешке.Это увеличивает ваш уровень синтеза белка (читай: наращивание мышечной массы), что делает его легкой задачей для отслеживания ваших достижений. В качестве бонуса, сыворотка улучшает кровоток, помогая вам получить больше аминокислот, куда они должны идти. Одно исследование показало, что у тех, кто принимал сыворотку в течение 14 недель, мышечный рост был на 25 процентов больше, чем в группе, которая воздерживалась от этого. О да … сыворотка также поддерживает состав тела. Двенадцать недель приема сыворотки — по два коктейля в день — помогли одной тестируемой группе сбросить в среднем пять фунтов жира и дюйм на талии.
Ежедневное потребление белка, составляющее примерно 1-1,5 грамма на фунт веса тела в день, особенно когда его получают из сыворотки, приводит к значительному увеличению мышечной массы и силы. Три лучшие формы сыворотки доступны: сывороточный концентрат, сывороточный изолят (который является более чистым белком) и сывороточный гидролизат, который является самой чистой формой белка, доступной на рынке сегодня.
лейцин
Исследования подтверждают, что лейцин действует как критический переключатель, который включает синтез мышечного белка, что приводит к наращиванию мышц.Учись, чмуды, говоришь? Хорошо, учтите, что данные показали, что добавление лейцина к протеиновому напитку во время упражнений увеличивает синтез мышечного белка более чем на 30%. Думаете, что 30 процентов могут сделать что-нибудь для ваших отстающих глаз?
Почему лейцин чудесный суп? Отбросив какой-нибудь необычный лабораторный халат, говоривший о вас, лейцин активирует комплекс, называемый mTOR, который активизирует синтез белка, помогая вам быстрее и полнее восстановиться, чем в жизни без лейцина. Лейцин также увеличивает выделение инсулина, что делает его особенно важным после тренировки, когда этот эффект заставляет больше аминокислот и питательных веществ сокращать мышцы живота.
Потребление лейцина помогает гарантировать, что больше аминокислот из сыворотки будет использовано для наращивания мышечной массы.
пищеварительных ферментов
Когда вы вкладываете средства в протеиновую добавку, вы хотите быть уверенным, что все идет туда, куда нужно. Некоторые продукты труднее усваиваются, чем другие, что означает неполное усвоение аминокислот, необходимых для роста мышц. Некоторые производители осознали этот факт и добавили в смесь пищеварительные ферменты, такие как протеазы, пептидазы, пепсин, трипсин, химотрипсин, бромелайн, папаин и ферменты, чтобы обеспечить более эффективную доставку.Это помогает гарантировать, что вы тратите меньше своего протеинового порошка. Меньше отходов приводит к большему росту и лучшему общему результату.
Добавки
GNC Pro Performance AMP Усиленный Wheybolic Extreme 60
Оптимальное питание Hydrowhey
Арнольд Сериал Железная Сыворотка
MuscleTech Essential Series 100% платина
BPI Whey-HD
,Когда дело доходит до увеличения размера мышц или определения мышц, вам, вероятно, сказали, что поднятие тяжестей разрушает мышцу, которая затем становится сильнее или больше в результате процесса восстановления. Но действительно ли это правда или просто еще один из распространенных спортивных мифов, который передается от более опытных ветеранов новичкам?
Ну, в отличие от многих распространенных мифов о спортзале, это утверждение на самом деле основано на том, что тренировки с отягощениями до утомления действительно вызывают повреждение мышц.В частности, это повреждение происходит с белками, которые включают мышечные волокна. Мышцы представляют собой пучки отдельных волокон, обернутых в фасции и соединительную ткань. Наименьшими компонентами мышечных волокон являются микрофиламенты из актина и миозина. Теория скользящей нити предполагает, что актин и миозин перекрываются и что, когда они получают сигнал от центральной нервной системы, чтобы сжиматься, они скользят друг через друга, создавая усиливающее, сокращающее мышцы действие.
Существует два типа перегрузки, которые могут стимулировать рост мышц: метаболический и механический.Метаболическая перегрузка относится к количеству работы, которую выполняет мышца, которая истощает ее доступного запаса энергии. Поскольку мышцы постоянно тренируются до утомления, мышечные клетки приспосабливаются, чтобы удерживать больше гликогена в качестве топлива. Поскольку 1 грамм гликогена может удерживать до 3 грамм воды, когда мышца накапливает больше гликогена, она может увеличиваться в размерах благодаря дополнительному гликогену и присоединенной воде.
Механическая перегрузка относится к структурному повреждению, которое происходит с нитями актин-миозинового белка в результате напряженных упражнений, таких как тяжелая атлетика или взрывная плиометрика.Повреждение мышц инициирует процесс восстановления, при котором определенные гормоны вместе с белком макронутриентов синтезируют новые сателлитные клетки, которые используются для восстановления поврежденных мышечных волокон. Другими словами, роль белка состоит в том, чтобы помочь восстановить ткани, поврежденные физическими упражнениями.
Читайте дальше, чтобы узнать о девяти вещах о роли белка в поддержании организма во время и после тренировок.
- В организме человека белки являются основными структурными компонентами клеток и выполняют несколько различных функций.Основная функция белка, потребляемого в рационе, заключается в создании и восстановлении клеток, в том числе мышечных клеток, поврежденных при физических нагрузках до момента кратковременной усталости. ( Примечание: Отказ не завершает повторение; усталость не в состоянии выполнять другое повторение.) Дополнительные роли, которые белки питания играют в организме, включают транспортировку клеток, служащих ферментами для поддержки различных физиологических функций и действующих в качестве гормонов.
- Хотя основная роль белка заключается в восстановлении поврежденных тканей, его также можно использовать для выработки энергии для сокращения мышц, когда другие источники аденозинтрифосфата (АТФ, клеточная форма энергии), а именно жиры и углеводы, недоступны.Глюконеогенез — это термин, который описывает, как белок превращается в гликоген для АТФ. Тем не менее, это происходит только в результате средней или высокой интенсивности в течение длительного периода времени. Спортивные напитки содержат сахар и натрий, которые помогают поддерживать уровень гликогена во избежание глюконеогенеза, экономя белки, поэтому их можно использовать для восстановления тканей после тренировки. Другой вариант — ограничить высокоинтенсивную активность до 45-50 минут, чтобы обеспечить достаточный запас гликогена во время тренировки.
- Аминокислоты являются строительными блоками белка. (Примечание: Для записи «амино» означает «содержащий азот».) Есть 20 аминокислот. Четыре считаются несущественными, потому что организм может производить их, и девять необходимы, потому что они не могут быть произведены в организме и должны потребляться в рационе. Восемь аминокислот считаются условными, потому что они могут стать незаменимыми и должны потребляться в рационе. Прием аминокислот до и во время тренировки в сочетании с восстановительной закуской после тренировки или едой, содержащей белок, может увеличить синтез мышечного белка.Применение различных стратегий восстановления после тренировки может позволить вашим клиентам тренироваться с большим объемом, чтобы достичь определенной силы или производительности. Протеин
- обеспечивает около 4 калорий энергии на грамм, и когда белок потребляется как часть хорошо сбалансированной диеты, он может помочь обеспечить чувство сытости или сытости. Это, в свою очередь, может уменьшить чувство голода, которое может привести к потреблению слишком большого количества калорий. Кроме того, белок дороже энергии, а это значит, что он требует больше энергии в процессе пищеварения по сравнению с углеводами и жирами.
- Организм постоянно строит новые клетки, чтобы заменить старые, и аминокислоты, потребляемые в рационе, поддерживают этот процесс. Рекомендации по питанию для потребления белка для среднего здорового взрослого человека составляют 0,8-0 г белка на килограмм веса тела (0,4-0,5 г на фунт). Рекомендованная суточная доза для человека, который много тренируется на аэробную выносливость, составляет 1,0-1,6 г / кг массы тела (0,5-0,7 г / фунт). Для тех, кто много силовых тренировок, потребляет 1.4-1,7 г / кг массы тела (0,6-0,8 г / фунт) будут поддерживать синтез мышечного белка. Например, активный 170-килограммовый мужчина, который тренируется с интенсивностью от умеренной до энергичной большую часть дня в неделю, должен потреблять приблизительно 70-170 граммов белка в день.
- Белок должен составлять 15-30% от ежедневного потребления калорий в зависимости от уровня активности. В те дни, когда активность выше интенсивности, следует употреблять больше белка.
- Для людей, заинтересованных в росте мышц, рекомендуется употреблять продукты с высоким содержанием белка, такие как нежирное мясо, рыба, яйца, курица или молоко.Соя является единственной формой растительного белка, которая содержит все восемь незаменимых аминокислот. Хотя потребление белка важно для роста мышц, потребление слишком большого количества белка, хотя и не обязательно опасного, просто приведет к тому, что организм будет выводить его с мочой.
- Белок следует употреблять в течение дня, а не за один прием пищи. Например, вышеупомянутому активному мужчине весом 170 фунтов было бы разумно потреблять 20-40 граммов белка за один раз, распределенных между трехразовым питанием и двумя закусками.
- Из белка, хранящегося в организме, почти половина хранится в скелетных мышцах, до 15% используется для структурных тканей, таких как кожа и кости, а остальные белки находятся в тканях и органах, включая почки и печень.
Хотите узнать больше? Читайте о нескольких скрытых источниках белка здесь.
 ,
,- Чип мил что это: ➤➤➤Читмил: что это такое и как применять
- Биосфера фитнес центр: Велнес-клуб премиум-класса на Ленинском проспекте и Шаболовской
