Снижение метаболизма что это: причины, симптомы, диагностика и способы лечения нарушений метаболизма
Нарушения метаболизма при сосудистых заболеваниях головного мозга
Сосудистые заболевания головного мозга – одна из ведущих причин смертности и инвалидизации населения всего мира. Окклюзия сосудов, питающих головной мозг, является начальным звеном в цепочке неблагоприятных изменений, которые приводят к грубым нарушениям метаболизма нейронов, структурно-функциональным изменениям, нередко заканчивающимся гибелью нервных клеток. Острая или хроническая ишемия мозговой ткани обусловливает целый каскад патологических реакций, которые в конечном итоге приводят к развитию очагового неврологического дефицита, дисциркуляторной энцефалопатии или к гибели больного. Тесная взаимосвязь нарушений энергетического и пластического обмена, их влияние на течение и прогноз заболевания нередко не учитываются при разработке схем лечения, а основой патогенетической терапии считается восстановление гемодинамики.
В последнее время нарушениям метаболизма и возможностям их коррекции уделяется большое внимание.
О возрастных гемодинамических и метаболических особенностях у больных ишемическим инсультом в реабилитационном периоде и способах их коррекции рассказала
– Неврологи очень много внимания уделяют лечению острого периода инсульта, а также профилактике цереброваскулярных нарушений. Не менее важной остается проблема реабилитации больных, перенесших инсульт.
 Мозговой инсульт представляет собой высокоинвалидизирующее заболевание: только 15-20% больных после инсульта возвращаются к прежней социальной и трудовой активности, поэтому актуальность вопросов реабилитации пациентов после сосудистых катастроф несомненна.
Мозговой инсульт представляет собой высокоинвалидизирующее заболевание: только 15-20% больных после инсульта возвращаются к прежней социальной и трудовой активности, поэтому актуальность вопросов реабилитации пациентов после сосудистых катастроф несомненна.
При этом очень важно учитывать возрастные особенности метаболизма и гемодинамики. Мы наблюдали пациентов среднего и пожилого возраста в период от 1 месяца до 1 года после острого инсульта. Пациенты от 40 до 59 лет вошли в группу среднего возраста, от 60 до 74 лет – в группу пожилых больных. Нами было выявлено, что течение как острого периода инсульта, так и периода реабилитации в этих двух группах имеет свои особенности. При изучении церебральной гемодинамики было обнаружено, что у больных среднего возраста изменения мозгового кровообращения более выражены по сравнению с контрольной группой такого же возраста и пожилыми людьми. Так, снижение объемной скорости кровотока в пораженных сосудах в средней возрастной группе с перенесенным инсультом составляло 55% по сравнению с той же возрастной группой без инсультов, в то время как в группе пожилых людей с инсультами этот показатель в сравнении с группой без инсультов оказался всего 19%.

Таким образом, можно утверждать, что у больных, перенесших инсульт в среднем возрасте, атеросклероз имеет более агрессивное и быстропрогрессирующее течение. Еще в 70-е годы в Институте геронтологии (совместно с харьковским Институтом неврологии, психиатрии и наркологии) профессор Никита Борисович Маньковский исследовал проблему раннего церебрального атеросклероза; при этом было выявлено, что у людей 40-50 лет к инсультам и инфарктам приводит высокоагрессивное течение атеросклероза. В настоящее время эта теория продолжает находить свое подтверждение и учитывается при решении вопросов лечения и профилактики мозговых инсультов.
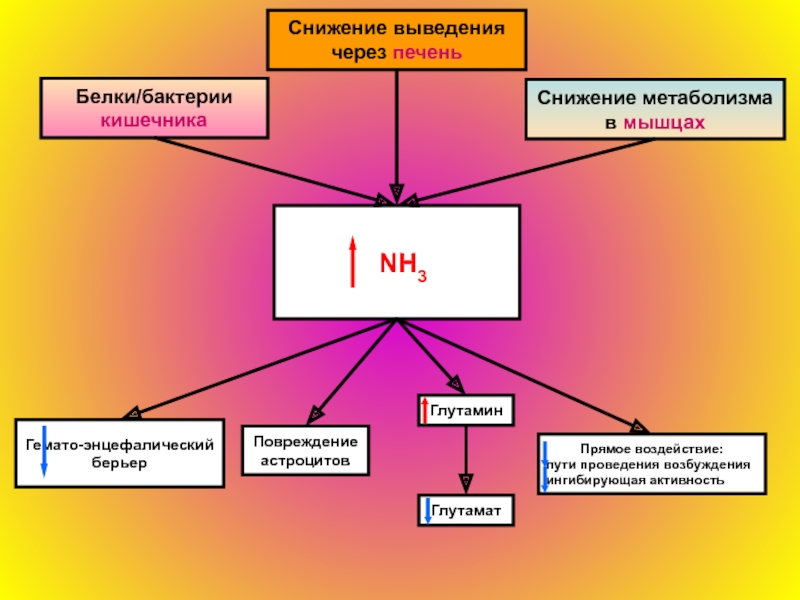 Мы определяли у наших больных содержание метаболитов (N-ацетилацетата, холина, лактата и креатинина) в лобной и затылочной долях, а также в очаге инсульта. N-ацетилацетат является маркером здоровых нейронов; его определение используется не только для научных целей, но и в практической медицине во многих зарубежных странах для оценки течения и прогноза в острый период инсульта. Содержание этого метаболита в очаге на уровне 0,7 ммоль или ниже говорит о крайне неблагоприятном течении инсульта и глубокой инвалидизации. Холин входит в состав клеточных мембран и является показателем позднего глиоза, который у многих больных в период реабилитации проявляется так называемыми глиозными образованиями. Холин в некоторой степени свидетельствует о функциональной активности холинергической системы. Креатинин – буфер для энергетического обмена, источник АТФ и АМФ, поэтому он характеризует энергетический обмен в нейронах, при старении его содержание снижается. Лактат, как известно, представляет собой маркер ишемии, в здоровом мозге лактата не должно быть.
Мы определяли у наших больных содержание метаболитов (N-ацетилацетата, холина, лактата и креатинина) в лобной и затылочной долях, а также в очаге инсульта. N-ацетилацетат является маркером здоровых нейронов; его определение используется не только для научных целей, но и в практической медицине во многих зарубежных странах для оценки течения и прогноза в острый период инсульта. Содержание этого метаболита в очаге на уровне 0,7 ммоль или ниже говорит о крайне неблагоприятном течении инсульта и глубокой инвалидизации. Холин входит в состав клеточных мембран и является показателем позднего глиоза, который у многих больных в период реабилитации проявляется так называемыми глиозными образованиями. Холин в некоторой степени свидетельствует о функциональной активности холинергической системы. Креатинин – буфер для энергетического обмена, источник АТФ и АМФ, поэтому он характеризует энергетический обмен в нейронах, при старении его содержание снижается. Лактат, как известно, представляет собой маркер ишемии, в здоровом мозге лактата не должно быть.
Наше исследование показало, что гемодинамические изменения были более выражены в группе пациентов среднего возраста, а метаболические нарушения (снижение функциональной активности нейронов, энергетического обмена, большая выраженность ишемии и некроза клеток мозга) преобладали в старшей возрастной группе. Лактат обнаружен в поздние сроки инсульта (позже 1 месяца) у 42% пациентов, причем менее трети из них (30%) составляли больные среднего возраста, а большая часть (70%) – пациенты старшей возрастной группы.

В патогенезе ишемического инсульта большое значение имеет и кардиальная патология. Не менее четверти случаев инсульта возникают на фоне заболеваний сердца. Назначая терапию при инсульте, следует помнить не только о возрастных особенностях церебральной гемодинамики и метаболизма, но и о воздействии тех или иных препаратов на центральную гемодинамику. Для людей среднего возраста обнаруживаются жесткие корреляционные связи между системной и церебральной гемодинамикой в области пораженных сосудов, у пожилых людей такие корреляции прослеживаются и по отношению к мозговым сосудам интактного полушария. Это говорит о том, что у пожилых пациентов более выражены нарушения авторегуляции мозгового кровообращения, что обусловливает необходимость более осторожно подходить к разработке стратегии лечения таких больных. Небольшое повышение или снижение систолического или диастолического системного артериального давления у таких пациентов значительно изменяет церебральную гемодинамику, в том числе и в регионах кровоснабжения интактных сосудов.
Таким образом, при реабилитации пациентов с инсультом одним из наиболее важных аспектов считается фармакологическая (медикаментозная) реабилитация. Основными методами воздействия на патогенез заболевания можно считать препараты вазоактивного и ноотропного действия, они улучшают гемодинамику и метаболизм мозга. Одним из наиболее перспективных нейропротекторных препаратов на сегодняшний день является препарат комплексного действия Инстенон. Он состоит из нескольких компонентов, которые имеют свою направленность действия: этамиван активно влияет на лимбико-ретикулярный комплекс, гексобендин обладает мощным метаболическим эффектом на нейроны головного мозга, этофиллин активирует метаболизм миокарда, тем самым оказывая положительное влияние на гемодинамику.
 Мы использовали этот препарат сначала внутримышечно в течение 10 дней, затем применяли 20 дней в таблетированной форме. Инстенон выраженно улучшает гемодинамику в интракраниальных сосудах – средней мозговой артерии и сосудах вертебробазилярного бассейна. Нами отмечен интересный эффект препарата: после применения Инстенона устраняется патологическое влияние гемодинамики в пораженных сосудах на электрогенез мозга. Следует отметить, что у больных пожилого возраста с инсультом очень жесткие связи не только между гемодинамикой и метаболизмом, но и между гемодинамикой и электрофизиологией мозга (ЭЭГ-показателями). Даже небольшие нарушения гемодинамики вызывают изменения ЭЭГ-ритмов. При применении Инстенона не только изменяется структура электрогенеза (снижается медленная активность и увеличивается интенсивность альфа-ритма, отмечается некоторое увеличение частоты альфа- и дельта-ритмов), но и устраняется патологическая зависимость электрогенеза от гемодинамики. Это свидетельствует о положительных вазотропных влияниях и антиишемическом эффекте препарата, которые в свою очередь улучшают психоэмоциональное состояние больного (улучшение памяти, речевой функции и других проявлений неврологического дефицита).
Мы использовали этот препарат сначала внутримышечно в течение 10 дней, затем применяли 20 дней в таблетированной форме. Инстенон выраженно улучшает гемодинамику в интракраниальных сосудах – средней мозговой артерии и сосудах вертебробазилярного бассейна. Нами отмечен интересный эффект препарата: после применения Инстенона устраняется патологическое влияние гемодинамики в пораженных сосудах на электрогенез мозга. Следует отметить, что у больных пожилого возраста с инсультом очень жесткие связи не только между гемодинамикой и метаболизмом, но и между гемодинамикой и электрофизиологией мозга (ЭЭГ-показателями). Даже небольшие нарушения гемодинамики вызывают изменения ЭЭГ-ритмов. При применении Инстенона не только изменяется структура электрогенеза (снижается медленная активность и увеличивается интенсивность альфа-ритма, отмечается некоторое увеличение частоты альфа- и дельта-ритмов), но и устраняется патологическая зависимость электрогенеза от гемодинамики. Это свидетельствует о положительных вазотропных влияниях и антиишемическом эффекте препарата, которые в свою очередь улучшают психоэмоциональное состояние больного (улучшение памяти, речевой функции и других проявлений неврологического дефицита).
После перенесенного инсульта у многих больных через год, а иногда и раньше, появляется экстрапирамидная недостаточность, которая усугубляет неврологические нарушения и социальную дезадаптацию человека. Еще одним достаточно частым поздним последствием инсульта является депрессия. В связи с этими данными нами проведены длительные наблюдения за больными с целью изучения изменений метаболизма мозга в разные периоды времени после инсульта. Мы обнаружили, что в первое полугодие после перенесенного инсульта у больных наблюдается низкое содержание N-ацетилацетата, что свидетельствует о сниженной функциональной активности нейронов. К 12 месяцам содержание этого метаболита в сером веществе увеличивается, а на второй год после инсульта – резко снижается. Именно это и является основой формирования постинсультных дополнительных синдромов, а также предпосылкой для повторных нарушений мозгового кровообращения. Эти данные свидетельствуют о том, что больным после инсульта даже в отдаленные сроки необходима активная метаболическая и вазоактивная коррекция.
 Мы рекомендуем добавлять к терапии ингибиторы МАО, которые не только эффективно предупреждают развитие экстрапирамидных нарушений, но и улучшают когнитивные процессы, обладают антидепрессивным эффектом. У больных, которым 2-3 раза в год назначают курс лечения ингибиторами МАО, реже развивается экстрапирамидная недостаточность, двигательные нарушения не прогрессируют, а чаще регрессируют. В эксперименте при применении ингибиторов МАО улучшаются не только качество жизни пациентов, но и ее продолжительность.
Мы рекомендуем добавлять к терапии ингибиторы МАО, которые не только эффективно предупреждают развитие экстрапирамидных нарушений, но и улучшают когнитивные процессы, обладают антидепрессивным эффектом. У больных, которым 2-3 раза в год назначают курс лечения ингибиторами МАО, реже развивается экстрапирамидная недостаточность, двигательные нарушения не прогрессируют, а чаще регрессируют. В эксперименте при применении ингибиторов МАО улучшаются не только качество жизни пациентов, но и ее продолжительность.Говоря об антитромбоцитарной терапии как о важнейшей составляющей профилактики повторных инсультов, следует отметить, что в фармакодинамике аспирина важен не только антиагрегантный, но и противовоспалительный эффект препарата. Именно это действие аспирина – основа профилактики развития кист после инсультов.
Подводя итог нашему анализу возрастных гемодинамических и метаболических особенностей при острых инсультах, можно сделать следующие выводы:
– у людей среднего возраста, перенесших инсульт, атеросклеротический процесс идет более агрессивно, в связи с чем ведущим направлением лечения и реабилитации пациентов должна стать противосклеротическая терапия;
– у людей пожилого возраста при инсульте выражены не только нарушения гемодинамики, и особенно метаболизма мозга, но и отмечается жесткая взаимосвязь между центральным и церебральным кровотоком, поэтому наиболее актуальны в лечении препараты вазоактивного и нейропротекторного действия;
– лечение и реабилитация пациентов после инсульта должны быть комплексными, необходимо учитывать особенности гемодинамики и метаболизма мозга.
Результаты сравнительного анализа изменений метаболизма у лиц, перенесших ишемический инсульт однократно и повторно, а также у пациентов, страдающих транзиторными ишемическими атаками, привела в своем докладе заведующая кафедрой нервных болезней Харьковского государственного медицинского университета им. В.Н. Каразина, доктор медицинских наук, профессор Ирина Анатольевна Григорова.
– Одним из наиболее важных принципов реабилитации пациентов после инсульта является оценка тяжести не только неврологического дефицита, но и структурно-функциональных изменений мозга, установленных с помощью КТ, УЗИ, электрофизиологических параметров (ЭЭГ), шкал изменений движения и чувствительности. Нами были дополнительно разработаны шкалы метаболических изменений. Собрав воедино критерии тяжести, полученные с помощью инструментальных методов исследования, мы создали шкалу оценки тяжести больных, перенесших острое нарушение мозгового кровообращения, в которой от качественного представления перешли к количественному, когда измененному параметру присваивается соответствующий балл. Таким образом, все показатели оценивали в баллах, их количество свидетельствовало о тяжести повреждения головного мозга. Это имеет не только научное значение, но и важное практическое применение – медицинское, социальное, экспертное (например, для определения ориентировочных сроков пребывания больного в стационаре, тактики лечения, реабилитационных мероприятий).
Таким образом, все показатели оценивали в баллах, их количество свидетельствовало о тяжести повреждения головного мозга. Это имеет не только научное значение, но и важное практическое применение – медицинское, социальное, экспертное (например, для определения ориентировочных сроков пребывания больного в стационаре, тактики лечения, реабилитационных мероприятий).
Особенностью разработанной шкалы стало то, что оценка степени тяжести состояния больных зависела не столько от клинических проявлений, сколько от глубины метаболических изменений. Мы разделили всех пациентов с высоким риском развития инсульта на три группы: к первой группе пациентов отнесли лиц, которые перенесли один ишемический инсульт; ко второй – перенесших несколько инсультов; к третьей – лиц без инсульта, но страдавших от повторных ТИА. Оказалось, что в третьей группе пациентов, которая клинически была отнесена к сравнительно легкой, развивались грубейшие нарушения метаболического характера, причем степень этих изменений обычно опережала таковую у пациентов первой группы (с одним инсультом в анамнезе). Лица, которые перенесли один инсульт, оказались наиболее подвержены терапии, у них были наилучшие результаты лечения. У лиц, перенесших более одного инсульта, после курса терапии также отмечались регресс симптоматики и улучшение общего состояния. В то же время пациенты, которые не имели ни одного инсульта, но подвергались ТИА, не всегда поддавались лечению; причиной тому было выраженное атеросклеротическое повреждение экстракраниальных сосудов.
Лица, которые перенесли один инсульт, оказались наиболее подвержены терапии, у них были наилучшие результаты лечения. У лиц, перенесших более одного инсульта, после курса терапии также отмечались регресс симптоматики и улучшение общего состояния. В то же время пациенты, которые не имели ни одного инсульта, но подвергались ТИА, не всегда поддавались лечению; причиной тому было выраженное атеросклеротическое повреждение экстракраниальных сосудов.
Состояние пациентов мы оценивали до курса лечения и после него. В схеме лечения применяли вазоактивные препараты, ноотропы и статины. Пациентов с выраженным стенозом общей сонной артерии направляли на консультацию к сосудистому хирургу.
Препарат Инстенон в клинической практике мы применяли внутримышечно по 2 мл 1 раз в сутки на протяжении 10 дней, затем перорально по 1-2 таблетки 3 раза в сутки в течение 35-40 дней. Уникальность действия Инстенона привлекает внимание специалистов давно: три составляющие препарата оказывают комплексное действие на головной мозг. Гексабендин за счет ноотропного эффекта способствует редукции кислородного голодания. Этамиван оказывает великолепное интегративное действие и восстанавливает функцию сознания. Этофиллин известен и кардиологам, и неврологам, так как оптимизирует работу миокарда, увеличивает сердечный выброс и таким образом улучшает центральную и периферическую гемодинамику. Эти эффекты очень важны, так как большинство больных с инсультами имеют кардиальную патологию, которая ухудшает течение заболевания. Инстенон позволяет комплексно воздействовать на всю сердечно-сосудистую систему.
Гексабендин за счет ноотропного эффекта способствует редукции кислородного голодания. Этамиван оказывает великолепное интегративное действие и восстанавливает функцию сознания. Этофиллин известен и кардиологам, и неврологам, так как оптимизирует работу миокарда, увеличивает сердечный выброс и таким образом улучшает центральную и периферическую гемодинамику. Эти эффекты очень важны, так как большинство больных с инсультами имеют кардиальную патологию, которая ухудшает течение заболевания. Инстенон позволяет комплексно воздействовать на всю сердечно-сосудистую систему.
В обязательный курс лечения больных после перенесенного инсульта в период реабилитации входил Актовегин. При комбинировании Актовегина и Инстенона при глубоких метаболических нарушениях (инсультах) метаболическое действие этих препаратов направлено главным образом на функции митохондрий, позволяя осуществлять спасительное в условиях ишемии анаэробное окисление глюкозы, способствуя восстановлению аэробного окисления в нейронах.
В комплексном лечении очень важно применение статинов. В настоящее время статины широко внедряются в неврологию благодаря уникальности своего действия: они обладают не только липидокорригирующим действием, но и положительным влиянием на эндотелиальную дисфункцию. Статины нормализуют липидный спектр крови, создают условия для адекватной агрегации, оптимальной гемодинамики.
При оценке нарушений липидного обмена нами использованы как плазменные, так и клеточные показатели. Липидно-плазменный обмен был нарушен у групп больных с одним инсультом, несколькими инсультами и с перенесенными ТИА приблизительно в одинаковой мере. Это говорит о высочайшем риске развития инсульта и системного атеросклероза у лиц, которые не перенесли инсульт, но имеют множественные ТИА. Кроме изучения плазменных показателей, которые давно используются в медицинской практике, мы впервые предложили метод гистохимического исследования липидосодержащих лейкоцитов крови, который применяли не только для оценки тяжести состояния лиц, перенесших острое нарушение мозгового кровообращения, но и с целью качественно-количественного определения липидного обмена. Внутриклеточные липиды в нейтрофилах являются важным фактором, регулирующим соотношение специфических и неспецифических иммунных сил организма. При гистохимическом исследовании липидосодержащих лейкоцитов мы обнаружили, что до лечения церебральной ишемии способность нейтрофилов к фагоцитозу была значительно ниже. Относительно неплохой компенсаторный коэффициент при гистохимическом исследовании липидосодержащих лейкоцитов определяли у пациентов, перенесших один инсульт (большинство больных активно лечились не только в остром периоде инсульта, но и после выписки из стационара). Наиболее низким коэффициент был у лиц, перенесших повторный инсульт. Больные с повторными ТИА, которые обычно не являются объектами длительного лечения, зачастую поздно обращаются к врачам, имели наиболее неблагоприятные изменения коэффициента фагоцитоза.
Внутриклеточные липиды в нейтрофилах являются важным фактором, регулирующим соотношение специфических и неспецифических иммунных сил организма. При гистохимическом исследовании липидосодержащих лейкоцитов мы обнаружили, что до лечения церебральной ишемии способность нейтрофилов к фагоцитозу была значительно ниже. Относительно неплохой компенсаторный коэффициент при гистохимическом исследовании липидосодержащих лейкоцитов определяли у пациентов, перенесших один инсульт (большинство больных активно лечились не только в остром периоде инсульта, но и после выписки из стационара). Наиболее низким коэффициент был у лиц, перенесших повторный инсульт. Больные с повторными ТИА, которые обычно не являются объектами длительного лечения, зачастую поздно обращаются к врачам, имели наиболее неблагоприятные изменения коэффициента фагоцитоза.
После проведенного курса полифакторного лечения Актовегином, Инстеноном и статинами в высоких дозах отмечали снижение атерогенности крови и повышение способности клеток к фагоцитозу.
Помимо этих показателей, мы изучали состояние оксидантно-антиоксидантной системы, поскольку в настоящее время существуют неоспоримые доказательства, что одним из основных повреждающих факторов при ишемии является оксидантный стресс, который запускает серию патологических процессов с вовлечением всех видов обмена веществ – белкового, липидного и углеводного. В настоящее время принято считать, что самые агрессивные воздействия в структурно-молекулярной биологии оказывают свободные радикалы, атакующие клеточные мембраны. Мы использовали интегративный метод биохемолюминесценции, который дает возможность выявлять наиболее агрессивные перекиси и свободные радикалы. У всех больных с сосудистыми заболеваниями головного мозга преобладали агрессивные факторы над антиоксидантными. До лечения наибольшее содержание свободных радикалов определялось в группе больных, перенесших повторные инсульты. После лечения у больных наблюдалось относительное улучшение данных показателей, хотя далеко не полноценное. Это еще раз доказывает, что лица, перенесшие инсульт, требуют тщательного наблюдения и адекватного беспрерывного лечения даже в отдаленные сроки.
Это еще раз доказывает, что лица, перенесшие инсульт, требуют тщательного наблюдения и адекватного беспрерывного лечения даже в отдаленные сроки.
В качестве метода определения состояния физического здоровья и основы для рекомендаций по целесообразности того или иного комплекса терапевтических воздействий мы внедрили так называемый биофизический метод, с помощью которого определяли степень подвижности нативных клеток буккального эпителия при электрофорезе. С помощью этого метода можно судить об эффективности проведенного лечения, о степени тяжести больного в данный момент и необходимости включения в схему лечения тех или иных препаратов. Абсолютно у всех пациентов электроотрицательность клеток была ниже нормы. После лечения Актовегином, Инстеноном и статинами она повышалась, что сопровождалось улучшением состояния физического здоровья.
Таким образом, у больных, которые перенесли ТИА, выявлены более глубокие клинико-биохимические и энергетические нарушения, чем у лиц, перенесших один ишемический инсульт. Это связано со многими причинами: прежде всего, играет роль чрезмерное экстракраниальное сужение сосудов, питающих головной мозг; кроме того, у пациентов с неоднократными ТИА развивается дисциркуляторная энцефалопатия II и III стадии с микроструктурными нарушениями, которые приводят к выраженным метаболическим изменениям. Пациентов с ТИА необходимо выявлять скрининговыми методами исследования, включать в группу диспансерного наблюдения, они подлежат активному лечению. Однако в настоящее время такие пациенты зачастую попадают к врачу лишь после второй или третьей ишемической атаки, а порой и вообще не обращаются за медицинской помощью. Да и неврологи часто считают, что ТИА – намного менее значимая патология, чем инсульты, поэтому уделяют ее лечению и профилактике гораздо меньше внимания.
Это связано со многими причинами: прежде всего, играет роль чрезмерное экстракраниальное сужение сосудов, питающих головной мозг; кроме того, у пациентов с неоднократными ТИА развивается дисциркуляторная энцефалопатия II и III стадии с микроструктурными нарушениями, которые приводят к выраженным метаболическим изменениям. Пациентов с ТИА необходимо выявлять скрининговыми методами исследования, включать в группу диспансерного наблюдения, они подлежат активному лечению. Однако в настоящее время такие пациенты зачастую попадают к врачу лишь после второй или третьей ишемической атаки, а порой и вообще не обращаются за медицинской помощью. Да и неврологи часто считают, что ТИА – намного менее значимая патология, чем инсульты, поэтому уделяют ее лечению и профилактике гораздо меньше внимания.
Реабилитацию цереброваскулярных больных и подбор медикаментозных препаратов должны осуществлять только специалисты, в том числе кардиологи. Полученные нами данные позволяют патогенетически обосновать значение вазоактивного и ноотропного лечения в сочетании с гиполипидемической терапией. Для коррекции нарушений метаболического гомеостаза мы рекомендуем схему, включающую Актовегин, Инстенон и препарат из группы статинов. Многим пациентам также показана экстракраниальная эндартерэктомия, которая позволяет предотвратить грубые метаболические изменения головного мозга.
Для коррекции нарушений метаболического гомеостаза мы рекомендуем схему, включающую Актовегин, Инстенон и препарат из группы статинов. Многим пациентам также показана экстракраниальная эндартерэктомия, которая позволяет предотвратить грубые метаболические изменения головного мозга.
СТАТТІ ЗА ТЕМОЮ
30.05.2021 Онкологія та гематологія Програма Guardian: мовою доказової медицини про туроктоког альфаТуроктоког альфа (препарат НовоЕйт, фармацевтична компанія Novo Nordisk, Данія) – це рекомбінантний людський фактор коагуляції VIII (FVIII) з усіченим В-доменом без будь-яких інших модифікацій у послідовності амінокислот. Засіб є очищеним білком, який складається з 1445 амінокислот і має молекулярну масу близько 166 кДа. Його виготовляють за допомогою технології рекомбінантної ДНК у клітинах яєчників китайського хом’яка й отримують без додавання будь-яких білків людського чи тваринного походження в процесі культивування клітин, очищення або виробництва готового препарату….
Засіб є очищеним білком, який складається з 1445 амінокислот і має молекулярну масу близько 166 кДа. Його виготовляють за допомогою технології рекомбінантної ДНК у клітинах яєчників китайського хом’яка й отримують без додавання будь-яких білків людського чи тваринного походження в процесі культивування клітин, очищення або виробництва готового препарату….
12-14 березня на міжнародній медичній науково-освітній платформі Medical Knowledge Hub відбулася друга Школа дерматоонкології. Онлайн-захід був орієнтований на лікарів, які займаються діагностикою та лікуванням пухлин шкіри, а саме дерматологів, онкологів, онкохірургів, патоморфологів, суміжних спеціалістів. Особливою подією школи став сателітний симпозіум компанії MSD, у рамках якого провідні фахівці висвітлили сучасні погляди на діагностику та лікування меланоми….
Онлайн-захід був орієнтований на лікарів, які займаються діагностикою та лікуванням пухлин шкіри, а саме дерматологів, онкологів, онкохірургів, патоморфологів, суміжних спеціалістів. Особливою подією школи став сателітний симпозіум компанії MSD, у рамках якого провідні фахівці висвітлили сучасні погляди на діагностику та лікування меланоми….
Метаболическая кардиомиопатия | Руководство по кардиологии
(Е.Г. Несукай)
Определение
Метаболическая кардиомиопатия (ранее ее определяли как дистрофию миокарда, миокардиодистрофию) — невоспалительное поражение миокарда различной этиологии, в основе которого лежит нарушение обмена веществ, процесса образования энергии и/или нарушение ее превращения в механическую работу, приводящее к дистрофии миокарда и недостаточности сократительной и других функций сердца.
Этиология
Метаболическая кардиомиопатия развивается в результате воздействия патогенных факторов при различных заболеваниях и состояниях (схема 8. 1).
1).
Среди физических факторов могут рассматриваться радиация, вибрация, перегревание, переохлаждение, гиперинсоляция.
К химическим факторам относятся лекарственные средства, токсическое воздействие бытовых и промышленных ядов.
Патогенез
В возникновении и развитии метаболических поражений миокарда при разных заболеваниях существенное значение имеет нарушение иннервации, транспорта и утилизации энергии в кардиомиоцитах, то есть их энергообеспечение.
Напряжение регулирующих систем, функции миокарда и метаболических процессов в кардиомиоцитах ограничивает резервные возможности сердца. Длительная гиперфункция сама по себе, а особенно в неблагоприятных условиях на фоне основного заболевания, может привести к возникновению энергетического дефицита и нарушению приспособительных изменений в миокарде.
Механизмы снижения продукции энергии в поврежденном сердце включают снижение плотности капилляров, увеличение межкапиллярного расстояния, а также больший диаметр гипертрофированных кардиомиоцитов, что ухудшает диффузию кислорода и обусловливает возникновение гипоксии миокарда. Один из механизмов связан также с нарушением функции митохондрий, которое вызвано редуцированным синтезом окислительных энзимов вследствие нарушения пролиферативной реакции, которая частично опосредована экспрессией рецепторов PPARα, играющих ключевую роль в биогенезе митохондрий. Эти рецепторы регулируют транскрипцию многих энзимов и переносчиков (транспортеров), которые участвуют в транспорте и окислении жирных кислот. Также снижается способность сердца восстанавливать запасы макроэргических фосфатов. Уменьшение окисления жирных кислот вызывает накопление липидов и вносит вклад в некроз поврежденных мембран, при этом высвобождение реактивных молекул (цитохромов, радикалов кислорода) приводит к апоптозу. Ускоренный гликолиз, вызванный нарушением окислительного фосфорилирования, приводит к ацидозу, который ингибирует многие процессы, включенные в процесс сокращения — расслабления. Из последних наиболее важным является повышение концентрации кальция в цитозоле, который инициирует множество порочных кругов, приводящих к некрозу миоцитов.
Один из механизмов связан также с нарушением функции митохондрий, которое вызвано редуцированным синтезом окислительных энзимов вследствие нарушения пролиферативной реакции, которая частично опосредована экспрессией рецепторов PPARα, играющих ключевую роль в биогенезе митохондрий. Эти рецепторы регулируют транскрипцию многих энзимов и переносчиков (транспортеров), которые участвуют в транспорте и окислении жирных кислот. Также снижается способность сердца восстанавливать запасы макроэргических фосфатов. Уменьшение окисления жирных кислот вызывает накопление липидов и вносит вклад в некроз поврежденных мембран, при этом высвобождение реактивных молекул (цитохромов, радикалов кислорода) приводит к апоптозу. Ускоренный гликолиз, вызванный нарушением окислительного фосфорилирования, приводит к ацидозу, который ингибирует многие процессы, включенные в процесс сокращения — расслабления. Из последних наиболее важным является повышение концентрации кальция в цитозоле, который инициирует множество порочных кругов, приводящих к некрозу миоцитов.
В прогрессировании метаболической кардиомиопатии ведущую роль играет усиление реакций свободнорадикального перекисного окисления липидов клеточных мембран. Повреждая мембраны, гидроперекиси и свободные радикалы снижают активность липидозависимых ферментативных реакций (к которым относятся основные жизненно важные ферменты ионного транспорта и дыхательной цепи митохондрий), изменяют мембранорецепторные системы клетки с развитием медиаторного дисбаланса, активируют протеолитические и лизосомальные ферменты.
Патологическая анатомия
Метаболические поражения миокарда охватывают все стадии нарушения обмена сердечной мышцы — от функциональных расстройств до грубых структурных изменений. Морфологические изменения происходят внутри клеток миокарда и не сопровождаются увеличением их количества. Наиболее чувствительны к патогенным воздействиям митохондрии и эндоплазматическая сеть. Для дегенеративных изменений миокарда характерно мозаичное нарушение структуры кардиомиоцитов: в одной и той же клетке среди набухших митохондрий с частично или полностью разрушенными внутренними перегородками могут быть митохондрии с нормальным строением.
Как правило, устранение патогенной причины приводит к постепенной нормализации ультраструктур кардиомиоцита, что обусловлено внутриклеточными регенераторными процессами. Поврежденные миофибриллы восстанавливаются в результате активной деятельности рибосом: постепенно устраняется внутриклеточный отек, появляются зерна гликогена, уменьшается количество жировых включений. При длительном и интенсивном воздействии повреждающих факторов на миокард дистрофические изменения могут приводить к глубоким морфологическим изменениям, заканчивающимся развитием миокардиофиброза.
Гибель части миокарда восполняется увеличением массы специфических структур в неповрежденных клетках, происходит гиперплазия митохондрий, саркоплазматического ретикулума, рибосом. В результате развивается гипертрофия миокарда, представляющая собой компенсаторную регенераторно-гиперпластическую реакцию, характерную для миокарда. Биохимические процессы чаще нарушаются в ЛЖ.
Клиническая картина
Клинические проявления многообразны и не являются специфичными. Начальные стадии могут протекать бессимптомно, со временем снижение сократительной способности миокарда может привести к тяжелой СН.
Начальные стадии могут протекать бессимптомно, со временем снижение сократительной способности миокарда может привести к тяжелой СН.
Нередко на фоне проявлений основного заболевания отмечают кардиалгию (чаще в области верхушки сердца (92%), реже за грудиной (15%)), расширение границ сердца, приглушенность тонов, небольшой систолический шум на верхушке сердца, нарушения ритма (в основном экстрасистолическую аритмию).
Диагностика
ЭКГ является ведущим методом в распознавании дистрофических изменений в миокарде, которые касаются в основном процесса реполяризации и проявляются чаще всего изменениями конечной части желудочкового комплекса: отмечается депрессия сегмента ST, которая имеет восходящий характер к положительному зубцу Т. Зубец Т также может быть деформированным, низкоамплитудным, сглаженным или отрицательным.
Также может определяться снижение вольтажа комплекса QRS, особенно выраженное при ожирении и микседеме, при тиреотоксикозе амплитуда зубцов чаще увеличена. В некоторых случаях могут возникать замедление внутрипредсердной проводимости, увеличение интервала Q–T, нарушения внутрижелудочковой проводимости. Из нарушений ритма наиболее часто отмечают синусовую тахикардию и экстрасистолическую аритмию.
В некоторых случаях могут возникать замедление внутрипредсердной проводимости, увеличение интервала Q–T, нарушения внутрижелудочковой проводимости. Из нарушений ритма наиболее часто отмечают синусовую тахикардию и экстрасистолическую аритмию.
При формулировке диагноза следует прежде всего указать основное заболевание или этиологический фактор, характер течения кардиомиопатии и основные клинические проявления (наличие нарушений ритма и проводимости, стадию СН).
В дифференциальной диагностике метаболической кардиомиопатии могут иметь значение нагрузочные и медикаментозные пробы, в случае необходимости — проведение коронарографии.
Лечение
Независимо от повреждающего фактора принципиальными для метаболической кардиомиопатии могут быть следующие положения:
- нарушения метаболизма миокарда при своевременном лечении обратимы;
- выраженная СН развивается сравнительно редко, в основном в конечной стадии заболевания, но возникшая СН резистентна к сердечным гликозидам и успех терапии целиком зависит от степени восстановления нарушенного обмена веществ в миокарде.

Помощь больным следует начинать с устранения причины развития дистрофии миокарда. Немаловажное значение имеет отказ от курения и злоупотребления алкоголем, исключение физического и психоэмоционального перенапряжения.
Наряду с лечением основного заболевания необходимо восстановление адекватного энергетического обмена. На первый план выступает применение комплекса лекарственных средств, направленных на улучшение транспорта кислорода в ткани и его утилизации.
На обмен веществ в клетке могут оказывать влияние две группы лекарственных средств: регуляторы экстрацеллюлярной природы (гормональные препараты, блокаторы и стимуляторы центральной и периферической нервной системы) и регуляторы метаболизма интрацеллюлярной природы (ферменты и антиферменты, витамины, кофакторы, разнообразные метаболиты), оказывающие действие на различные пути обмена веществ.
При нарушении процессов окислительного фосфорилирования применяют комплекс витаминов, включающий витамины В1, В2, пантотеновую и липоевую кислоты. Витамины группы В влияют на белковый, липидный, углеводно-энергетический обмен, синтез аминокислот, нуклеотидов.
Витамины группы В влияют на белковый, липидный, углеводно-энергетический обмен, синтез аминокислот, нуклеотидов.
Среди препаратов с антиоксидантными свойствами широко применяют токоферола ацетат, его сочетание с витамином РР (никотиновой кислотой) способствует улучшению энергетического обеспечения сократительной функции миокарда. Активным антиоксидантом, который участвует в окислительно-восстановительных процессах, является витамин С.
Большое значение для нормализации метаболизма миокарда имеет достаточное поступление в организм незаменимых аминокислот; в том числе метионина, лейцина, аланина, валина, лизина, трионина, триптофана, являющихся пластическим материалом для синтеза белка, ферментов, коферментов. Для улучшения их усвоения рекомендуется назначать их в комплексе с анаболическими стероидами (метандиенон, нандролон).
При прогрессировании дистрофического процесса показано применение внутрь калия хлорида, калия и магния аспарагината для устранения закономерного дефицита внутриклеточного калия, нарушения баланса кальция и магния, что приводит к восстановлению регуляции возбудимости и проводимости миокарда, его автоматизма и сократимости.
Для активации синтеза белков и нуклеиновых кислот применяют соли оротовой кислоты (оротат калия/магния).
Проводимая терапия должна быть направлена на повышение генерации энергии и повышение устойчивости миокарда к гипоксии. В последнее время большое внимание уделяют роли серотонинергической системы в регуляции стрессорной реакции. Специфической особенностью никотинамида является его способность стимулировать процессы аэробного окисления и обмен гликогена, тем самым повышая устойчивость кардиомиоцитов к гипоксии.
Прямое цито- и мембранопротекторное действие на кардиомиоциты в условиях гипоксических состояний оказывает триметазидин.
Продолжительность интенсивной метаболической терапии на ранних стадиях у больных с преимущественно функциональными нарушениями составляет 2–3 нед. При прогрессировании дистрофии миокарда и выявлении органического поражения сердца курс терапии следует повторять несколько раз в год.
ПОРАЖЕНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ПРИ ЭНДОКРИННЫХ НАРУШЕНИЯХ
Сердечно-сосудистая система часто вовлекается в патологический процесс при заболеваниях желез внутренней секреции. Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме.
Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме.
ПОРАЖЕНИЕ СЕРДЦА ПРИ САХАРНОМ ДИАБЕТЕ
Термин «диабетическая кардиомиопатия» впервые предложен в 1954 г. для обозначения кардиальных изменений, предшествующих ИБС.
Патогенез
Патогенез метаболической кардиомиопатии при сахарном диабете многофакторный, поражение сердечно-сосудистой системы обусловлено сложными обменными нарушениями, возникающими в связи с абсолютной или относительной недостаточностью инсулина и нарушением толерантности к глюкозе.
Патогенез миокардиальных нарушений включает несколько основных механизмов: повреждение кардиомиоцитов, микроциркуляторные и нейровегетативные нарушения. Первый механизм связан с нарушением метаболизма кардиомиоцитов, снижением эффективности энергетических, пластических процессов и изменением ионного метаболизма, в результате чего снижаются компенсаторные возможности сердечно-сосудистой системы, нарушается сократительная функция миокарда, уменьшается толерантность к физическим нагрузкам. Второй механизм основывается на микроциркуляторных нарушениях в мелких артериях миокарда как локального проявления генерализованной микроангиопатии. Третий механизм включает поражение вегетативной нервной системы в результате формирования нейровегетодистрофии.
Второй механизм основывается на микроциркуляторных нарушениях в мелких артериях миокарда как локального проявления генерализованной микроангиопатии. Третий механизм включает поражение вегетативной нервной системы в результате формирования нейровегетодистрофии.
Кардиомиопатия, не обусловленная нарушением коронарного кровообращения, возникает у больных молодого возраста с ювенильным сахарным диабетом, для которых нехарактерно развитие выраженного атеросклероза, или у пациентов старшего возраста без сопутствующей ИБС.
Инсулин оказывает на сердце прямое действие, которое заключается в увеличении поступления и стимуляции окисления глюкозы и лактата, увеличении образования гликогена в миокарде. Непрямой эффект инсулина состоит в снижении содержания жирных кислот в плазме крови, уменьшении их поступления в сердце.
Дефицит инсулина вызывает нарушение утилизации тканями глюкозы и усиливает расщепление липидов и белков, также приводит к выраженным изменениям состава внутренней среды организма — гипергликемии, гиперкетонемии, гиперлипидемии с накоплением в крови жирных кислот, диспротеинемии, метаболическому ацидозу, оксидантный стресс вызывает апоптоз миоцитов. Эти нарушения являются определяющими факторами изменения структуры и функции миокарда.
Эти нарушения являются определяющими факторами изменения структуры и функции миокарда.
Патогенез и морфогенез диабетического поражения сердца обусловлены не только влиянием гиперинсулинемии на эндотелий сосудов, энергетические и метаболические процессы в миокарде, но и непосредственно связаны с токсико-метаболическим повреждением кардиомиоцитов.
Есть мнение, что причиной разрушения структур кардиомиоцитов, нарушения структуры сарколеммы и ее дериватов, изменения ионного равновесия и снижения активности актомиозинового комплекса кардиомиоцитов является прямая глюкозотоксичность.
В патогенезе кардиомиопатии важную роль играет тканевая гипоксия. Большое значение в развитии гипоксии имеет нарушение транспорта кислорода кровью, функции дыхательных ферментов под влиянием выраженного ацидоза. При сахарном диабете потребность тканей, в том числе миокарда, в кислороде повышена.
Важным фактором развития миокардиодистрофии является нарушение нейроэндокринной регуляции сердца, связанное с преобладанием эффектов контринсулярных гормонов. Доказано, что у пациентов происходит повышение продукции адренокортикотропного и соматотропного гормонов, а также глюкокортикоидов, катехоламинов и глюкагона, это приводит к инициации целой группы метаболических и ультраструктурных процессов, вызывающих развитие метаболической кардиомиопатии.
Доказано, что у пациентов происходит повышение продукции адренокортикотропного и соматотропного гормонов, а также глюкокортикоидов, катехоламинов и глюкагона, это приводит к инициации целой группы метаболических и ультраструктурных процессов, вызывающих развитие метаболической кардиомиопатии.
Патогенез увеличения жесткости миокарда связан с нарушением транспорта кальция, электромеханическим дисбалансом, сопровождающимся асинхронностью расслабления и механическими факторами.
Патологическая анатомия
Характерен фиброз миокарда, связанный с нарушением внутриклеточного метаболизма оксида азота и кальция, а также с пролиферативными процессами, обусловленными действием инсулина и ИФР. Морфологической основой дистрофии миокарда при сахарном диабете является микроангиопатия, характеризующаяся инфильтрацией тучными клетками и фибриноидным набуханием стенок мелких сосудов. При морфологическом исследовании выявляют развитие апоптозной дегенерации, потерю синаптических пузырьков, появление больших вакуолей в цитоплазме клеток симпатических ганглиев. При гистохимическом исследовании в стенках сосудов определяются отложения гликопротеинов. На ультраструктурном уровне определяется утолщение базальной мембраны сосудистой стенки. Важное значение придают дезорганизации мышечных волокон гипертрофированного миокарда.
При гистохимическом исследовании в стенках сосудов определяются отложения гликопротеинов. На ультраструктурном уровне определяется утолщение базальной мембраны сосудистой стенки. Важное значение придают дезорганизации мышечных волокон гипертрофированного миокарда.
Клиническая картина и диагностика
Больные с ювенильным сахарным диабетом изредка отмечают колющую боль в области сердца. Возникновение тахикардии покоя связано с поражением блуждающего нерва и относительным преобладанием тонуса симпатического отдела вегетативной нервной системы. Тахикардия сопровождается неэффективными сокращениями миокарда, что приводит к истощению энергоресурсов и в конечном счете к снижению сократительной функции миокарда и развитию СН.
Размеры сердца в пределах нормы. Некоторое приглушение тонов сердца и систолический шум на верхушке чаще отмечают у болеющих сахарным диабетом более 5 лет. В дальнейшем гипергликемия и инсулинорезистентность ассоциируются с увеличением массы ЛЖ и появлением симптомов СН.
На ЭКГ отмечаются синусовая тахикардия или брадикардия, желудочковая экстрасистолическая аритмия, нарушения процессов реполяризации: смещение сегмента ST, изменение амплитуды, инверсия, уплощение, сглаженность или двухфазность зубца Т, нарушение внутрижелудочковой проводимости.
При эхоКГ-исследовании наиболее ранним признаком поражения миокарда при сахарном диабете является нарушение диастолической функции, которое отмечают у 27–69% бессимптомных больных.
При анализе крови уровень гликемии в плазме крови натощак >7,0 ммоль/л.
Лечение
Одной из основных задач лечения больных диабетической кардиомиопатией является профилактика дальнейшего прогрессирования поражения миокарда и развития СН. Важным является борьба с факторами риска: курением, ожирением, малоподвижным образом жизни, несбалансированным питанием. Рекомендации по оптимизации образа жизни должны содержать обоснование соответствующей низкокалорийной диеты для уменьшения массы тела, отказ от курения, регулярные физические нагрузки.
Важной задачей является нормализация обмена веществ, что включает достижение целевых уровней глюкозы, аглюкозурии, нормализации уровня гликированного гемоглобина. Регулярные физические нагрузки позволяют снизить резистентность к инсулину, повысить толерантность к глюкозе, способствуют утилизации глюкозы крови и свободных жирных кислот в мышцах, оказывают благоприятное влияние на функционирование сердечно-сосудистой системы.
Фармакотерапия сахарного диабета II типа направлена на усиление секреции инсулина, снижение инсулинорезистентности и представлена препаратами с различными механизмами действия: бигуаниды, производные сульфонилмочевины, глитазоны, глиниды, ингибиторы α-глюкозидазы, инсулин. Применение метформина позволяет улучшить контроль глюкозы крови у больных сахарным диабетом и способствует снижению общей смертности на 36%.
Для восстановления метаболических нарушений в миокарде назначают препараты α-липоевой кислоты, которая активирует ферменты митохондрий, увеличивает окисление глюкозы, замедляет глюконеогенез и кетогенез, как антиоксидант защищает клетки от повреждающего действия свободных радикалов. Также применяют препараты, способствующие коррекции нарушений обмена в миокарде: триметазидин, триметилгидразиния пропионат.
Также применяют препараты, способствующие коррекции нарушений обмена в миокарде: триметазидин, триметилгидразиния пропионат.
ТИРЕОТОКСИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Патогенез
Нарушение функции сердечно-сосудистой системы — появление «тиреотоксического сердца» является частым осложнением тиреотоксикоза. Изменения сердечно-сосудистой системы при тиреотоксикозе («тиреотоксическое сердце») обусловлены воздействием избыточного количества тиреоидных гормонов (L-тироксина и 3,5,3-трийод-L-тиронина) на обменные процессы в миокарде, гемодинамику и симпатическую нервную систему. Одним из важных эффектов тиреоидных гормонов является разобщение окислительного фосфорилирования, что приводит к снижению в сердечной мышце содержания АТФ и креатинфосфата. В результате происходит угнетение анаболических процессов: снижается синтез и усиливается распад гликогена и белка, снижается содержание калия в эритроцитах и других клетках. Потребление кислорода миокардом увеличивается, однако эффективность его утилизации в процессе биологического окисления снижается. При избытке тироксина нарушается проницаемость митохондриальных мембран.
При избытке тироксина нарушается проницаемость митохондриальных мембран.
Под влиянием тиреоидных гормонов происходит усиление сократительной функции миокарда, вероятно, вследствие активизации стимулирующего влияния на сердце и прямого действия тироксина на сердечную мышцу. Вследствие нарушений энергетических процессов и изменения калий-натриевого насоса происходит ускорение спонтанной деполяризации в клетках синусного узла, что обусловливает более частое образование в нем импульсов. Избыток тиреоидных гормонов изменяет симпатические и парасимпатические влияния на миокард. При высокой степени тиреотоксикоза в результате резкого снижения эффективности биологического окисления, преобладания распада белка над его синтезом снижается уровень энергетических ресурсов и пластических процессов, что приводит в конечном итоге к угнетению сократительной функции миокарда.
Гемодинамика
В основе гиперфункции сердца при тиреотоксикозе лежит повышение сократительной способности миокарда, что обусловлено как повышением активности симпатической нервной системы, так и непосредственным действием тиреоидных гормонов на миокард. При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается МОК (в основном за счет повышения ЧСС), скорость кровотока и ОЦК. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом повышается. В результате повышается пульсовое давление. Сердце испытывает диастолическую перегрузку, а правые отделы сердца еще и систолическую перегрузку, увеличенная работа сердца происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики ЛЖ работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию СН.
При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается МОК (в основном за счет повышения ЧСС), скорость кровотока и ОЦК. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом повышается. В результате повышается пульсовое давление. Сердце испытывает диастолическую перегрузку, а правые отделы сердца еще и систолическую перегрузку, увеличенная работа сердца происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики ЛЖ работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию СН.
Патологическая анатомия
Гистологические изменения миокарда при тиреотоксикозе характеризуются воспалением и дегенерацией вплоть до развития очагов некроза и фиброза. Гистологические изменения в миокарде непостоянны и неспецифичны. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем дегенеративно-склеротические. При тяжелом течении заболевания возникают дегенеративные изменения в митохондриях и их распад.
Гистологические изменения в миокарде непостоянны и неспецифичны. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем дегенеративно-склеротические. При тяжелом течении заболевания возникают дегенеративные изменения в митохондриях и их распад.
Клиническая картина и диагностика
Больные нередко жалуются на боль в области сердца, часто ноющего, колющего, нередко стенокардитического характера, а также на сердцебиение, которое возникает в состоянии покоя, но при физических нагрузках неадекватно усиливается. Больные отмечают повышенную возбудимость, потливость, мышечную слабость, тремор рук, похудение. Существенным симптомом является постоянная синусовая тахикардия, выраженность которой соответствует тяжести токсического зоба. У 10–20% больных диагностируется тахисистолическая форма фибрилляции предсердий. Характерно повышение САД, что обусловлено увеличением сердечного выброса. Одышка отмечается как при нагрузках, так и в покое. СН, в основном правожелудочковую, отмечают в 15–25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, поскольку очень быстро возникает слабость ПЖ.
Одышка отмечается как при нагрузках, так и в покое. СН, в основном правожелудочковую, отмечают в 15–25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, поскольку очень быстро возникает слабость ПЖ.
При осмотре отмечается прекардиальная пульсация и пульсация артерий. Аускультативно определяется повышение звучности сердечных тонов, особенно первого, почти всегда выслушивается систолический шум на верхушке сердца и ЛА.
На ЭКГ, кроме синусовой тахикардии или фибрилляции предсердий, отмечается повышение амплитуды зубца Р, иногда изменения комплекса QRS, снижение сегмента ST и вольтажа зубца Т.
При эхоКГ-исследовании на ранней стадии заболевания выявляют умеренную гипертрофию — утолщение задней стенки, межжелудочковой перегородки и увеличение сократительной функции ЛЖ. В дальнейшем развивается дилатация полостей сердца, увеличивается масса миокарда, уменьшается систолический и минутный объем крови, снижается сократительная функция миокарда.
В сыворотке крови определяется повышение уровней общего и свободного тироксина, трийодтиронина, снижение уровня тиреотропного гормона.
Лечение
Проводится по трем направлениям: нормализация функции щитовидной железы (достижение эутиреоидного состояния), устранение недостаточности кровообращения и восстановление синусового ритма (при фибрилляции предсердий).
Компенсация тиреотоксикоза достигается применением антитиреоидных препаратов или проведением хирургической операции или радиойодтерапии.
Для уменьшения синусовой тахикардии нецелесообразно применять сердечные гликозиды, широко назначают блокаторы β-адренорецепторов. При тахисистолической форме фибрилляции предсердий проводят комбинированное лечение антиаритмическими средствами (пропафенон) и блокаторами β-адренорецепторов, добиваясь восстановления синусового ритма или перевода фибрилляции предсердий в нормосистолическую форму.
Лечение СН не имеет специфических особенностей и обязательно должно проводиться на фоне антитиреоидной терапии. Следует учитывать, что чувствительность миокарда к гликозидам наперстянки может быть повышена.
КЛИМАКТЕРИЧЕСКАЯ (ДИСГОРМОНАЛЬНАЯ) КАРДИОМИОПАТИЯ
Эпидемиология
Изменение демографической структуры общества привело к увеличению в популяции доли женщин старшей возрастной группы (в настоящее время в мире около 500 млн женщин старше 50 лет, то есть в менопаузе).
О существовании связи между расстройством деятельности сердца и изменением функции женских половых органов известно давно. Заболевание может развиваться вследствие дефицита эстрогенов не только в климактерический период, но и у женщин молодого возраста с различными гинекологическими заболеваниями (миома матки, эндометриоз и др.), при посткастрационном и предменструальном синдромах. Климактерическая кардиомиопатия диагностируется иногда и у мужчин (климакс отмечают у 10–20% лиц мужского пола).
Патогенез
Менопауза, не являясь собственно заболеванием, приводит к нарушению эндокринного равновесия в организме и способствует развитию сердечно-сосудистых заболеваний.
В патогенезе обменных нарушений основное значение имеет нарушение активности эстрогенов, в норме благоприятно влияющих на белковый и электролитный обмен в миокарде и регулирующих симпатические влияния на сердце. При патологическом климаксе в миокарде происходят метаболические нарушения, приводящие к дистрофическим изменениям, в большинстве случаев носящим обратимый характер и лишь в некоторых случаях заканчивающимся развитием миокардиофиброза (кардиосклероза) (схема 8.2). Увеличение количества абдоминального жира и развитие абдоминального ожирения связано как с физиологическими изменениями, так и с изменениями образа жизни. Среди причин абдоминального ожирения после менопаузы можно выделить изменение баланса энергии — снижение скорости обменных процессов наряду с повышением аппетита и увеличением поступления энергии с пищей на фоне повышения тонуса симпатической нервной системы, усиления глюкокортикоидной стимуляции и падения уровня гормона роста. В основе патогенеза климактерической АГ лежит гипоэстрогения, которая сопровождается повышением возбудимости гипоталамо-гипофизарных структур, нарушением центральной и периферической регуляции сосудистого тонуса. Одним из механизмов является отсутствие в период менопаузы депрессорного эффекта фолликулярного гормона.
При патологическом климаксе в миокарде происходят метаболические нарушения, приводящие к дистрофическим изменениям, в большинстве случаев носящим обратимый характер и лишь в некоторых случаях заканчивающимся развитием миокардиофиброза (кардиосклероза) (схема 8.2). Увеличение количества абдоминального жира и развитие абдоминального ожирения связано как с физиологическими изменениями, так и с изменениями образа жизни. Среди причин абдоминального ожирения после менопаузы можно выделить изменение баланса энергии — снижение скорости обменных процессов наряду с повышением аппетита и увеличением поступления энергии с пищей на фоне повышения тонуса симпатической нервной системы, усиления глюкокортикоидной стимуляции и падения уровня гормона роста. В основе патогенеза климактерической АГ лежит гипоэстрогения, которая сопровождается повышением возбудимости гипоталамо-гипофизарных структур, нарушением центральной и периферической регуляции сосудистого тонуса. Одним из механизмов является отсутствие в период менопаузы депрессорного эффекта фолликулярного гормона.
Клиническая картина
Наиболее распространенными являются жалобы на продолжительную, почти постоянную боль в области сердца разнообразного характера, локализующуюся слева от грудины, в области верхушки. Боль не провоцируется физическим напряжением. Кардиалгия не прекращается после приема нитроглицерина. Характерно сердцебиение при нормальном пульсе, не связанное с физической нагрузкой, нередко появляется в покое.
Больные часто жалуются на ощущение неудовлетворенности вдохом, невозможность вдохнуть полной грудью, которое не связано с физическими нагрузками и часто возникает в покое.
Типичны нарушения функции вегетативной нервной системы: гиперемия или побледнение кожи, потливость, приливы крови, сердцебиение, онемение конечностей, озноб, нарушение ритма дыхания, полиурия, головокружение, нарушение терморегуляции.
Большое количество жалоб обусловлено изменениями психического состояния: эмоциональная лабильность, раздражительность, плаксивость, повышенная возбудимость, нередко подавленное настроение, страхи, ухудшение памяти. Усугубление симптомов связано с нагрузками, особенно эмоциональными.
Усугубление симптомов связано с нагрузками, особенно эмоциональными.
При патологическом климаксе нередко возникает симптоматическая АГ. Впоследствии, после исчезновения приливов крови и других проявлений климактерического синдрома, невротическое состояние может стать причиной развития гипертонической болезни.
У большинства мужчин с климактерической кардиомиопатией отмечают те или иные симптомы патологического климакса со стороны мочеполовой системы: отсутствие или снижение (редко повышение) либидо, снижение потенции. Больные часто жалуются на расстройства мочеиспускания, что обычно связано с доброкачественной гиперплазией предстательной железы.
Вазомоторный синдром проявляется в виде приливов крови, то есть внезапно возникающего ощущения жара в верхней половине туловища, коже лица, шеи, которое сменяется последовательно гиперемией и потоотделением. Наряду с приливами крови в отдельных областях тела периодически появляются парестезии: ощущение онемения, покалывания, ползания мурашек.
Климактерическая кардиомиопатия может возникнуть остро или развиваться постепенно. Характерно несоответствие между интенсивностью и длительностью болевого синдрома и удовлетворительным состоянием кровообращения.
При объективном обследовании характерно несоответствие между обилием жалоб и отсутствием клинических признаков коронарной или СН.
Диагностика
На ЭКГ самыми частыми изменениями являются снижение сегмента ST и/или инверсия зубца Т, которые в основном регистрируют в правых и средних грудных отведениях (V1–4). Зубец Т может длительное время быть отрицательным, затем положительным, а через несколько дней вновь отрицательным без какой-либо связи с клинической картиной болезни, на фоне удовлетворительного состояния больного. Изменения на ЭКГ не соответствуют клиническим проявлениям, физические нагрузки практически не влияют на конфигурацию зубцов. Часто возникают синусовая аритмия, предсердная и желудочковая экстрасистолия, пароксизмальная суправентрикулярная тахикардия. Изредка регистрируют нарушения предсердно-желудочковой и внутрижелудочковой проводимости.
Изредка регистрируют нарушения предсердно-желудочковой и внутрижелудочковой проводимости.
На ранних стадиях климактерическая кардиомиопатия протекает чаще изолированно и характеризуется типичной клинической картиной заболевания. В более поздние периоды клиническая картина зависит от присоединения ИБС, воспалительных процессов в миокарде и других болезней, что несомненно отягощает течение кардиомиопатии и ухудшает прогноз.
Лечение
Должно быть направлено на устранение всех симптомов заболевания. Важное значение имеет модификация образа жизни, включающая повышение физической активности и соблюдение диеты с ограничением потребления насыщенных жиров и увеличением в рационе доли моно- и полиненасыщенных жиров и грубой клетчатки. Для нормализации деятельности нервной системы обычно назначают седативные препараты, транквилизаторы, иногда антидепрессанты.
Для лечения АГ в постменопаузе наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Женщинам в постменопаузе должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Женщинам в постменопаузе должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Назначение заместительной гормонотерапии является патогенетически обоснованным в лечении больных с климактерической кардиомиопатией. Применяют препараты, содержащие эстрогены и гестагены. Половые гормоны подавляют повышенную активность гипоталамо-гипофизарных структур мозга и опосредованно влияют на сердце, нормализуя влияние вегетативной нервной системы. Не исключено, что половые гормоны ослабляют повышенную активность САС и тем самым нормализуют метаболические процессы в миокарде. Эстрогены оказывают непосредственное сосудорасширяющее действие на коронарные сосуды, а также нормализуют электролитный и белковый обмен в миокарде. Дозы и общая продолжительность лечения зависят от исходного гормонального фона и уровня эстрогенов, лечение следует проводить под наблюдением эндокринолога. Необходимо отметить, что климактерическая кардиомиопатия является самоизлечивающимся заболеванием, при котором гормоны оказывают лишь вспомогательное заместительное действие, гормональную терапию следует назначать на длительный срок. Лечение гормонами устраняет тягостные проявления климактерического синдрома и после окончания возрастной перестройки эндокринной системы заболевание исчезает.
Лечение гормонами устраняет тягостные проявления климактерического синдрома и после окончания возрастной перестройки эндокринной системы заболевание исчезает.
Прогноз
Как правило, благоприятный. Снижение трудоспособности в большинстве случаев носит временный характер. Полное выключение больных из привычной трудовой обстановки, как правило, играет отрицательную роль, приводит к излишней концентрации внимания на тягостных ощущениях со стороны сердца.
ПОРАЖЕНИЯ СЕРДЦА ПРИ НАРУШЕНИИ ОБМЕНА ВЕЩЕСТВ
Нарушения обмена веществ в организме всегда отражаются на течении метаболических процессов в миокарде, нередко вызывая нарушение его функции и структуры. При различных заболеваниях первоначально могут нарушаться один или несколько путей метаболизма, что в дальнейшем обязательно отражается на энергообеспечении сердечной мышцы. При некоторых нарушениях обмена в межуточной ткани миокарда и в коронарных сосудах откладываются патологические продукты нарушенного метаболизма белков, углеводов, минералов или накапливаются избыточные компоненты нормального обмена. К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и др.
К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и др.
НАРУШЕНИЯ БЕЛКОВОГО ОБМЕНА. АМИЛОИДОЗ
Определение
Амилоидоз — системное заболевание неустановленной этиологии, характеризующееся внеклеточным отложением в органах и тканях (главным образом в медии артерий, периваскулярной соединительной и нервной ткани, в ретикулоэндотелиальной системе, а также миокарде, почках, печени, коже) особого белка β-фибриллярной структуры — амилоида.
Этиология и патогенез
Амилоидоз является следствием нарушения белкового обмена и может быть приобретенным или наследственным. Наследственный амилоидоз является аутосомным доминантным заболеванием. Ряд авторов связывают развитие заболевания с изменением свойств белков тканей вследствие аутоиммунных процессов под влиянием комплекса антиген — антитело. Диспротеинемия с накоплением в плазме крови грубодисперсных фракций белка и аномальных белков (парапротеинов) ведет к выходу последних из сосудов ткани с образованием амилоидных субстанций.
В последние годы стала возможной более точная биохимическая идентификация белков, входящих в состав амилоидных фибрилл, на основании чего выделены типы амилоида, определена связь отдельных типов с клиническими формами амилоидоза, изучены белки-предшественники, предположительно участвующие в синтезе белков.
Выделяют четыре типа амилоидоза: первичный (системный), вторичный, семейный (наследственный) и сенильный (старческий).
Наиболее распространен первичный тип (85%) с преимущественным поражением сердца, при котором амилоид образован легкими цепями молекул k и λ иммуноглобулина (AL-тип), часто ассоциирован с миеломной болезнью, более часто отмечают у мужчин и редко в возрасте младше 30 лет.
Вторичный амилоидоз возникает в результате образования неиммуноглобулиновых белков, миофибриллы содержат амилоидный протеин А, не относящийся к иммуноглобулинам (АА-тип), что часто происходит при хронических воспалительных заболеваниях — ревматоидном артрите, туберкулезе, болезни Крона и при семейной средиземноморской лихорадке.
Семейный или наследственный амилоидоз чаще всего является следствием образования мутантного белка преальбумина (транстиретина). Установлен аутосомно-доминантный тип наследования. Выявлены гены, ответственные за синтез этих белков, и идентифицирован характер генных мутаций.
Сенильный кардиальный амилоидоз, также известный как амилоид SSA, возникает вследствие образования патологического транстиретина у лиц старшего возраста. Выделяют две формы связанного с возрастом амилоидоза — амилоидоз предсердий, который охватывает только предсердия, и старческий аортальный амилоидоз, ограниченный аортой.
Патологическая анатомия
Миокард при амилоидозе сердца очень плотный на ощупь, утолщенный, мало поддается растяжению. Объем полостей сердца существенно не изменен или незначительно увеличен. Амилоид откладывается в разных отделах сердца, преимущественно в миокарде предсердий и желудочков, эндокарде, в клапанах, перикарде, нередко в синусном и AV-узлах, а также в мелких артериальных и венозных сосудах, включая vasa vasorum коронарных артерий, суживая их просвет вплоть до полной обтурации. В результате мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда.
В результате мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда.
Клиническая картина
Амилоидное поражение сердца не имеет специфических симптомов, развивается постепенно и может длительное время протекать бессимптомно, даже при выявлении отложений амилоида в миокарде при биопсии. Следует обратить внимание, что во время появления симптомов существует весьма значительная инфильтрация сердца амилоидом. У некоторых пациентов возникает боль в области сердца, иногда носящая стенокардический характер как следствие накопления депозитов амилоида в коронарных артериях.
В 10–15% случаев отмечается ортостатическая гипотензия, иногда с симптомами синкопальных состояний.
При аускультации на фоне глухих тонов сердца можно выслушать систолический шум митральной регургитации, при развитии СН — протодиастолический ритм галопа.
Часто определяют различные нарушения ритма, которые нередко могут быть причиной внезапной смерти. У некоторых больных отмечается выраженная брадикардия.
У некоторых больных отмечается выраженная брадикардия.
СН выявляют у 45–56% больных. Вначале доминирует правожелудочковая СН с повышенным давлением в яремных венах, гепатомегалией, периферическими отеками, асцитом. Затем возникает систолическая дисфункция и застойная СН.
Диагностика
Изменения на ЭКГ неспецифичны, наиболее типично наличие брадикардии, снижение амплитуды зубцов. Иногда наличие патологического зубца Q и отсутствие зубца R в отведениях V1–3 симулируют ИМ. Накопление депозитов амилоида в проводящей системе могут обусловливать различные расстройства образования импульса и проведения — возможны различные нарушения проводимости, включая полную блокаду сердца: часто выявляются предсердные и желудочковые нарушения ритма (синдром слабости синусного узла, фибрилляция предсердий (у 30% больных), желудочковая экстрасистолическая аритмия).
Двухмерная эхоКГ и допплерография являются основными методами неинвазивной диагностики. При обследовании выявляют нормальные или уменьшенные размеры полости ЛЖ со значительным утолщением миокарда и характерным нарушением его структуры с диффузным гранулярным блеском (рис. 8.1а, б). Отмечается также утолщение межпредсердной перегородки и створок клапанов, увеличение предсердий, наличие небольшого или умеренного перикардиального выпота. Нарушение диастолической функции ЛЖ и ПЖ происходит по рестриктивному типу нарушения их наполнения. В тяжелых случаях выявляются признаки различной степени нарушения систолической функции обоих желудочков.
8.1а, б). Отмечается также утолщение межпредсердной перегородки и створок клапанов, увеличение предсердий, наличие небольшого или умеренного перикардиального выпота. Нарушение диастолической функции ЛЖ и ПЖ происходит по рестриктивному типу нарушения их наполнения. В тяжелых случаях выявляются признаки различной степени нарушения систолической функции обоих желудочков.
При рентгеноскопии отмечают уменьшение пульсации контура сердца, размеры сердца увеличены (кардиомегалия) и обычно не соответствуют степени тяжести застойной СН.
К достижениям последних лет относится введение в клиническую практику метода сцинтиграфии с меченным 123I сывороточным Р-компонентом (SАР) для оценки распределения амилоида в организме. Р-компонент содержится в небольшом количестве (5–10%) в амилоиде всех типов; радиоактивный SАР, введенный больному амилоидозом, специфически связывается с амилоидными депозитами и может быть визуализирован и количественно оценен на серии сцинтиграмм. Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения.
Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения.
Для диагностики также используют сцинтиграфию с изотопом технеция 99mТс-пирофосфатом, способным связываться с амилоидом многих типов, однако эта проба оказывается положительной только при значительных отложениях амилоида в сердце, которые можно определить и с помощью эхоКГ.
МРТ используется для идентификации утолщения миокарда и небольшого размера полости ЛЖ при амилоидозе, что сопоставимо с данными эхоКГ.
Диагноз «амилоидоз» должен быть подтвержден эндомиокардиальной биопсией. При изучении биоптатов тканей важно не только выявить амилоид, но и провести иммуногистохимическое исследование для идентификации его типа.
Диагноз «амилоидоз сердца» чаще устанавливают при аутопсии, поскольку при жизни в ряде случаев не выявляют объективных причин, которыми можно было бы объяснить возникновение патологических признаков.
Лечение
Терапия при первичном амилоидозе включает клеточную антиплазменную терапию, которая останавливает продукцию легких цепей, а также применение алкилирующих средств (мелфалан) и преднизолона. Благоприятный эффект химиотерапии показан в двух рандомизированных испытаниях. Перспективна трансплантация стволовых клеток с органной ремиссией в 50% случаев. Другим подходом к лечению амилоидоза сердца может быть применение талидомида с дексаметазоном. Недавно показана эффективность леналидомида.
Благоприятный эффект химиотерапии показан в двух рандомизированных испытаниях. Перспективна трансплантация стволовых клеток с органной ремиссией в 50% случаев. Другим подходом к лечению амилоидоза сердца может быть применение талидомида с дексаметазоном. Недавно показана эффективность леналидомида.
Для лечения пациентов с нарушениями ритма сердца назначают антиаритмические препараты. При явлениях полной поперечной блокады и слабости синусного узла эффективна имплантация искусственного водителя ритма. Кардиостимуляторы применяют для лечения пациентов с тяжелыми клинически выраженными нарушениями проводимости.
СН часто рефрактерна к медикаментозной терапии. Для уменьшения недостаточности кровообращения основными препаратами являются диуретики, которые применяют с осторожностью в низких дозах, и вазодилататоры — ингибиторы АПФ или блокаторы рецепторов ангиотензина II, хотя они плохо переносятся и могут вызвать значительную артериальную гипотензию или ортостатические симптомы, особенно у пациентов с амилоид-индуцированной дисфункцией автономной нервной системы. Не рекомендуется применять дигоксин из-за его токсичности и опасности развития аритмий, однако при тщательном ЭКГ-мониторировании его можно применять для контроля ритма у пациентов с фибрилляцией предсердий.
Не рекомендуется применять дигоксин из-за его токсичности и опасности развития аритмий, однако при тщательном ЭКГ-мониторировании его можно применять для контроля ритма у пациентов с фибрилляцией предсердий.
Блокаторы кальциевых каналов неэффективны в лечении при амилоидозе сердца. Больные могут быть гиперчувствительны к негативным инотропным эффектам блокаторов кальциевых каналов, их применение может привести к нарастанию симптомов декомпенсации.
Блокаторы β-адренорецепторов могут спровоцировать угрожающие жизни нарушения проводимости.
При резком снижении сократительной способности предсердий, свидетельствующем о массивной инфильтрации, даже при синусовом ритме показано применение антиагрегантов или антикоагулянтов, что обусловлено повышенным риском тромбообразования.
Трансплантация сердца обычно не проводится, поскольку возникают рецидивы амилоидоза в аллотрансплантате, а также неуклонное прогрессирование его в других органах, что сокращает продолжительность жизни больных.
Прогноз
Течение амилоидоза прогрессирующее, прогноз неблагоприятный, хотя зависит от формы, сроков диагностики и степени вовлечения жизненно важных органов. Каждый из четырех основных типов амилоидной болезни имеет различные степени вовлечения сердца, клинические симптомы и прогноз. Выживаемость больных со старческим амилоидозом намного выше, чем с первичным амилоидозом, — в среднем соответственно 60,0 и 5,5 мес со времени установления диагноза. Летальный исход (приблизительно через 1,5–2,5 года после появления первых признаков поражения сердца) обычно наступает вследствие нарушений ритма и проводимости, а также внесердечных осложнений (легочной или системной эмболии). У больных с вовлечением проводящей системы нередко возникает внезапная смерть. Самая низкая выживаемость отмечена у больных с рефрактерной к терапии застойной СН (в среднем 6 мес), особенностью которой является преимущественно правосердечный или тотальный ее тип с резким набуханием шейных вен и значительным повышением венозного давления, застойным увеличением печени и полостными отеками (гидроторакс, гидроперикард, асцит).
НАРУШЕНИЯ ПРЕИМУЩЕСТВЕННО ЛИПИДНОГО ОБМЕНА
ГОЛОДАНИЕ И КАХЕКСИЯ
Патогенез
Голодание, длительное неполноценное питание, кахексия приводят к нарушениям деятельности сердца, которые сопровождаются уменьшением массы миокарда, обычно пропорционально меньшим, чем уменьшение массы тела вследствие атрофии мышечных волокон, дегенеративным изменениям в миокарде и к СН.
Патологическая анатомия
При голодании микроскопически отмечают вакуолизацию миофибрилл, особенно вокруг ядер, изменения хроматина ядер и митохондрий. В далеко зашедших случаях выявляют бурую атрофию и дистрофические изменения миокарда.
Клиническая картина и диагностика
Основными проявлениями нарушения функции сердечно-сосудистой системы при голодании являются синусовая брадикардия, уменьшение МОК, снижение венозного давления и АД (преимущественно систолического), что нередко сопровождается головокружением, а при быстром перемещении из горизонтального положения в вертикальное — обмороком.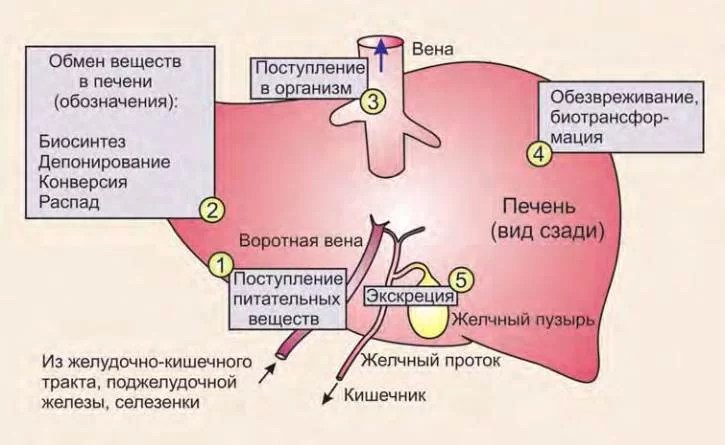 Часто возникают отеки, обусловленные гипопротеинемией и увеличением ОЦК (но не СН).
Часто возникают отеки, обусловленные гипопротеинемией и увеличением ОЦК (но не СН).
На ЭКГ отмечаются отклонение оси сердца вправо, синусовая брадикардия, низкий вольтаж зубцов, иногда изменения зубца Т и комплекса QRS, которые, по-видимому, обусловлены нарушением обмена энергии и электролитов в миокарде.
Лечение заключается в восстановлении полноценного питания.
ОЖИРЕНИЕ
Эпидемиология
Эпидемиологические исследования свидетельствуют, что ожирение связано с сердечно-сосудистыми заболеваниями и преждевременной смертностью. Ожирение само по себе приводит к комплексному и прогностически неблагоприятному поражению сердца. Вероятность развития ГЛЖ у лиц с нормальной массой тела составляет 5,5%, а у лиц с ожирением — 30%. По данным Фремингемского исследования установлено наличие высокодостоверной связи между ИМТ, полостными размерами и толщиной стенок ЛЖ.
По современным представлениям ожирение представляет собой независимый фактор риска развития СН, являясь ее причиной у 11% мужчин и 14% женщин в США. По данным Фремингемского исследования увеличение ИМТ на каждый 1 кг/м2 повышает риск развития СН на 5% у мужчин и на 7% у женщин независимо от других факторов риска.
По данным Фремингемского исследования увеличение ИМТ на каждый 1 кг/м2 повышает риск развития СН на 5% у мужчин и на 7% у женщин независимо от других факторов риска.
Этиология
Ожирение может быть самостоятельным заболеванием, возникающим вследствие избыточного потребления пищи с высокой калорийностью, или синдромом, сопровождающим различные заболевания, и развиваться вследствие ряда нейроэндокринных, социальных, поведенческих и генетических факторов. Генетические факторы играют важную роль в развитии ожирения. Результаты исследований свидетельствуют, что существует редко идентифицируемая группа генов, вызывающих значительное ожирение, однако чаще выявляют гены «восприимчивости», которые детерминируют склонность к ожирению и регулируют распределение жировой массы в организме, скорость обменных процессов и их реакцию на физическую активность и диету, контролируют пищевые привычки. Идентифицировано более 41 сайта в геноме, которые, возможно, связаны с развитием ожирения в популяции.
Патогенез
При ожирении происходит постепенное увеличение размеров клеток жировой ткани, ведущее к изменению их свойств. Гормонально-метаболические сдвиги, характерные для ожирения, могут напрямую воздействовать на структуру и массу миокарда. У пациентов с ожирением адипоциты жировой ткани высвобождают большое количество биологически активных субстанций, участвующих в регуляции сосудистого тонуса: ангиотензин II, интерлейкины, простагландины, эстрогены, ИФР, ФНО-α, ингибитор активатора плазминогена-1, лептин и другие, что повышает риск развития сердечно-сосудистых осложнений, при этом снижается уровень адипонектина, специфического циркулирующего белка жировой ткани, который вовлечен в регулирование метаболизма липидов и глюкозы (схема 8.3). Синтезируемый в жировой ткани лептин, важный маркер энергетического баланса, стимулирует гиперсимпатикотонию, способствует повышению уровня АКТГ, кортизола и альдостерона.
Ведущее значение в развитии различных форм ожирения имеют изменения функционирования гипоталамо-гипофизарной системы. Эндоканнабиноидная система, представленная в мозге (гипоталамусе) и периферически в жировой ткани (адипоцитах), печени, скелетных мышцах и пищеварительном тракте, посредством каннабиноидных рецепторов 1-го типа (СВ1) участвует в центральной и периферической регуляции энергетического баланса, а также метаболизме глюкозы и липидов, играет роль в контроле потребления пищи и массы тела. Гиперактивация этой системы ассоциирована с мотивацией к увеличенному потреблению пищи и ожирением и приводит к нарушению механизмов обратной связи, которые поддерживают устойчивый гомеостаз.
Эндоканнабиноидная система, представленная в мозге (гипоталамусе) и периферически в жировой ткани (адипоцитах), печени, скелетных мышцах и пищеварительном тракте, посредством каннабиноидных рецепторов 1-го типа (СВ1) участвует в центральной и периферической регуляции энергетического баланса, а также метаболизме глюкозы и липидов, играет роль в контроле потребления пищи и массы тела. Гиперактивация этой системы ассоциирована с мотивацией к увеличенному потреблению пищи и ожирением и приводит к нарушению механизмов обратной связи, которые поддерживают устойчивый гомеостаз.
Присоединение АГ при ожирении происходит примерно у 60% больных, механизмы ее формирования связывают с развитием гормонально-метаболических отклонений, вызванных накоплением жировой ткани. Ключевую роль среди них играет развитие инсулинорезистентности и компенсаторной гиперинсулинемии, которая, усиливая задержку натрия почками, способствует дальнейшему росту ОЦК. Гипертензивное действие может оказывать и лептин, стимулирующий симпатическую нервную систему. Ожирение, АГ, дислипидемию и гипергликемию, в основе которых лежит инсулинорезистентность, объединяют в понятие «метаболический синдром».
Ожирение, АГ, дислипидемию и гипергликемию, в основе которых лежит инсулинорезистентность, объединяют в понятие «метаболический синдром».
При высокой степени ожирения нельзя исключить определенную роль гипоксии в изменении нейроэндокринной регуляции кровообращения и в развитии дистрофии миокарда. Включение гипоксического фактора в патогенез дистрофических поражений сердца может стать существенным механизмом не только их возникновения, но и развития СН.
Гемодинамика
Сердце у больных ожирением испытывает перегрузку объемом. ОЦК и объем плазмы крови увеличиваются пропорционально степени увеличения массы тела, что приводит к увеличению наполнения ЛЖ и ударного объема, дилатации и росту массы ЛЖ. Считается, что нарастание сердечного выброса при ожирении физиологически связано с удовлетворением метаболических потребностей возросшей тканевой массы тела. Развитие сердечно-сосудистых осложнений при ожирении связано с истощением компенсаторных механизмов миокарда, обусловленным увеличением величины ОЦК, которая формируется пропорционально объему сосудистой сети периферических тканей. Нарастающее содержание жировой ткани в организме десинхронизирует физиологические взаимосвязи между сердцем и кровотоком периферических метаболически активных тканей.
Нарастающее содержание жировой ткани в организме десинхронизирует физиологические взаимосвязи между сердцем и кровотоком периферических метаболически активных тканей.
Сердечный выброс в состоянии покоя у больных с тяжелой степенью ожирения достигает 10 л/мин, причем на обеспечение кровотока в жировой ткани используется от ⅓ до ½ этого объема. Увеличенный объем крови в свою очередь увеличивает венозный возврат в ПЖ и ЛЖ, вызывая их дилатацию, увеличивая напряжение стенки. Это приводит к ГЛЖ, которая сопровождается снижением диастолической податливости камеры, приводя к повышению давления наполнения ЛЖ и его расширению.
Увеличение толщины миокарда снижает чрезмерное напряжение его волокон, что позволяет сохранить нормальную сократительную способность ЛЖ, одновременно создает предпосылки для диастолической дисфункции, в основе которой лежит относительное уменьшение количества капилляров на единицу объема мышечной ткани и ухудшение условий диффузии кислорода в гипертрофированных мышечных волокнах. По мере прогрессирования дилатации ЛЖ увеличение напряжения стенки приводит к систолической дисфункции.
По мере прогрессирования дилатации ЛЖ увеличение напряжения стенки приводит к систолической дисфункции.
Патологическая анатомия
При ожирении отмечают увеличенное отложение жировой ткани под эпикардом обоих желудочков и в поверхностных слоях миокарда, что со временем приводит к атрофии мышечных волокон, замещению их жировой тканью (cor adiposum). Миокард на разрезе имеет желтоватый оттенок. Выявляют наличие диффузной мышечной гипертрофии, которая является наиболее характерным проявлением ожирения со стороны сердечно-сосудистой системы.
Клиническая картина
У взрослого ожирение устанавливают при ИМТ >30,0 кг/м2. Клинически выраженные расстройства кровообращения развиваются у больных с ИМТ >40,0 кг/м2.
Жалобы на боль в сердце ноющего, колющего характера, сердцебиение и перебои в работе сердца при физических нагрузках. По мере накопления избыточной массы тела постепенно развивается прогрессирующая одышка при нагрузках, возникает ортопноэ и пароксизмальная ночная одышка, появляются отеки нижних конечностей, возможно увеличение живота в объеме.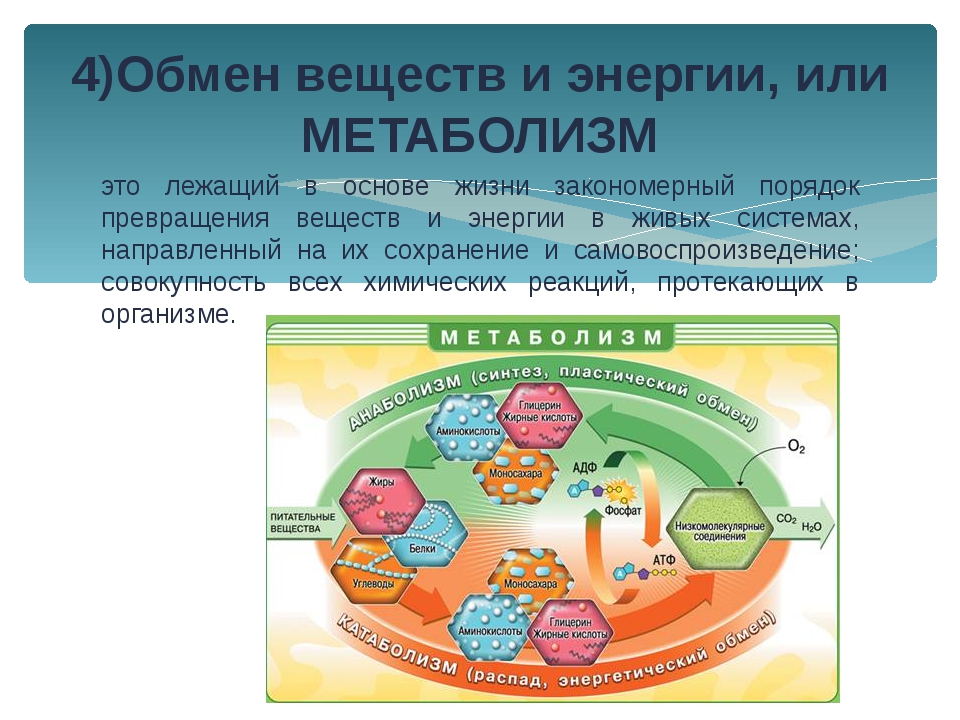
Во многих проспективных исследованиях установлено, что увеличение массы тела приводит к повышению АД. У больных с ожирением высок риск присоединения ИБС, течение которой особенно агрессивно и тяжело.
Сердце принимает «поперечное» положение из-за высокого стояния диафрагмы, смещаясь влево и несколько кзади. Аускультативно определяется выраженная глухость тонов. Пульс имеет склонность к учащению.
При крайних степенях ожирения иногда отмечают клинический синдром, проявляющийся сочетанием сонливости, альвеолярной гиповентиляции и легочной гипертензии с гипертрофией ПЖ — синдром Пиквика.
Диагностика
На ЭКГ обычно синусовая тахикардия, отклонение электрической оси сердца влево, снижение сегмента ST в I–II и V5–6 отведениях, уплощенный и отрицательный зубец Т. У некоторых больных регистрируется низкоамплитудный зубец РІІІ и глубокий QІІІ. Отмечаются признаки ГЛЖ.
При эхоКГ-исследовании выявляют гипертрофию и дилатацию ЛЖ, увеличение левого предсердия, диаметра восходящей аорты. С помощью допплеровской эхоКГ выявляют признаки диастолической дисфункции, может определяться аортальная регургитация. В последующем происходит нарушение и систолической функции. Возможно расслоение листков перикарда за счет отложения жира. Проведение эхоКГ-исследования часто затруднено из-за большой толщины грудной клетки, сужения межреберных промежутков, смещения сердца кзади.
С помощью допплеровской эхоКГ выявляют признаки диастолической дисфункции, может определяться аортальная регургитация. В последующем происходит нарушение и систолической функции. Возможно расслоение листков перикарда за счет отложения жира. Проведение эхоКГ-исследования часто затруднено из-за большой толщины грудной клетки, сужения межреберных промежутков, смещения сердца кзади.
При изучении гемодинамических показателей у всех пациентов выявлено увеличение ОЦК, что сопровождается нарастанием ригидности миокарда ЛЖ, ростом давления его наполнения и УОК. С увеличением степени ожирения повышается конечное диастолическое давление в ПЖ, среднее давление в ЛА, давление заклинивания в легочных капиллярах и конечное диастолическое давление в ЛЖ. Эти изменения вызывают расширение полостей левого предсердия, ПЖ и правого предсердия. Давление крови в ПЖ, как правило, также повышено.
Рентгенологическая картина всегда изменена вследствие высокого стояния диафрагмы и скопления жира в области верхушки сердца, что создает картину его кажущегося увеличения. Пульсация вялая, тонус сердца понижен.
Пульсация вялая, тонус сердца понижен.
Лечение
Начальные дистрофические изменения миокарда при ожирении являются в значительной мере обратимыми при нормализации массы тела. Первоочередным этапом лечения является коррекция пищевых привычек и повышение физической активности. Специфические рекомендации включают 30 мин физической активности по крайней мере 5 раз в неделю, уменьшение калорийности пищи в среднем до 1500 ккал/сут, снижение потребления жиров до 30–35% дневной энергетической ценности (с оговоркой 10% для мононенасыщенных жирных кислот, например оливковое масло), отказ от трансгенных жиров, увеличение потребления продуктов, содержащих волокна, до 30 г/сут и отказ от жидких моно-и дисахаридов.
Для уменьшения массы тела применяют медикаментозные и хирургические методы лечения ожирения. Назначают ингибиторы липаз (средства периферического действия) и анорексигенные средства (центрального действия).
Лечение сердечно-сосудистых расстройств у больных с ожирением зависит от характера поражения сердца. Для лечения АГ наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Для лечения АГ наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
При наличии признаков СН лечение проводят в соответствии с современными рекомендациями.
АЛКОГОЛЬНАЯ КАРДИОМИОПАТИЯ
Эпидемиология
Одна из форм алкогольного поражения сердца, отмечается у 50% лиц, на протяжении длительного времени злоупотребляющих алкоголем.
Алкогольную кардиомиопатию выявляют приблизительно у ⅓ всех больных с неишемической кардиомиопатией, 40–50% больных умирают в течение 3–6 лет.
Этиология
Этиологическим фактором является этанол и/или его метаболиты. Развитие алкогольной кардиомиопатии могут обусловить стрессовые состояния, недостаточность питания (дефицит белков, витаминов), наследственная предрасположенность, вирусная инфекция на фоне снижения иммунитета, изменения исходного состояния миокарда. Не всегда отмечается отчетливый параллелизм между количеством употребляемого этанола, длительностью интоксикации и выраженностью поражения сердца.
Не всегда отмечается отчетливый параллелизм между количеством употребляемого этанола, длительностью интоксикации и выраженностью поражения сердца.
Патогенез
Основной из метаболитов этанола, ацетальдегид, оказывает прямое повреждающее воздействие на клеточные и субклеточные мембраны кардиомиоцитов, связанное с их способностью растворять липиды и увеличивать текучесть биологических мембран. На определенном этапе интоксикации это может вызывать нарушение обмена веществ в миокарде и ингибирование основных путей утилизации энергии в клетках сердца, в результате угнетения функции дыхательной цепи митохондрий возникает гипоксия миокарда. Опосредованное воздействие происходит в результате влияния алкоголя на различные отделы нервной системы и функцию надпочечников.
Патологическая анатомия
Длительное употребление алкоголя вызывает жировую инфильтрацию миокарда, дегенеративные изменения в стенках коронарных артерий и нейронах, расположенных в сердце. При микроскопическом исследовании отмечают исчезновение поперечной исчерченности миофибрилл, пикноз ядер, интерстициальный отек, вакуольную и жировую дистрофию, иногда единичные или множественные очаги некроза, мелкие участки фиброза.
Клиническая картина
Как правило, больные упорно отрицают злоупотребление алкоголем.
Развернутую клиническую картину с явлениями СН, стойкими нарушениями ритма и проводимости, тромбоэмболическими осложнениями, кардиомегалией выявляют редко.
Первым клиническим проявлением наиболее часто бывают нарушения ритма без признаков застойной СН. Развитие заболевания имеет несколько стадий — от функциональных расстройств, нарушений ритма сердца преходящего характера до стойкой гипертрофии миокарда с последующим развитием СН.
К наиболее частым и типичным клиническим симптомам относят:
- возбуждение, тремор рук, суетливость, многословность;
- ощущение нехватки воздуха, кардиалгию, тахикардию;
- похолодение конечностей;
- ощущение жара во всем теле, гиперемию кожи лица, инъецированность склер;
- потливость;
- повышение АД.
Начальными признаками заболевания принято считать сердцебиение и одышку при физической нагрузке. На более поздних стадиях заболевания состояние пациентов постепенно ухудшается.
На более поздних стадиях заболевания состояние пациентов постепенно ухудшается.
Диагностика
На ЭКГ характерными изменениями являются укорочение интервала Р–Q, удлинение интервала Q–T в сочетании с небольшой элевацией сегмента ST и заостренным высоким с широким основанием зубцом Т, синусовая аритмия, бради- или тахикардия. Нередко нарушения ритма (предсердная и желудочковая экстрасистолическая аритмия, фибрилляция предсердий) и проводимости (атриовентрикулярная и внутрижелудочковая блокады) возникают после длительного и/или однократного употребления большого количества алкоголя (синдром «праздничного» сердца).
О наличии алкогольной кардиомиопатии может свидетельствовать отсутствие определенной причины фибрилляции предсердий (тиреотоксикоз, ревматический порок сердца) у мужчин молодого возраста.
Диагностику затрудняет и отсутствие маркеров алкогольного поражения сердца.
Диагностировать алкогольную кардиомиопатию легче в том случае, если в анамнезе имеются указания на длительное употребление алкоголя и определяются клинические признаки кардиомегалии, аритмии или застойной СН при отсутствии других причин, способных привести к аналогичным нарушениям сердечной деятельности.
При эхоКГ-исследовании отмечается дилатация полости ЛЖ, снижение его сократительной способности, возможна диффузная гипоксия. При допплеровском исследовании могут выявляться признаки митральной регургитации.
Лечение
При лечении обязательно исключают употребление алкоголя. Полная абстиненция может остановить прогрессирование поражения сердца на ранних этапах (обычно в первые 2–6 мес).
На ранних стадиях без проявлений СН и при наличии кардиалгии, тахикардии, АГ и аритмии рекомендованы блокаторы β-адренорецепторов. При выраженной кардиомегалии следует назначать сердечные гликозиды, однако строго контролировать их прием в целях предупреждения кардиотоксического эффекта. В комплексное лечение включают мочегонные средства, витамины, анаболические гормоны, соли калия и магния.
Прогноз
При полном отказе от употребления спиртных напитков и под влиянием лечения размеры сердца у больных с алкогольной кардиомиопатией нередко уменьшаются. Восстановление основных функций миокарда и улучшение общего состояния наступают очень медленно, сроки относительного выздоровления исчисляются месяцами и годами.
ЛИТЕРАТУРА
- Александров А.А., Кухаренко С.С. (2006) Миокардиальные проблемы ожирения. Рос. кардиол. журн., 2: 11-17.
- Артемчук А.Ф. (2000) Клинические особенности и терапия сердечно-сосудистых нарушений при алкоголизме. Укр. кардіол. журн., 4: 68-71.
- Ефимов А.С., Соколова Л.К., Рыбченко Ю.Б. (2005) Сахарный диабет и сердце. Мистецтво лікування, 34: 44-49.
- Зубкова С.Т., Тронько Н.Д. (2006) Сердце при эндокринных заболеваниях. Библиотечка практикующего врача, Киев, 200 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Моисеев В.С., Сумароков А.В. (2001) Болезни сердца. Универсум паблишинг, Москва, с. 369-378.
- Alpert M.A. (2001) Obesity cardiomyopathy: pathophysiology and evolution of the clinical syndrome. Amer. J. Med. Sci., 321: 225-236.
- Bartnik M., Van der Berghe G., Betteridge J. et al. (2007) Guidelines on diabetes, pre-diabetes and cardiovascular diseases.
 Eur. Heart J., 28: 88-136.
Eur. Heart J., 28: 88-136. - Cooper L.T., Baughman K.L., Feldman A.M. (2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Eur. Heart J., 28: 3077-3093.
- Cote M., Matias I., Lemieux I. et al. (2007) Circulating endocannabinoid levels, abdominal adiposity and related cardiometabolic risk factors in obese men. Int. J. Obes. (Lond), 31: 692-699.
- Di Marzo V., Matias I. (2005) Endocannabinoid control of food intake and energy balance. Nature Neuroscience, 8: 585-589.
- Falk R.H. (2005) Diagnosis and management of the cardiac amyloidoses. Circulation, 112: 2047-2060.
- Fauchier L. (2003) Alcoholic cardiomyopathy and ventricular arrhythmias. Chest., 123: 1320-1325.
- Galinier M., Pathak K., Roncalli J. et al. (2005) Obesity and cardiac failure. Arch. Mal. Coeur. Vaiss., 98: 39-45.
- Gertz M.A., Blood E., Vesole D.H. et al. (2004) A multicenter phase 2 trial of stem cell transplantation for immunoglobulin light-chain amyloidosis (E4A97): An Eastern Cooperative Oncology Group Study.
 Bone Marrow Transplant., 34: 149-154.
Bone Marrow Transplant., 34: 149-154. - Hemery Y., Broustet H., Guiraude O. et al. (2000) Alcohol and rhythm disorders. Ann. Cardiol. Angeiol., 49: 473-479.
- Huss J.M., Kelly D.P. (2005) Mitochondrial energy metabolism in heart failure: a question of balance. J. Clin. Invest., 115: 547-555.
- Ingwall J.S., Weiss R.G. (2004) Is the failing heart energy starved? On using chemical energy to support cardiac function. Circ. Res., 95: 135-145.
- Katz A.M. (2006) Physiology of the heart. 4th ed. Williams&Wilkins, Lippincot, 644 p.
- Kholova I., Niessen H.W. (2005) Amyloid in the cardiovascular system: a review. J. Clin. Pathol., 58: 125-133.
- Maceira A.M., Joshi J., Prasad S.K. et al. (2005) Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation, 111: 186-193.
- Matias I., Gonthier M.P., Orlando P. et al. (2006) Regulation, function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia.
 J. Clin. Endocrinol. Metab., 91: 3171-3180.
J. Clin. Endocrinol. Metab., 91: 3171-3180. - Miller S.R., SekijimaY., Kelly J.W. (2004) Native state stabilization by NSAIDs inhibits transthyretin amyloidogenesis from the most common familial disease variants. Lab. Invest., 84: 545-552.
- Murtagh B., Hammill S.C., Gertz M.A. et al. (2005) Electrocardiographic findings in primary systemic amyloidosis and biopsy-proven cardiac involvement. Amer. J. Cardiol., 95: 535-537.
- Poirier P., Giles T.D., Bray G.A. et al. (2006) Obesity and cardiovascular disease: pathophysiology, evaluation and effect of weight loss. Circulation,113: 898-918.
- Rajkumar S.V., Dispenzieri A., Kyle R.A. (2006) Monoclonal gammopathy of undetermined significance, Waldenstrom macroglobulinemia, AL amyloidosis, and related plasma cell disorders: Diagnosis and treatment. Mayo Clin. Proc., 81: 693-703.
- Rutter M.K., Parise H., Benjamin E.J. et al. (2003) Impact of glucose intolerance and insulin resistance on cardiac structure and function: sex-related differences in the Framingham Heart Study.
 Circulation, 107: 448-454.
Circulation, 107: 448-454. - Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams& Wilkins, Lippincott, 1628 p.
- Torp-Pedersen C., Caterson I., Coutinho W. et al. (2007) Cardiovascular responses to weight management and sibutramine in high-risk subjects: an analysis from the SCOUT trial. Eur. Heart J., 28: 2915-2923.
- Trayhurn P., Wood I.S. (2004) Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br. J. Nutr., 92: 347-355.
Нарушение обмена веществ у новорожденных — лечение в Москве
Токсико-метаболические поражения – нарушения, связанные с обменом веществ ребенка во внутриутробном периоде.
Причины и последствия
К токсико-метаболическим нарушениям плода приводят хронические заболевания матери, неправильное питание, вредные привычки, употребление токсических веществ и медикаментов, запрещенных для беременных.
Все это может привести к развитию у ребенка желтухи, гипогликемии, гипокальциемии, гипонатриемии, угнетению центральной нервной системы токсическими веществами.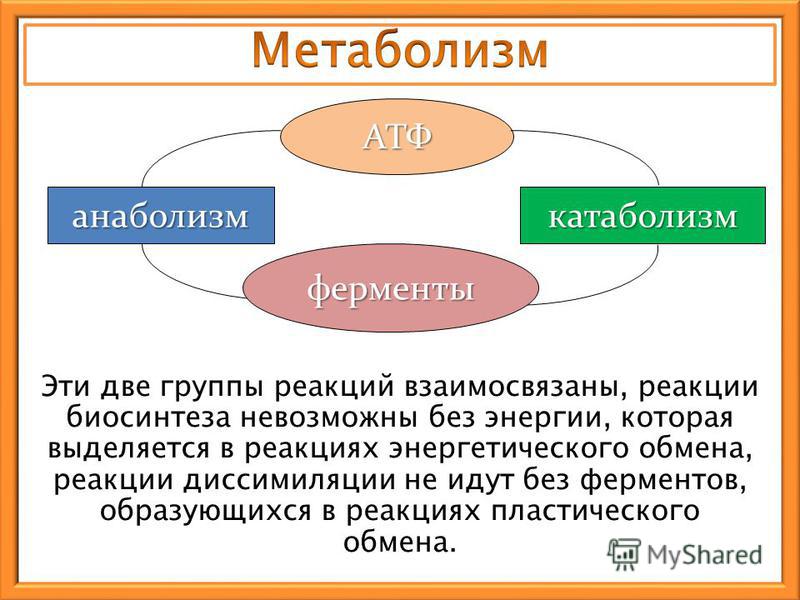 В свою очередь эти метаболические отклонения влияют на формирование центральной системы. У ребенка могут наблюдаться повышение или снижение мышечного тонуса и рефлексов, тремор, дрожание, нарушение сна, судороги, задержка психического, моторного и речевого развития, церебрастенический синдром (апатия, сонливость, повышенная утомляемость, снижении памяти, перепады настроения).
В свою очередь эти метаболические отклонения влияют на формирование центральной системы. У ребенка могут наблюдаться повышение или снижение мышечного тонуса и рефлексов, тремор, дрожание, нарушение сна, судороги, задержка психического, моторного и речевого развития, церебрастенический синдром (апатия, сонливость, повышенная утомляемость, снижении памяти, перепады настроения).
Наиболее распространенным последствием перенесенного токсико-метаболического поражения у детей является СДВГ — синдром дефицита внимания и гиперактивности. Проявляется он в агрессивности, импульсивности, трудностями концентрации и поддержания внимания. Такому ребенку тяжело учиться и усваивать школьную программу, могут возникать социальные конфликты со сверстниками.
Диагностика
Токсико-метаболические поражения центральной нервной системы у детей требуют комплексного подхода в диагностике и терапии. Прежде всего детский невролог устанавливает причины повреждения, имеющиеся синдромы и степень тяжести неврологических последствий. В диагностике применяются визуализационные методы исследования – МРТ, КТ, а также УЗИ головного мозга – нейросонография, которая позволяет оценить состояние тканей мозга и ликворные пространства. В дальнейшем, для ребенка разрабатывается индивидуальная программа нейрореабилитации и психолого-педагогической коррекции. Проводятся мероприятия по развитию моторики и речи у ребенка с логопедом.
Лечение
Лечебная гимнастика, иглорефлексотерапия, массаж позволят нормализовать тонус мышц, восстановить обменные процессы, укрепить общее состояние организма. Остеопатическое лечение может быть показано при наличии синдрома гипервозбудимости. При нарушении социализации ребенка необходимы занятия с детским психологом, направленные на адаптацию ребенка к школе. Важно, также, самим родителям принимать активное участие в восстановлении ребенка – наладить режим дня, питания, следить за увлечениями ребенка, ограничивать использование ребенком компьютеров, игровых приставок и прочих цифровых средств.
9 ошибок любителей диет, вызывающих замедление метаболизма
Обмен веществ у каждого человека протекает по-своему. Однако зависимость между скоростью этого процесса и избавлением от лишнего веса все-таки есть у всех. К сожалению, люди, склонные пробовать на себе многочисленные «чудодейственные» диеты, далеко не всегда учитывают это обстоятельство и с самыми решительными намерениями
начинают питаться так, что искусственно тормозят свой метаболизм вместо того, чтобы его ускорить. Кроме разочарования, неправильно подобранная система питания может нанести существенный вред здоровью.
Давайте рассмотрим наиболее распространенные ошибки, связанные с таким неудачным выбором.
Отказ от чая и кофе
Эти напитки для желающих похудеть ассоциируются с «вкусняшками», которые традиционно являются составляющей любой чае- или кофепаузы. Кроме того, многие предпочитают чай или кофе с сахаром. На деле как раз выпечка, конфеты и прочие сладости (включая сахар) способствуют набору лишнего веса, а сами напитки, напротив, имеют свойство подстегивать метаболизм. Установлено, что одна чашка кофе ускоряет обмен веществ на 5-8%, а чашка крепкого чая – на 12%.
Голодание
Полный отказ от еды сторонники диет обычно объясняют необходимостью очищения организма от шлаков. Но длительное голодание приводит к двум одинаково вредным последствиям. С одной стороны, органы и ткани организма как бы теряют навык усвоения питательных веществ. Это чревато развитием дефицита мышечной массы, обезвоживанием, нарушением
гормонального баланса и торможением обмена веществ. С другой – организм воспринимает прекращение поступления пищи как форс-мажор и при выходе из «голодной» диеты начинает срочно накапливать источники энергии (а именно жиры) на случай повторения только что испытанного стресса. Оба варианта чреваты не снижением веса, а его набором.
Употребление теплой воды
Наш организм в любой ситуации должен получать достаточное количество жидкости, а при диете – тем более. Для похудения лучше всего пить обычную воду. Это известно всем, но немногие знают, что жидкость потребляемая в течение дня, должна быть преимущественно холодной. Именно в таком виде она способствует ускорению метаболизма, а теплая
вода в этом смысле бесполезна.
Ограничение количества белка
Это одна из самых опасных ошибок, которую может совершить человек, мечтающий похудеть. При дефиците белка нарушается работа почти всех органов и систем, возникают гормональные сбои, прекращается усвоение питательных веществ, снижается интенсивность метаболизма. Кроме того тормозятся процессы восстановления мышечной ткани, практически целиком состоящей из белка. На практике это означает не только снижение трудоспособности, но и проблемы с перенесением физических нагрузок. А так как для ускорения обмена веществ нужно заниматься физкультурой,
плаванием, ходьбой на свежем воздухе, то для похудения диета с пониженным содержанием белков противопоказана.
При формировании рациона следует помнить, что его белковая составляющая должна быть как можно более разнообразной. Переход исключительно на белки, содержащиеся в растениях (орехах, бобовых и т. д.), может скверно отразиться на состоянии здоровья: эти продукты не содержат необходимых человеку аминокислот.
Отказ от углеводов
Большинство диет основаны на серьезном уменьшении доли углеводов в рационе. Но отказываться от всех продуктов, содержащих углеводы нельзя. Замедляют метаболизм только простые углеводы, которыми богаты мучные и кондитерские изделия, сахар, конфеты, варенье, а также виноград. Цельнозерновые каши, специальные виды хлеба, макаронные изделия из твердых сортов пшеницы, овощи и фрукты доставляют в организм сложные углеводы, в том числе клетчатку, без которой нормальная работа кишечника невозможна, а значит, обеспечены проблемы с обменом веществ.
Полный отказ от углеводов допускается только на несколько дней и под контролем врача. Если углеводное голодание продолжается больше недели, может произойти серьезный сбой метаболизма, что впоследствии потребует длительного лечения.
Исключение из рациона продуктов, богатых железом
Железо содержится в продуктах, которые часто исключаются из меню из-за их высокой калорийности (например, бобовые, мясо, печень). Так поступать не стоит, поскольку именно этот микроэлемент способствует ускорению обменных процессов в организме. Кроме того, при дефиците железа угнетается кроветворная функция, что может сильно ослабить организм и помешать активным занятиям спортом, необходимым для похудения.
Ограничение употребления молочной пищи
Нормальный обмен веществ требует достаточно кальция, а его человек в значительной степени получает из молочных продуктов. Ограничивать их потребление вредно, но можно без всяких последствий для фигуры отдать предпочтение обезжиренным сортам, имеющим минимальную калорийность.
Искусственное создание дефицита витамина D
Этим витамином богаты жирные сорта рыбы (тунец, лосось), куриные яйца и морепродукты. Дефицит витамина D ведет к ослаблению иммунитета и понижению концентрации кальция в крови, что, в свою очередь, снижает скорость метаболизма. Хроническая нехватка этого вещества может привести к развитию болезни Крона, которая проявляется в виде воспалительного процесса, захватывающего большую часть кишечника.
Употребление алкоголя
Спиртные напитки очень калорийны. При их употреблении организм использует в качестве топлива получаемые быстрые углеводы вместо того, чтобы сжигать жировые запасы. А еще возлияния сопровождаются неконтролируемым потреблением различных закусок, которые, как правило, не имеют ничего общего со здоровой и низкокалорийной пищей.
Итак, при составлении рациона, способствующего похудению, необходимо учитывать не только количество и калорийность продуктов, но и влияние содержащихся в них веществ на скорость метаболизма. В этом случае диета будет более эффективной и не нанесет вреда здоровью.
Врач лабораторной диагностики ЦДЛ
Новополоцкой городской больницы
Мясникова Н.М.
Его величество метаболизм. Вся правда об обмене веществ от тяжелоатлета
От ленивца до колибри
Обмен веществ – процесс, который объединяет все живые существа на нашей планете. Например, ленивец не только самый медлительный из животных, но и лидер по медленному темпу метаболизма. А самый быстрый обмен веществ у малютки колибри.
Биологи делят процессы обмена веществ на два типа. Первый – базальный – обеспечивает организму получение энергии, необходимой для поддержания жизнедеятельности в состоянии покоя (переваривание пищи, кровоснабжение, дыхание и т. п.). Он происходит даже во сне и потребляет до 70 % всех калорий, поступающих в организм. Второй тип – дополнительный – связан с любой активностью, отличной от состояния покоя.
Есть ли у человека инструменты, чтобы влиять на процесс обмена веществ? Ведь если метаболизм быстрый, то можно позволить себе есть больше, не беспокоясь о фигуре. Попробуем разобраться, от чего зависят эти процессы.
Во‑первых, возраст. Считается, что с годами метаболизм замедляется, поэтому всё сложнее оставаться в хорошей физической форме. Вроде бы и питание то же, что и раньше, а лишний вес будто прилипает к человеку. Обратимся к цифрам: по данным исследователя Эрика Полмана, начиная с 20 лет метаболизм снижается на 1–2 % каждые 10 лет. Если принимать за норму средний уровень базального метаболизма в 1200 ккал, то получим снижение на 12–24 ккал в день на каждое десятилетие. Выходит, что если даже повезёт дожить до 80 лет, то метаболизм снизится в среднем на 120 ккал в день.
Тогда почему с возрастом нам всё сложнее сохранять хорошую внешнюю композицию тела? Всё просто: в 40 лет мы уже не так активны, как в 30. Мотивации меньше, хочется большего комфорта, становится лень лишний раз двигаться, куда‑то бежать и что‑то делать.
Во‑вторых, питание. Бытует мнение, что если питаться часто, но понемногу, можно разогнать метаболизм в организме. Правда ли это? Исследования учёных пока не подтверждают эту теорию. Для метаболизма нет никакой разницы, съедите вы ваш дневной рацион маленькими порциями либо проглотите всё одним махом.
В‑третьих, тренировки. «Нужно просто больше тренироваться! – считают некоторые эксперты из мира тяжёлой атлетики. – Чем больше у тебя мышц, тем быстрее метаболизм!» Отнюдь. Лишь самые экстремальные случаи набора мышц могут заметно ускорить метаболизм. Давайте снова обратимся к цифрам: набор каждых 2 кг мышц увеличивает обмен веществ в состоянии покоя всего на 30 ккал в день. А дополнительный расход на восстановление после силовой тренировки занимает примерно 100–150 ккал в сутки, что эквивалентно паре съеденных яблок.
Борис Ховрах / Фото: личный архив
МЕТАБОЛИЗМ | Энциклопедия Кругосвет
Содержание статьиМЕТАБОЛИЗМ, или обмен веществ, химические превращения, протекающие от момента поступления питательных веществ в живой организм до момента, когда конечные продукты этих превращений выделяются во внешнюю среду. К метаболизму относятся все реакции, в результате которых строятся структурные элементы клеток и тканей, и процессы, в которых из содержащихся в клетках веществ извлекается энергия. Иногда для удобства рассматривают по отдельности две стороны метаболизма – анаболизм и катаболизм, т.е. процессы созидания органических веществ и процессы их разрушения. Анаболические процессы обычно связаны с затратой энергии и приводят к образованию сложных молекул из более простых, катаболические же сопровождаются высвобождением энергии и заканчиваются образованием таких конечных продуктов (отходов) метаболизма, как мочевина, диоксид углерода, аммиак и вода.
Термин «обмен веществ» вошел в повседневную жизнь с тех пор, как врачи стали связывать избыточный или недостаточный вес, чрезмерную нервозность или, наоборот, вялость больного с повышенным или пониженным обменом. Для суждения об интенсивности метаболизма ставят тест на «основной обмен». Основной обмен – это показатель способности организма вырабатывать энергию. Тест проводят натощак в состоянии покоя; измеряют поглощение кислорода (О2) и выделение диоксида углерода (СО2). Сопоставляя эти величины, определяют, насколько полно организм использует («сжигает») питательные вещества. На интенсивность метаболизма влияют гормоны щитовидной железы, поэтому врачи при диагностике заболеваний, связанных с нарушениями обмена, в последнее время все чаще измеряют уровень этих гормонов в крови. См. также ЩИТОВИДНАЯ ЖЕЛЕЗА.
Методы исследования.
При изучении метаболизма какого-нибудь одного из питательных веществ прослеживают все его превращения от той формы, в какой оно поступает в организм, до конечных продуктов, выводимых из организма. В таких исследованиях применяется крайне разнообразный набор биохимических методов.
Использование интактных животных или органов.
Животному вводят изучаемое соединение, а затем в его моче и экскрементах определяют возможные продукты превращений (метаболиты) этого вещества. Более определенную информацию можно получить, исследуя метаболизм определенного органа, например печени или мозга. В этих случаях вещество вводят в соответствующий кровеносный сосуд, а метаболиты определяют в крови, оттекающей от данного органа.
Поскольку такого рода процедуры сопряжены с большими трудностями, часто для исследования используют тонкие срезы органов. Их инкубируют при комнатной температуре или при температуре тела в растворах с добавкой того вещества, метаболизм которого изучают. Клетки в таких препаратах не повреждены, и так как срезы очень тонкие, вещество легко проникает в клетки и легко выходит из них. Иногда затруднения возникают из-за слишком медленного прохождения вещества сквозь клеточные мембраны. В этих случаях ткани измельчают, чтобы разрушить мембраны, и с изучаемым веществом инкубируют клеточную кашицу. Именно в таких опытах было показано, что все живые клетки окисляют глюкозу до СО2 и воды и что только ткань печени способна синтезировать мочевину.
Использование клеток.
Даже клетки представляют собой очень сложно организованные системы. В них имеется ядро, а в окружающей его цитоплазме находятся более мелкие тельца, т.н. органеллы, различных размеров и консистенции. С помощью соответствующей методики ткань можно «гомогенизировать», а затем подвергнуть дифференциальному центрифугированию (разделению) и получить препараты, содержащие только митохондрии, только микросомы или прозрачную жидкость – цитоплазму. Эти препараты можно по отдельности инкубировать с тем соединением, метаболизм которого изучается, и таким путем установить, какие именно субклеточные структуры участвуют в его последовательных превращениях. Известны случаи, когда начальная реакция протекает в цитоплазме, ее продукт подвергается превращению в микросомах, а продукт этого превращения вступает в новую реакцию уже в митохондриях. Инкубация изучаемого вещества с живыми клетками или с гомогенатом ткани обычно не выявляет отдельные этапы его метаболизма, и только последовательные эксперименты, в которых для инкубации используются те или иные субклеточные структуры, позволяют понять всю цепочку событий.
Использование радиоактивных изотопов.
Для изучения метаболизма какого-либо вещества необходимы: 1) соответствующие аналитические методы для определения этого вещества и его метаболитов; и 2) методы, позволяющие отличать добавленное вещество от того же вещества, уже присутствующего в данном биологическом препарате. Эти требования служили главным препятствием при изучении метаболизма до тех пор, пока не были открыты радиоактивные изотопы элементов и в первую очередь радиоактивный углерод 14C. С появлением соединений, «меченных» 14C, а также приборов для измерения слабой радиоактивности эти трудности были преодолены. Если к биологическому препарату, например к суспензии митохондрий, добавляют меченную 14C жирную кислоту, то никаких специальных анализов для определения продуктов ее превращений не требуется; чтобы оценить скорость ее использования, достаточно просто измерять радиоактивность последовательно получаемых митохондриальных фракций. Эта же методика позволяет легко отличать молекулы радиоактивной жирной кислоты, введенной экспериментатором, от молекул жирной кислоты, уже присутствовавших в митохондриях к началу эксперимента.
Хроматография и электрофорез.
В дополнение к вышеупомянутым требованиям биохимику необходимы и методы, позволяющие разделять смеси, состоящие из малых количеств органических веществ. Важнейший из них – хроматография, в основе которой лежит феномен адсорбции. Разделение компонентов смеси проводят при этом либо на бумаге, либо путем адсорбции на сорбенте, которым заполняют колонки (длинные стеклянные трубки), с последующей постепенной элюцией (вымыванием) каждого из компонентов.
Разделение методом электрофореза зависит от знака и числа зарядов ионизированных молекул. Электрофорез проводят на бумаге или на каком-нибудь инертном (неактивном) носителе, таком, как крахмал, целлюлоза или каучук.
Высокочувствительный и эффективный метод разделения – газовая хроматография. Им пользуются в тех случаях, когда подлежащие разделению вещества находятся в газообразном состоянии или могут быть в него переведены.
Выделение ферментов.
Последнее место в описываемом ряду – животное, орган, тканевой срез, гомогенат и фракция клеточных органелл – занимает фермент, способный катализировать определенную химическую реакцию. Выделение ферментов в очищенном виде – важный раздел в изучении метаболизма.
Сочетание перечисленных методов позволило проследить главные метаболические пути у большей части организмов (в том числе у человека), установить, где именно эти различные процессы протекают, и выяснить последовательные этапы главных метаболических путей. К настоящему времени известны тысячи отдельных биохимических реакций, изучены участвующие в них ферменты.
Клеточный метаболизм.
Живая клетка – это высокоорганизованная система. В ней имеются различные структуры, а также ферменты, способные их разрушить. Содержатся в ней и крупные макромолекулы, которые могут распадаться на более мелкие компоненты в результате гидролиза (расщепления под действием воды). В клетке обычно много калия и очень мало натрия, хотя клетка существует в среде, где натрия много, а калия относительно мало, и клеточная мембрана легко проницаема для обоих ионов. Следовательно, клетка – это химическая система, весьма далекая от равновесия. Равновесие наступает только в процессе посмертного автолиза (самопереваривания под действием собственных ферментов).
Потребность в энергии.
Чтобы удержать систему в состоянии, далеком от химического равновесия, требуется производить работу, а для этого необходима энергия. Получение этой энергии и выполнение этой работы – непременное условие для того, чтобы клетка оставалась в своем стационарном (нормальном) состоянии, далеком от равновесия. Одновременно в ней выполняется и иная работа, связанная со взаимодействием со средой, например: в мышечных клетках – сокращение; в нервных клетках – проведение нервного импульса; в клетках почек – образование мочи, значительно отличающейся по своему составу от плазмы крови; в специализированных клетках желудочно-кишечного тракта – синтез и выделение пищеварительных ферментов; в клетках эндокринных желез – секреция гормонов; в клетках светляков – свечение; в клетках некоторых рыб – генерирование электрических разрядов и т.д.
Источники энергии.
В любом из перечисленных выше примеров непосредственным источником энергии, которую клетка использует для производства работы, служит энергия, заключенная в структуре аденозинтрифосфата (АТФ). В силу особенностей своей структуры это соединение богато энергией, и разрыв связей между его фосфатными группами может происходить таким образом, что высвобождающаяся энергия используется для производства работы. Однако энергия не может стать доступной для клетки при простом гидролитическом разрыве фосфатных связей АТФ: в этом случае она расходуется впустую, выделяясь в виде тепла. Процесс должен состоять из двух последовательных этапов, в каждом из которых участвует промежуточный продукт, обозначенный здесь X–Ф (в приведенных уравнениях X и Y означают два разных органических вещества; Ф – фосфат; АДФ – аденозиндифосфат):
Поскольку практически для любого проявления жизнедеятельности клеток необходим АТФ, неудивительно, что метаболическая активность живых клеток направлена в первую очередь на синтез АТФ. Этой цели служат различные сложные последовательности реакций, в которых используется потенциальная химическая энергия, заключенная в молекулах углеводов и жиров (липидов).
МЕТАБОЛИЗМ УГЛЕВОДОВ И ЛИПИДОВ
Синтез АТФ.
Анаэробный (без участия кислорода).
Главная роль углеводов и липидов в клеточном метаболизме состоит в том, что их расщепление на более простые соединения обеспечивает синтез АТФ. Несомненно, что те же процессы протекали и в первых, самых примитивных клетках. Однако в атмосфере, лишенной кислорода, полное окисление углеводов и жиров до CO2 было невозможно. У этих примитивных клеток имелись все же механизмы, с помощью которых перестройка структуры молекулы глюкозы обеспечивала синтез небольших количеств АТФ. Речь идет о процессах, которые у микроорганизмов называют брожением. Лучше всего изучено сбраживание глюкозы до этилового спирта и CO2 у дрожжей.
В ходе 11 последовательных реакций, необходимых для того, чтобы завершилось это превращение, образуется ряд промежуточных продуктов, представляющих собой эфиры фосфорной кислоты (фосфаты). Их фосфатная группа переносится на аденозиндифосфат (АДФ) с образованием АТФ. Чистый выход АТФ составляет 2 молекулы АТФ на каждую молекулу глюкозы, расщепленную в процессе брожения. Аналогичные процессы происходят во всех живых клетках; поскольку они поставляют необходимую для жизнедеятельности энергию, их иногда (не вполне корректно) называют анаэробным дыханием клеток.
У млекопитающих, в том числе у человека, такой процесс называется гликолизом и его конечным продуктом является молочная кислота, а не спирт и CO2. Вся последовательность реакций гликолиза, за исключением двух последних этапов, полностью идентична процессу, протекающему в дрожжевых клетках.
Аэробный (с использованием кислорода).
С появлением в атмосфере кислорода, источником которого послужил, очевидно, фотосинтез растений, в ходе эволюции развился механизм, обеспечивающий полное окисление глюкозы до CO2 и воды, – аэробный процесс, в котором чистый выход АТФ составляет 38 молекул АТФ на каждую окисленную молекулу глюкозы. Этот процесс потребления клетками кислорода для образования богатых энергией соединений известен как клеточное дыхание (аэробное). В отличие от анаэробного процесса, осуществляемого ферментами цитоплазмы, окислительные процессы протекают в митохондриях. В митохондриях пировиноградная кислота – промежуточный продукт, образовавшийся в анаэробной фазе – окисляется до СО2 в шести последовательных реакциях, в каждой из которых пара электронов переносится на общий акцептор – кофермент никотинамидадениндинуклеотид (НАД). Эту последовательность реакций называют циклом трикарбоновых кислот, циклом лимонной кислоты или циклом Кребса. Из каждой молекулы глюкозы образуется 2 молекулы пировиноградной кислоты; 12 пар электронов отщепляется от молекулы глюкозы в ходе ее окисления, описываемого уравнением:
Перенос электронов.
В каждой митохондрии имеется механизм, посредством которого восстановленный НАД (НАДЧН, где Н – водород), образовавшийся в цикле трикарбоновых кислот, передает свою пару электронов кислороду. Перенос, однако, не происходит напрямую. Электроны как бы передаются «из рук в руки» и, лишь пройдя цепь переносчиков, присоединяются к кислороду. Эта «цепь переноса электронов» состоит из следующих компонентов:
НАДНЧН ® Флавинадениндинклеотид ® Кофермент Q ®
® Цитохром b ® Цитохром c ® Цитохром a ® O2
Все компоненты этой системы, находящиеся в митохондриях, фиксированы в пространстве и сцеплены друг с другом. Такое их состояние облегчает перенос электронов.
В состав НАД входит никотиновая кислота (витамин ниацин), а в состав флавинадениндинуклеотида – рибофлавин (витамин B2). Кофермент Q представляет собой высокомолекулярный хинон, синтезируемый в печени, а цитохромы – это три разных белка, каждый из которых, подобно гемоглобину, содержит гемогруппу.
В цепи переноса электронов на каждую пару электронов, перенесенную от НАДЧН на O2, синтезируется 3 молекулы АТФ. Поскольку от каждой молекулы глюкозы отщепляются и передаются молекулам НАД 12 пар электронов, в общей сложности на каждую молекулу глюкозы образуется 3ґ12 = 36 молекул АТФ. Этот процесс образования АТФ в ходе окисления называется окислительным фосфорилированием.
Липиды как источник энергии.
Жирные кислоты могут использоваться в качестве источника энергии приблизительно так же, как и углеводы. Окисление жирных кислот протекает путем последовательного отщепления от молекулы жирной кислоты двууглеродного фрагмента с образованием ацетилкофермента A (ацетил-КоА) и одновременной передачей двух пар электронов в цепь переноса электронов. Образовавшийся ацетил-КоА – нормальный компонент цикла трикарбоновых кислот, и в дальнейшем его судьба не отличается от судьбы ацетил-КоА, поставляемого углеводным обменом. Таким образом, механизмы синтеза АТФ при окислении как жирных кислот, так и метаболитов глюкозы практически одинаковы.
Если организм животного получает энергию почти целиком за счет одного только окисления жирных кислот, а это бывает, например, при голодании или при сахарном диабете, то скорость образования ацетил-КоА превышает скорость его окисления в цикле трикарбоновых кислот. В этом случае лишние молекулы ацетил-КоА реагируют друг с другом, в результате чего образуются в конечном счете ацетоуксусная и b-гидроксимасляная кислоты. Их накопление является причиной патологического состояния, т.н. кетоза (одного из видов ацидоза), который при тяжелом диабете может вызвать кому и смерть.
Запасание энергии.
Животные питаются нерегулярно, и их организму нужно как-то запасать заключенную в пище энергию, источником которой являются поглощенные животным углеводы и жиры. Жирные кислоты могут запасаться в виде нейтральных жиров либо в печени, либо в жировой ткани. Углеводы, поступая в большом количестве, в желудочно-кишечном тракте гидролизуются до глюкозы или иных сахаров, которые затем в печени превращаются в ту же глюкозу. Здесь из глюкозы синтезируется гигантский полимер гликоген путем присоединения друг к другу остатков глюкозы с отщеплением молекул воды (число остатков глюкозы в молекулах гликогена доходит до 30 000). Когда возникает потребность в энергии, гликоген вновь распадается до глюкозы в реакции, продуктом которой является глюкозофосфат. Этот глюкозофосфат направляется на путь гликолиза – процесса, составляющего часть пути окисления глюкозы. В печени глюкозофосфат может также подвергнуться гидролизу, и образующаяся глюкоза поступает в кровоток и доставляется кровью к клеткам в разных частях тела.
Синтез липидов из углеводов.
Если количество углеводов, поглощенных с пищей за один прием, больше того, какое может быть запасено в виде гликогена, то избыток углеводов превращается в жиры. Начальная последовательность реакций совпадает при этом с обычным окислительным путем, т.е. сначала из глюкозы образуется ацетил-КоА, но далее этот ацетил-КоА используется в цитоплазме клетки для синтеза длинноцепочечных жирных кислот. Процесс синтеза можно описать как обращение обычного процесса окисления жирных клеток. Затем жирные кислоты запасаются в виде нейтральных жиров (триглицеридов), отлагающихся в разных частях тела. Когда требуется энергия, нейтральные жиры подвергаются гидролизу и жирные кислоты поступают в кровь. Здесь они адсорбируются молекулами плазменных белков (альбуминов и глобулинов) и затем поглощаются клетками самых разных типов. Механизмов, способных осуществлять синтез глюкозы из жирных кислот, у животных нет, но у растений такие механизмы имеются.
Метаболизм липидов.
Липиды попадают в организм главным образом в форме триглицеридов жирных кислот. В кишечнике под действием ферментов поджелудочной железы они подвергаются гидролизу, продукты которого всасываются клетками стенки кишечника. Здесь из них вновь синтезируются нейтральные жиры, которые через лимфатическую систему поступают в кровь и либо транспортируются в печень, либо отлагаются в жировой ткани. Выше уже указывалось, что жирные кислоты могут также синтезироваться заново из углеводных предшественников. Следует отметить, что, хотя в клетках млекопитающих может происходить включение одной двойной связи в молекулы длинноцепочечных жирных кислот (между С–9 и С–10), включать вторую и третью двойную связь эти клетки неспособны. Поскольку жирные кислоты с двумя и тремя двойными связями играют важную роль в метаболизме млекопитающих, они в сущности являются витаминами. Поэтому линолевую (C18:2) и линоленовую (C18:3) кислоты называют незаменимыми жирными кислотами. В то же время в клетках млекопитающих в линоленовую кислоту может включаться четвертая двойная связь и путем удлинения углеродной цепи может образоваться арахидоновая кислота (C20:4), также необходимый участник метаболических процессов.
В процессе синтеза липидов остатки жирных кислот, связанные с коферментом А (ацил-КоА), переносятся на глицерофосфат – эфир фосфорной кислоты и глицерина. В результате образуется фосфатидная кислота – соединение, в котором одна гидроксильная группа глицерина этерифицирована фосфорной кислотой, а две группы – жирными кислотами. При образовании нейтральных жиров фосфорная кислота удаляется путем гидролиза, и ее место занимает третья жирная кислота в результате реакции с ацил-КоА. Кофермент А образуется из пантотеновой кислоты (одного из витаминов). В его молекуле имеется сульфгидрильная (– SH) группа, способная реагировать с кислотами с образованием тиоэфиров. При образовании фосфолипидов фосфатидная кислота реагирует непосредственно с активированным производным одного из азотистых оснований, таких, как холин, этаноламин или серин.
За исключением витамина D, все встречающиеся в организме животных стероиды (производные сложных спиртов) легко синтезируются самим организмом. Сюда относятся холестерин (холестерол), желчные кислоты, мужские и женские половые гормоны и гормоны надпочечников. В каждом случае исходным материалом для синтеза служит ацетил-КоА: из ацетильных групп путем многократно повторяющейся конденсации строится углеродный скелет синтезируемого соединения.
МЕТАБОЛИЗМ БЕЛКОВ
Синтез аминокислот.
Растения и большинство микроорганизмов могут жить и расти в среде, в которой для их питания имеются только минеральные вещества, диоксид углерода и вода. Это значит, что все обнаруживаемые в них органические вещества эти организмы синтезируют сами. Встречающиеся во всех живых клетках белки построены из 21 вида аминокислот, соединенных в различной последовательности. Аминокислоты синтезируются живыми организмами. В каждом случае ряд химических реакций приводит к образованию a-кетокислоты. Одна такая a-кетокислота, а именно a-кетоглутаровая (обычный компонент цикла трикарбоновых кислот), участвует в связывании азота по следующему уравнению:
a-Кетоглутаровая кислота + NH3 + НАДЧН ®
® Глутаминовая кислота + НАД.
Азот глутаминовой кислоты может быть затем передан любой из других a-кетокислот с образованием соответствующей аминокислоты.
Организм человека и большинства других животных сохранил способность синтезировать все аминокислоты за исключением девяти т.н. незаменимых аминокислот. Поскольку кетокислоты, соответствующие этим девяти, не синтезируются, незаменимые аминокислоты должны поступать с пищей.
Синтез белков.
Аминокислоты нужны для биосинтеза белка. Процесс биосинтеза протекает обычно следующим образом. В цитоплазме клетки каждая аминокислота «активируется» в реакции с АТФ, а затем присоединяется к концевой группе молекулы рибонуклеиновой кислоты, специфичной именно для данной аминокислоты. Эта сложная молекула связывается с небольшим тельцем, т.н. рибосомой, в положении, определяемом более длинной молекулой рибонуклеиновой кислоты, прикрепленной к рибосоме. После того как все эти сложные молекулы соответствующим образом выстроились, связи между исходной аминокислотой и рибонуклеиновой кислотой разрываются и возникают связи между соседними аминокислотами – синтезируется специфичный белок. Процесс биосинтеза поставляет белки не только для роста организма или для секреции в среду. Все белки живых клеток со временем претерпевают распад до составляющих их аминокислот, и для поддержания жизни клетки должны синтезироваться вновь.
Синтез других азотсодержащих соединений.
В организме млекопитающих аминокислоты используются не только для биосинтеза белков, но и как исходный материал для синтеза многих азотсодержащих соединений. Аминокислота тирозин является предшественником гормонов адреналина и норадреналина. Простейшая аминокислота глицин служит исходным материалом для биосинтеза пуринов, входящих в состав нуклеиновых кислот, и порфиринов, входящих в состав цитохромов и гемоглобина. Аспарагиновая кислота – предшественник пиримидинов нуклеиновых кислот. Метильная группа метионина передается ряду других соединений в ходе биосинтеза креатина, холина и саркозина. При биосинтезе креатина от одного соединения к другому передается также и гуанидиновая группировка аргинина. Триптофан служит предшественником никотиновой кислоты, а из валина в растениях синтезируется такой витамин, как пантотеновая кислота. Все это лишь отдельные примеры использования аминокислот в процессах биосинтеза.
Азот, поглощаемый микроорганизмами и высшими растениями в виде иона аммония, расходуется почти целиком на образование аминокислот, из которых затем синтезируются многие азотсодержащие соединения живых клеток. Избыточных количеств азота ни растения, ни микроорганизмы не поглощают. В отличие от них, у животных количество поглощенного азота зависит от содержащихся в пище белков. Весь азот, поступивший в организм в виде аминокислот и не израсходованный в процессах биосинтеза, довольно быстро выводится из организма с мочой. Происходит это следующим образом. В печени неиспользованные аминокислоты передают свой азот a-кетоглутаровой кислоте с образованием глутаминовой кислоты, которая дезаминируется, высвобождая аммиак. Далее азот аммиака может либо на время запасаться путем синтеза глутамина, либо сразу же использоваться для синтеза мочевины, протекающего в печени.
У глутамина есть и другая роль. Он может подвергаться гидролизу в почках с высвобождением аммиака, который поступает в мочу в обмен на ионы натрия. Этот процесс крайне важен как средство поддержания кислотно-щелочного равновесия в организме животного. Почти весь аммиак, происходящий из аминокислот и, возможно, из других источников, превращается в печени в мочевину, так что свободного аммиака в крови обычно почти нет. Однако при некоторых условиях довольно значительные количества аммиака содержит моча. Этот аммиак образуется в почках из глутамина и переходит в мочу в обмен на ионы натрия, которые таким образом реадсорбируются и задерживаются в организме. Этот процесс усиливается при развитии ацидоза – состояния, при котором организм нуждается в дополнительных количествах катионов натрия для связывания избытка ионов бикарбоната в крови.
Избыточные количества пиримидинов тоже распадаются в печени через ряд реакций, в которых высвобождается аммиак. Что касается пуринов, то их избыток подвергается окислению с образованием мочевой кислоты, выделяющейся с мочой у человека и других приматов, но не у остальных млекопитающих. У птиц отсутствует механизм синтеза мочевины, и именно мочевая кислота, а не мочевина, является у них конечным продуктом обмена всех азотсодержащих соединений.
Нуклеиновые кислоты.
Структура и синтез этих азотсодержащих соединений подробно описаны в статье НУКЛЕИНОВЫЕ КИСЛОТЫ.
ОБЩИЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Можно сформулировать некоторые общие понятия, или «правила», касающиеся метаболизма. Приведенные ниже несколько главных «правил» позволяют лучше понять, как протекает и регулируется метаболизм.
1. Метаболические пути необратимы. Распад никогда не идет по пути, который являлся бы простым обращением реакций синтеза. В нем участвуют другие ферменты и другие промежуточные продукты. Нередко противоположно направленные процессы протекают в разных отсеках клетки. Так, жирные кислоты синтезируются в цитоплазме при участии одного набора ферментов, а окисляются в митохондриях при участии совсем другого набора.
2. Ферментов в живых клетках достаточно для того, чтобы все известные метаболические реакции могли протекать гораздо быстрее, чем это обычно наблюдается в организме. Следовательно, в клетках существуют какие-то регуляторные механизмы. Открыты разные типы таких механизмов.
а) Фактором, ограничивающим скорость метаболических превращений данного вещества, может быть поступление этого вещества в клетку; именно на этот процесс в таком случае и направлена регуляция. Роль инсулина, например, связана с тем, что он, по-видимому, облегчает проникновение глюкозы во все клетки, глюкоза же подвергается превращениям с той скоростью, с какой она поступает. Сходным образом проникновение железа и кальция из кишечника в кровь зависит от процессов, скорость которых регулируется.
б) Вещества далеко не всегда могут свободно переходить из одного клеточного отсека в другой; есть данные, что внутриклеточный перенос регулируется некоторыми стероидными гормонами.
в) Выявлено два типа сервомеханизмов «отрицательной обратной связи».
У бактерий были обнаружены примеры того, что присутствие продукта какой-нибудь последовательности реакций, например аминокислоты, подавляет биосинтез одного из ферментов, необходимых для образования этой аминокислоты.
В каждом случае фермент, биосинтез которого оказывается затронутым, был ответствен за первый «определяющий» этап (на схеме реакция 4) метаболического пути, ведущего к синтезу данной аминокислоты.
Второй механизм хорошо изучен у млекопитающих. Это простое ингибирование конечным продуктом (в нашем случае – аминокислотой) фермента, ответственного за первый «определяющий» этап метаболического пути.
Еще один тип регулирования посредством обратной связи действует в тех случаях, когда окисление промежуточных продуктов цикла трикарбоновых кислот сопряжено с образованием АТФ из АДФ и фосфата в процессе окислительного фосфорилирования. Если весь имеющийся в клетке запас фосфата и (или) АДФ уже исчерпан, то окисление приостанавливается и может возобновиться лишь после того, как этот запас вновь станет достаточным. Таким образом, окисление, смысл которого в том, чтобы поставлять полезную энергию в форме АТФ, происходит только тогда, когда возможен синтез АТФ.
3. В биосинтетических процессах участвует сравнительно небольшое число строительных блоков, каждый из которых используется для синтеза многих соединений. Среди них можно назвать ацетилкофермент А, глицерофосфат, глицин, карбамилфосфат, поставляющий карбамильную (H2N–CO–) группу, производные фолиевой кислоты, служащие источником гидроксиметильной и формильной групп, S-аденозилметионин – источник метильных групп, глутаминовую и аспарагиновую кислоты, поставляющие аминогруппы, и наконец, глутамин – источник амидных групп. Из этого относительно небольшого числа компонентов строятся все те разнообразные соединения, которые мы находим в живых организмах.
4. Простые органические соединения редко участвуют в метаболических реакциях непосредственно. Обычно они должны быть сначала «активированы» путем присоединения к одному из ряда соединений, универсально используемых в метаболизме. Глюкоза, например, может подвергнуться окислению лишь после того, как она будет этерифицирована фосфорной кислотой, для прочих же своих превращений она должна быть этерифицирована уридиндифосфатом. Жирные кислоты не могут быть вовлечены в метаболические превращения прежде, чем они образуют эфиры с коферментом А. Каждый из этих активаторов либо родствен одному из нуклеотидов, входящих в состав рибонуклеиновой кислоты, либо образуется из какого-нибудь витамина. Легко понять в связи с этим, почему витамины требуются в таких небольших количествах. Они расходуются на образование «коферментов», а каждая молекула кофермента на протяжении жизни организма используется многократно, в отличие от основных питательных веществ (например, глюкозы), каждая молекула которых используется только один раз.
В заключение следует сказать, что термин «метаболизм», означавший ранее нечто не более сложное, чем просто использование углеводов и жиров в организме, теперь применяется для обозначения тысяч ферментативных реакций, вся совокупность которых может быть представлена как огромная сеть метаболических путей, многократно пересекающихся (из-за наличия общих промежуточных продуктов) и управляемых очень тонкими регуляторными механизмами.
МЕТАБОЛИЗМ МИНЕРАЛЬНЫХ ВЕЩЕСТВ
Относительное содержание.
Различные элементы, встречающиеся в живых организмах, перечислены ниже в убывающем порядке в зависимости от их относительного содержания: 1) кислород, углерод, водород и азот; 2) кальций, фосфор, калий и сера; 3) натрий, хлор, магний и железо; 4) марганец, медь, молибден, селен, йод и цинк; 5) алюминий, фтор, кремний и литий; 6) бром, мышьяк, свинец и, возможно, некоторые другие.
Кислород, углерод, водород и азот – это те элементы, из которых построены мягкие ткани тела. Они входят в состав таких соединений, как углеводы, липиды, белки, вода, диоксид углерода и аммиак. Элементы, перечисленные в пп. 2 и 3, находятся в организме обычно в виде одного или нескольких неорганических соединений, а элементы пп. 4, 5 и 6 присутствуют только в следовых количествах и потому их называют микроэлементами.
Распределение в организме.
Кальций.
Кальций присутствует главным образом в костной ткани и в зубах, преимущественно в виде фосфата и в небольших количествах в виде карбоната и фторида. Поступающий с пищей кальций всасывается в основном в верхних отделах кишечника, имеющих слабокислую реакцию. Этому всасыванию (у человека здесь всасывается всего 20–30% кальция пищи) способствует витамин D. Под действием витамина D клетки кишечника вырабатывают особый белок, который связывает кальций и облегчает его перенос через стенку кишечника в кровь. На всасывание влияет также присутствие некоторых других веществ, в особенности фосфата и оксалата, которые в малых количествах способствуют всасыванию, а в больших, наоборот, подавляют его.
В крови около половины кальция связано с белком, остальное составляют ионы кальция. Соотношение ионизированной и неионизированной форм зависит от общей концентрации кальция в крови, а также от содержания белка и фосфата и концентрации водородных ионов (рН крови). Доля неионизированного кальция, на которую влияет уровень белка, позволяет косвенным образом судить о качестве питания и об эффективности работы печени, в которой идет синтез плазменных белков.
На количество ионизированного кальция влияют, с одной стороны, витамин D и факторы, воздействующие на всасывание, а с другой – паратиреоидный гормон и, возможно, также витамин D, поскольку оба эти вещества регулируют как скорость отложения кальция в костной ткани, так и его мобилизацию, т.е. вымывание из костей. Избыток паратиреоидного гормона стимулирует выход кальция из костной ткани, что приводит к повышению его концентрации в плазме. Изменяя скорости всасывания и экскреции кальция и фосфата, а также скорости образования костной ткани и ее разрушения, эти механизмы строго контролируют концентрацию кальция и фосфата в сыворотке крови. Ионы кальция играют регулирующую роль во многих физиологических процессах, в том числе в нервных реакциях, мышечном сокращении, свертывании крови. Выведение кальция из организма происходит в норме в основном (на 2/3) через желчь и кишечник и в меньшей степени (1/3) – через почки.
Фосфор.
Метаболизм фосфора – одного из главных компонентов костной ткани и зубов – во многом зависит от тех же факторов, что и метаболизм кальция. Фосфор в виде фосфата присутствует в организме также в сотнях различных физиологически важных органических эфиров. Паратиреоидный гормон стимулирует выведение фосфора с мочой и выход его из костной ткани; тем самым он регулирует концентрацию фосфора в плазме крови.
Натрий.
Натрий – главный катион внеклеточной жидкости – вместе с белком, хлоридом и бикарбонатом играет важнейшую роль в регулировании осмотического давления и pH (концентрации водородных ионов) крови. В клетках, напротив, содержится очень мало натрия, так как они обладают механизмом для выведения ионов натрия и удержания ионов калия. Весь натрий, превышающий потребности организма, очень быстро выводится через почки.
Поскольку во всех процессах выделения натрий теряется, он должен постоянно поступать в организм с пищей. При ацидозе, когда необходимо, чтобы из организма выводились большие количества анионов (например, хлорида или ацетоацетата), почки предотвращают чрезмерную потерю натрия благодаря образованию аммиака из глутамина. Выведение натрия через почки регулируется гормоном коры надпочечников альдостероном. Под действием этого гормона в кровь возвращается достаточно натрия для поддержания нормального осмотического давления и нормального объема внеклеточной жидкости.
Суточная потребность в хлористом натрии составляет 5–10 г. Эта величина возрастает при поглощении больших количеств жидкости, когда усиливается потоотделение и выделяется больше мочи.
Калий.
В отличие от натрия, калий содержится в клетках в больших количествах, но во внеклеточной жидкости его мало. Главная функция калия – регулирование внутриклеточного осмотического давления и поддержание кислотно-щелочного равновесия. Он также играет важную роль в проведении нервного импульса и во многих ферментных системах, в том числе и в тех, которые участвуют в мышечном сокращении. Калий широко распространен в природе, и его много в любой пище, так что спонтанно калиевая недостаточность возникнуть не может. В плазме концентрация калия регулируется альдостероном, стимулирующим его экскрецию с мочой.
Сера.
С пищей сера поступает в организм главным образом в составе двух аминокислот – цистина и метионина. На конечных этапах метаболизма этих аминокислот сера высвобождается и в результате окисления переводится в неорганическую форму. В составе цистина и метионина сера присутствует в структурных белках. Важную роль играет также сульфгидрильная (–SH) группа цистеина, от которой зависит активность многих ферментов.
Большая часть серы выводится с мочой в виде сульфата. Небольшое количество экскретируемого сульфата обычно связано с органическими соединениями типа фенолов.
Магний.
Метаболизм магния сходен с метаболизмом кальция, и в виде комплекса с фосфатом этот элемент тоже входит в состав костной ткани. Магний присутствует во всех живых клетках, где он функционирует как необходимый компонент многих ферментных систем; эта его роль была убедительно продемонстрирована на примере углеводного обмена в мышцах. Магний, как и калий, широко распространен, и вероятность возникновения его недостаточности очень мала.
Железо.
Железо входит в состав гемоглобина и других гемопротеинов, а именно миоглобина (мышечного гемоглобина), цитохромов (дыхательных ферментов) и каталазы, а также в состав некоторых ферментов, не содержащих гемогруппы. Всасывается железо в верхних отделах кишечника, причем это единственный элемент, всасывающийся только тогда, когда его запас в организме полностью исчерпан. В плазме железо транспортируется в соединении с белком (трансферрином). Через почки железо не выводится; избыток его накапливается в печени в соединении с особым белком (ферритином).
Микроэлементы.
У каждого микроэлемента, присутствующего в организме, своя особая функция, связанная с тем, что он стимулирует действие того или иного фермента или как-либо иначе на него влияет. Цинк необходим для кристаллизации инсулина; кроме того, он является компонентом карбоангидразы (фермента, участвующего в транспорте диоксида углерода) и некоторых других ферментов. Молибден и медь – тоже необходимые компоненты различных ферментов. Иод требуется для синтеза трииодтиронина, гормона щитовидной железы. Фтор (входящий в состав зубной эмали) способствует предотвращению кариеса.
ИСПОЛЬЗОВАНИЕ МЕТАБОЛИТОВ
Углеводы.
Всасывание.
Моносахариды, или простые сахара, высвобождающиеся при переваривании углеводов пищи, переходят из кишечника в кровоток в результате процесса, называемого всасыванием. Механизм всасывания представляет собой сочетание простой диффузии и химической реакции (активного всасывания). Одна из гипотез, касающихся природы химической фазы процесса, предполагает, что в этой фазе моносахариды соединяются с фосфорной кислотой в реакции, катализируемой ферментом из группы киназ, после чего проникают в кровеносные сосуды и здесь высвобождаются в результате ферментативного дефосфорилирования (разрыва фосфатной связи), катализируемого одной из фосфатаз. Именно активным всасыванием объясняется то, что разные моносахариды всасываются с разной скоростью и что углеводы всасываются даже тогда, когда уровень сахара в крови выше, чем в кишечнике, т.е. в условиях, когда естественно было бы ожидать их перемещения в обратном направлении – из крови в кишечник.
Механизмы гомеостаза.
Поступающие в кровоток моносахариды повышают уровень сахара в крови. При голодании концентрация глюкозы в крови колеблется обычно от 70 до 100 мг на 100 мл крови. Этот уровень поддерживается с помощью механизмов, называемых механизмами гомеостаза (самостабилизации). Как только уровень сахара в крови в результате всасывания из кишечника повышается, в действие вступают процессы, выводящие сахар из крови, так что уровень его колеблется не слишком сильно.
Подобно глюкозе, все прочие моносахариды поступают из кровотока в печень, где превращаются в глюкозу. Теперь они неотличимы как от глюкозы, которая всосалась, так и от той, что уже была в организме, и подвергаются тем же метаболическим превращениям. Один из механизмов гомеостаза углеводов, функционирующий в печени, – это гликогенез, посредством которого глюкоза переходит из крови в клетки, где превращается в гликоген. Гликоген хранится в печени до тех пор, пока не произойдет снижение уровня сахара в крови: в этой ситуации гомеостатический механизм вызовет распад накопленного гликогена до глюкозы, которая вновь поступит в кровь.
Превращения и использование.
Поскольку кровь поставляет глюкозу во все ткани тела и все ткани используют ее для получения энергии, уровень глюкозы в крови снижается главным образом за счет ее использования.
В мышцах глюкоза крови превращается в гликоген. Однако мышечный гликоген не может быть использован для получения глюкозы, которая перешла бы в кровь. В нем заключен запас энергии, и скорость его использования зависит от мышечной активности. В мышечной ткани содержатся два соединения с большим запасом легко доступной энергии в форме богатых энергией фосфатных связей – креатинфосфат и аденозинтрифосфат (АТФ). При отщеплении от этих соединений их фосфатных групп высвобождается энергия для мышечного сокращения. Чтобы мышца вновь могла сокращаться, эти соединения должны быть восстановлены в своей исходной форме. Для этого требуется энергия, которую поставляет окисление продуктов распада гликогена. При мышечном сокращении гликоген превращается в глюкозофосфат, а затем – через ряд реакций – во фруктозодифосфат. Фруктозодифосфат распадается на два трехуглеродных соединения, из которых после ряда этапов образуется сначала пировиноградная кислота, а в конечном итоге – молочная кислота, как об этом уже говорилось при описании метаболизма углеводов. Это превращение гликогена в молочную кислоту, сопровождающееся высвобождением энергии, может происходить в отсутствие кислорода.
При недостатке кислорода молочная кислота накапливается в мышцах, диффундирует в кровоток и поступает в печень, где из нее вновь образуется гликоген. Если кислорода достаточно, то молочная кислота в мышцах не накапливается. Вместо этого она, как это описано выше, полностью окисляется через цикл трикарбоновых кислот до диоксида углерода и воды с образованием АТФ, который может быть использован для сокращения.
Метаболизм углеводов в нервной ткани и эритроцитах отличается от метаболизма в мышцах тем, что гликоген здесь не участвует. Однако и здесь промежуточными продуктами являются пировиноградная и молочная кислоты, образующиеся при расщеплении глюкозофосфата.
Глюкоза используется не только в клеточном дыхании, но и во многих других процессах: синтезе лактозы (молочного сахара), образовании жиров, а также особых сахаров, входящих в состав полисахаридов соединительной ткани и ряда других тканей.
Гликоген печени, синтезируемый при всасывании углеводов в кишечнике, служит самым доступным источником глюкозы, когда всасывание отсутствует. Если этот источник оказывается исчерпанным, в печени начинается процесс глюконеогенеза. Глюкоза образуется при этом из некоторых аминокислот (из 100 г белка образуется 58 г глюкозы) и нескольких других неуглеводных соединений, в том числе из глицериновых остатков нейтральных жиров.
Некоторую, хотя и не столь важную, роль в метаболизме углеводов играют почки. Они выводят из организма избыток глюкозы, когда ее концентрация в крови слишком высока; при меньших концентрациях глюкоза практически не выводится.
В регулировании метаболизма углеводов участвует несколько гормонов, в том числе гормоны поджелудочной железы, передней доли гипофиза и коры надпочечников.
Гормон поджелудочной железы инсулин снижает концентрацию глюкозы в крови и повышает ее концентрацию в клетках. По-видимому, он стимулирует также и запасание гликогена в печени. Кортикостерон, гормон коры надпочечников, и адреналин, вырабатываемый мозговым веществом надпочечников, воздействуют на метаболизм углеводов, стимулируя распад гликогена (главным образом в мышцах и печени) и синтез глюкозы (в печени).
Липиды.
Всасывание.
В кишечнике после переваривания жиров остаются главным образом свободные жирные кислоты с небольшой примесью холестерина и лецитина и следами жирорастворимых витаминов. Все эти вещества очень тонко диспергированы благодаря эмульгирующему и солюбилизирующему действию солей желчных кислот. Солюбилизирующее действие обычно связывают с образованием нестойких химических соединений между жирными кислотами и солями желчных кислот. Эти комплексы проникают в клетки эпителия тонкого кишечника и здесь распадаются на жирные кислоты и соли желчных кислот. Последние переносятся в печень и вновь секретируются с желчью, а жирные кислоты вступают в соединение с глицерином или холестерином. Образовавшиеся реконструированные жиры поступают в лимфатические сосуды брыжейки в форме млечного сока, т.н. «хилуса». Из сосудов брыжейки хилус по лимфатической системе через грудной проток поступает в кровеносную систему.
После переваривания пищи содержание липидов в крови возрастает приблизительно от 500 мг (уровень при голодании) до 1000 мг на 100 мл плазмы. Присутствующие в крови липиды представляют собой смесь жирных кислот, нейтральных жиров, фосфолипидов (лецитина и кефалина), холестерина и эфиров холестерина.
Распределение.
Кровь доставляет липиды в разные ткани тела и прежде всего в печень. Печень обладает способностью модифицировать поступающие в нее жирные кислоты. Это особенно выражено у видов, запасающих жиры с высоким содержанием насыщенных или, наоборот, ненасыщенных жирных кислот: в печени этих животных соотношение насыщенных и ненасыщенных кислот изменяется таким образом, что отлагающийся жир по своему составу соответствует жиру, свойственному данному организму.
Жиры в печени либо используются для получения энергии, либо переходят в кровь и доставляются ею в разные ткани. Здесь они могут включаться в структурные элементы тканей, но большая их часть отлагается в жировых депо, где они хранятся до тех пор, пока не возникнет потребность в энергии; тогда они снова переносятся в печень и подвергаются здесь окислению.
Метаболизм липидов, как и углеводов, регулируется гомеостатически. Механизмы гомеостаза, воздействующие на липидный и углеводный обмен, видимо, тесно связаны, поскольку при замедлении метаболизма углеводов усиливается метаболизм липидов, и наоборот.
Превращения и использование.
Четырехуглеродные кислоты – ацетоуксусная (продукт конденсации двух ацетатных единиц) и b-гидроксимасляная – и трехуглеродное соединение ацетон, образующийся при отщеплении одного атома углерода от ацетоуксусной кислоты, известны под общим названием кетоновых (ацетоновых) тел. В норме кетоновые тела присутствуют в крови в небольших количествах. Избыточное их образование при тяжелом диабете ведет к повышению их содержания в крови (кетонемия) и в моче (кетонурия) – это состояние обозначают термином «кетоз».
Белки.
Всасывание.
При переваривании белков пищеварительными ферментами образуется смесь из аминокислот и небольших пептидов, содержащих от двух до десяти остатков аминокислот. Эти продукты всасываются слизистой кишечника, и здесь гидролиз завершается – пептиды также распадаются до аминокислот. Поступившие в кровь аминокислоты смешиваются с находящимися здесь такими же аминокислотами. В крови содержится смесь из аминокислот, поступивших из кишечника, образовавшихся при распаде тканевых белков и синтезированных организмом заново.
Синтез.
В тканях непрерывно идет распад белков и их новообразование. Содержащиеся в крови аминокислоты избирательно поглощаются тканями как исходный материал для построения белков, а из тканей в кровь поступают другие аминокислоты. Синтезу и распаду подвергаются не только структурные белки, но и белки плазмы крови, а также белковые гормоны и ферменты.
Во взрослом организме аминокислоты или белки практически не запасаются, поэтому удаление аминокислот из крови происходит с такой же скоростью, как и их поступление из тканей в кровь. В растущем организме формируются новые ткани, и на этот процесс расходуется больше аминокислот, чем поступает в кровь за счет распада тканевых белков.
Печень участвует в метаболизме белков самым активным образом. Здесь синтезируются белки плазмы крови – альбумины и глобулины – а также собственные ферменты печени. Так, при потере плазменных белков содержание альбумина в плазме восстанавливается – за счет интенсивного синтеза – довольно быстро. Аминокислоты в печени используются не только для образования белков, но подвергаются также расщеплению, в ходе которого извлекается заключенная в них энергия.
Превращения и использование.
Если аминокислоты используются в качестве источника энергии, то отщепляемая от них аминогруппа (–NH2) направляется на образование мочевины, а не содержащий азота остаток молекулы окисляется приблизительно так же, как глюкоза или жирные кислоты.
Так называемый «орнитиновый цикл» описывает, как происходит превращение аммиака в мочевину. В этом цикле аминогруппа, отщепившаяся от аминокислоты в форме аммиака, присоединяется вместе с диоксидом углерода к молекуле орнитина с образованием цитруллина. Цитруллин присоединяет второй атом азота, на этот раз от аспарагиновой кислоты, и превращается в аргинин. Далее аргинин подвергается гидролизу с образованием мочевины и орнитина. Орнитин может теперь вновь вступить в цикл, а мочевина выводится из организма через почки как один из конечных продуктов метаболизма.
См. также ГОРМОНЫ; ФЕРМЕНТЫ; ЖИРЫ И МАСЛА; НУКЛЕИНОВЫЕ КИСЛОТЫ; БЕЛКИ; ВИТАМИНЫ.
Диетолог: Интервальное голодание может спровоцировать набор веса и замедление метаболизма — Агентство городских новостей «Москва»
Интервальное голодание может спровоцировать набор веса и проблемы с обменом веществ. Об этом Агентству городских новостей «Москва» сообщила главный внештатный специалист-диетолог столичного департамента здравоохранения Антонина Стародубова.
«Об интермиттирующем (интервальном) голодании много говорят и пишут, при этом данный метод зачастую представляют не только как эффективное и абсолютно безопасное средство для коррекции массы тела, но и как панацею от всех болезней. Хочется отметить, что в настоящее время исследования по применению интервального голодания проводились с участием ограниченного количества людей, а большинство данных получено в результате экспериментов на животных, поэтому говорить о преимуществах и последствиях применения этого метода не представляется возможным», — сказала врач.
Она пояснила, что в условиях голода в организме включаются механизмы, направленные на адаптацию к новым, неблагоприятным условиям.
«Пища оказывает на человека значительное влияние, она обеспечивает организм энергией и всеми необходимыми питательными веществами. Несбалансированное, неправильное питание приводит к развитию серьезных заболеваний. В условиях голода в нашем организме включаются механизмы, направленные на адаптацию к этим новым неблагоприятным условиям, в результате чего обмен веществ начинает замедляться, соответственно, снижается потребность организма в энергии, поступающей с пищей. Это приводит к тому, что ранее сбалансированный по энергетической составляющей рацион питания становится избыточным, что приводит к рикошетному набору массы тела», — отметила А.Стародубова.
Врач рекомендовала не переедать, но и не пропускать приемы пищи. Она напомнила, что ежедневный рацион питания должен содержать все необходимые организму пищевые вещества (белки, жиры, углеводы, витамины и минеральные вещества) в определенном количестве и соотношении.
«Принимать пищу рекомендуется в одно и то же время, основные приемы пищи — не менее трех раз в день — можно дополнять двумя небольшими перекусами. На ночь, за 1,5-2 часа до сна, можно выпить кефир или другой кисломолочный продукт. Ответственно относитесь к своему питанию, ведь от этого зависит ваше здоровье и благополучие. Особенно это относится к питанию, детей, подростков, беременных и кормящих женщин, а также пожилых людей и людей, страдающих теми или иными хроническими заболеваниями. Помните, что к материалам, в том числе по питанию, рекомендующим «средство от всех болезней», следует относиться критически, а по вопросам резкого изменения типа питания или применения жестких ограничительных диет необходимо проконсультироваться с врачом», — заключила А.Стародубова.
Узнайте, почему метаболизм замедляется с возрастом
Чувствуете ли вы, что набираете пять фунтов после того, как съели кусок торта, когда вы могли бы съесть весь торт в свои 20 лет и не набрать ни грамма? Это не твое воображение. С возрастом наш метаболизм замедляется, и скорость расщепления пищи снижается на 10 процентов каждые десять лет после 20 лет.
Метаболизм — это количество энергии (калорий), которое ваше тело использует для поддержания себя. Количество калорий, сжигаемых вашим телом в состоянии покоя, зависит от вашей основной скорости метаболизма (BMR), а также от того, сколько вы тренируетесь, и от отношения мышечной массы к жировой ткани.
«К тому времени, когда нам исполнится 50, мы увидим 30-процентное снижение», — говорит Карен Андри, лицензированный и зарегистрированный диетолог и координатор по бариатрии в больнице Пьемонт, Атланта.
Почему так легко набрать вес
Замедление метаболизма может приводить к увеличению веса каждый год, даже если вы не едите намного больше, чем обычно.
Например, если вы каждую ночь съедаете по тарелке мороженого — около 500 калорий — за неделю вы потребляете 3500 дополнительных калорий, что составляет фунт жира.Умножьте это на 52 недели в году, и вы увидите значительный набор веса, если будете употреблять всего одно дополнительное лакомство за ночь.
«Набрать вес очень просто, но очень сложно его сбросить», — говорит Андри.
Поддержание мышечной массы является ключом к предотвращению увеличения веса, но это может быть сложной задачей, потому что после 45 лет средний человек теряет примерно 1 процент мышечной массы ежегодно. Щелкните здесь, чтобы найти укрепляющие упражнения для всего тела.
Поддержание здорового веса требует усилий, поэтому внимательно относитесь к тому, что вы едите каждый день, и увеличивайте свою физическую активность.
Идеальная масса тела
Как узнать, что у вас идеальный вес? Медицинский персонал обычно либо определяет ваш индекс массы тела, либо использует простую формулу, подобную этой:
- Женский — 5’0 ”= 100 фунтов
- Самка — 5 футов 1 дюйм = 105 фунтов
- Женский — 5 футов 2 дюйма = 110 фунтов
- Самка — 5 футов 3 дюйма = 115 фунтов.
- Самка — 5 футов 4 дюйма = 120 фунтов.
- Самка — 5 футов 5 дюймов = 125 фунтов.
«Мы используем таблицы Metropolitan Life Insurance для определения идеальной массы тела много лет назад», — говорит Андри.«Они на самом деле не очень реалистичны; однако они используются повсеместно, поэтому вы можете сравнить яблоки с яблоками ».
Поскольку вес настолько уникален для образа жизни и факторов риска каждого человека, лучше всего поговорить с лечащим врачом, чтобы определить ваш личный целевой вес. Щелкните здесь, чтобы найти ближайшего к вам врача.
Для получения дополнительных советов по фитнесу и питанию посетите страницу «Жизнь лучше, здоровье и хорошее самочувствие».
Вам нужно записаться на прием к врачу из Пьемонта? Экономьте время, бронируйте онлайн.
Что такое метаболизм и как его изменить?
Когда дело доходит до похудения или поддержания текущего веса, ваш метаболизм может повлиять на ваши результаты. Если вас это беспокоит, полезно точно понять, что такое метаболизм. Также полезно знать, что может повлиять на это, и, если у вас может быть медленнее, как помочь его ускорить.
Определение метаболизма
Метаболизм относится к биохимическим процессам, которые организм использует при преобразовании пищи (калорий) в энергию как для поддержания жизни, так и для поддержки физической активности, будь то упражнения или не упражнения.Эти процессы включают:
- Дыхание
- Переваривание пищи
- Доставка питательных веществ в ваши клетки через кровь
- Использование энергии мышцами, нервами и клетками
- Удаление шлаков из вашего тела
Скорость, с которой вы сжигаете калории или энергию, называется скоростью метаболизма. Это число включает ваш базальный уровень метаболизма (BMR) — количество калорий, необходимых для поддержки основных функций, таких как дыхание и циркуляция крови, а также калорий, сожженных во время физической активности.
Ваш BMR является наиболее важным компонентом вашего метаболизма, составляя от 60% до 75% ваших общих калорий, расходуемых ежедневно.
Факторы, влияющие на обмен веществ
Скорость метаболизма у всех разная, так как многие факторы могут влиять на то, насколько быстро (или медленно) наш организм использует или преобразует энергию.
Возраст
С возрастом метаболизм замедляется. Некоторые исследования предполагают, что это связано с тем, что с возрастом меняется состав нашего тела. Мы постепенно теряем обезжиренную массу, и, поскольку жир сжигает меньше калорий, чем мышцы, наш метаболизм снижается.Возрастные изменения в наших органах также могут снизить скорость метаболизма.
Секс
У мужчин обычно более высокий метаболизм, чем у женщин. Исследования показывают, что это может быть связано с тем, что женщины экономят энергию и накапливают жир более эффективно, чем их коллеги-мужчины, хотя также выясняется, что различия в различных гормонах также могут иметь значение.
Состав тела
Сухая мышечная масса сжигает больше калорий, чем жир, даже когда ваше тело находится в состоянии покоя.Итак, чем больше у вас мышц, тем больше калорий вы сжигаете в течение дня и тем выше ваш метаболизм. У людей, страдающих ожирением, на расход энергии может влиять воспаление.
Размер корпуса (высота)
Ваш рост также может влиять на скорость метаболизма вашего тела, но несколько сложным образом. Люди более высокого роста, как правило, имеют более высокий BMR (потому что они больше), но некоторые исследования показали, что они, как правило, сжигают меньше калорий во время упражнений по сравнению с их массой тела по сравнению с более низкими людьми.
Если принять во внимание ваш рост и объем талии, это может помочь определить, есть ли у вас риск развития метаболических нарушений, таких как метаболический синдром.
Температура тела
Организм использует до 40% от общего количества энергии, затрачиваемой на поддержание стабильной температуры. Следовательно, если вы подвержены экстремальным температурам, вашему телу придется работать усерднее. Чем больше вы работаете, тем выше ваш метаболизм.
Люди, страдающие ожирением, обычно имеют более низкую температуру тела, поэтому некоторые исследователи предполагают, что это могло снизить их метаболизм и способствовать их первоначальному увеличению веса.
Потребление кофеина или стимулятора
Если вы когда-либо пили слишком много кофе или энергетических напитков, вы, вероятно, воочию почувствовали, что ваш метаболизм повышается. Это потому, что стимуляторы, такие как кофеин, могут увеличить скорость метаболизма. Однако их риски могут перевесить их преимущества, так что это не самый безопасный способ повысить ваш метаболизм.
Гормоны
Если гормоны щитовидной железы не вырабатываются организмом должным образом, ваш метаболизм может увеличиваться или уменьшаться.Если щитовидная железа не производит достаточного количества гормонов (гипотиреоз), метаболизм замедляется, что может привести к увеличению веса. Принимая во внимание, что если щитовидная железа производит слишком много (гипертиреоз), это обычно способствует потере веса.
Беременность
У беременных женщин метаболизм более быстрый. Это связано с увеличением массы тела, а также физиологическими изменениями в организме. Если женщина начинает с низкой массы тела, возможно, ей придется увеличить потребление пищи, чтобы обеспечить ей достаточное количество калорий и питательных веществ.
Прием пищи
Что делает большинство людей, садясь на диету, в первую очередь? Они сокращают калории и сокращают потребление пищи. Однако вашему организму необходимы питательные вещества, содержащиеся в пище, для поддержания здорового обмена веществ. Метаболизм также увеличивается при переваривании пищи.
Уровень активности
Когда вы больше двигаетесь в течение дня, будь то упражнения или рутинные повседневные движения, такие как ходьба или стоя, ваше тело сжигает больше калорий. Это упражнение ускоряет ваш метаболизм, облегчая похудение или поддержание потери веса.
Ваш общий расход энергии может меняться день ото дня в зависимости от уровня активности, но ваш базальный уровень метаболизма остается довольно стабильным.
Расчет скорости обмена веществ
Чтобы определить ваш текущий уровень метаболизма, вам сначала нужно рассчитать ваш BMR или количество калорий, необходимых вашему организму для основных функций. Самый точный способ сделать это — протестировать его в лаборатории. Некоторые клубы здоровья также предлагают тестирование метаболизма (за отдельную плату).
Другой вариант — рассчитать ваш расчетный BMR самостоятельно.Доступны онлайн-калькуляторы или, если вы предпочитаете вычислить это число вручную, вы можете сделать это с помощью уравнения Харриса-Бенедикта:
- Мужчины: 88,362 + (13,397 x вес в кг) + (4,799 x рост в см) — (5,677 x возраст в годах) = BMR
- Женщины: 447,593 + (9,247 x вес в кг) + (3,098 x рост в см) — (4,330 x возраст в годах) = BMR
Как только вы определите свой BMR, вы сможете рассчитать общий уровень метаболизма. Это число представляет собой комбинацию вашего BMR и калорий, используемых для таких процессов, как упражнения и другие повседневные движения.
Использование фитнес-трекера — самый простой способ подсчитать количество калорий, сожженных в результате движения. Например, если вы сжигаете 700 калорий в результате ежедневного движения, а ваш основной уровень метаболизма составляет 1200 калорий, ваше общее потребление энергии (скорость метаболизма) составит около 1900 калорий.
Как увеличить метаболизм для похудания
Есть некоторые вещи, которые вы не можете изменить в своем метаболизме. Например, вы не можете изменить свой возраст или пол. Но есть кое-что, что вы можете сделать, чтобы ускорить метаболизм и похудеть.Это включает:
- Упражнение : Вы сжигаете больше калорий, когда тренируетесь. Даже легкая тренировка увеличивает ваш метаболизм. Более тяжелые и интенсивные тренировки сжигают больше калорий.
- Увеличьте свою повседневную активность : Нет времени заниматься спортом? Больше двигайтесь в течение дня. Простые повседневные задачи, такие как ходьба, подъем по лестнице, садоводство и работа по дому, требуют от вашего тела более усердной работы и сжигания большего количества калорий.
- Добавить мышцы : Вы можете улучшить композицию тела, чтобы сжигать больше калорий.Выполняйте силовые упражнения для наращивания мышц, и вы сможете сжигать больше калорий в течение всего дня, даже когда ваше тело отдыхает.
- Съешьте нужное количество калорий : Слишком много калорий может вызвать увеличение веса. Слишком мало калорий может замедлить метаболизм. Убедитесь, что вы потребляете достаточно калорий для поддержания здорового обмена веществ.
Слово от Verywell
Ваш метаболизм будет немного меняться день ото дня. Если вы научитесь контролировать и поддерживать здоровый обмен веществ на регулярной основе, вам будет легче добиться как потери веса, так и поддержания веса в долгосрочной перспективе.
Диета может замедлить метаболизм, но не разрушить его
Когда дело доходит до диеты, исследования показывают, что большинство людей восстанавливают часть (если не большую часть) веса, который они потеряли. Хотя есть много причин, по которым может произойти такое восстановление веса, некоторые популярные в Интернете утверждают, что это потому, что диета навсегда нарушает ваш метаболизм. Но хотя это правда, что диета замедляет ваш метаболизм, она также улучшает ваш метаболизм во многих положительных отношениях.
Когда мы говорим о метаболизме, мы обычно имеем в виду скорость метаболизма.Это количество калорий, которое ваше тело сжигает в состоянии покоя. Конечно, чем больше мы занимаемся, тем больше калорий сжигаем. Чтобы похудеть с помощью диеты, вам нужно потреблять меньше калорий, чем вы потребляете. Это заставляет организм использовать свои запасы энергии — например, жир — для восполнения дефицита. В результате изменится и ваш метаболизм.
Потеря мышечной ткани во время диеты, которая сжигает около 15-25 калорий на килограмм каждый день, снижает скорость метаболизма в состоянии покоя, а это означает, что вам нужно меньше калорий, чем раньше.Но организм также намеренно замедляет обмен веществ, чтобы сохранить запасы энергии и минимизировать потерю веса.
Когда организм ощущает истощение жировых запасов, он запускает адаптивный термогенез, процесс, который еще больше снижает скорость метаболизма в состоянии покоя — и может замедлить снижение веса, несмотря на строгую диету. Адаптивный термогенез может сработать в течение трех дней после начала диеты и, как предполагается, будет сохраняться далеко за пределами диеты — даже препятствуя поддержанию веса и способствуя его восстановлению.
Один из примеров эффекта адаптивного термогенеза был замечен в широко разрекламированном исследовании 2016 года, в котором рассматривались бывшие участники американского реалити-шоу «Самый большой неудачник».Он показал, что у участников наблюдалось значительное снижение скорости метаболизма даже через несколько лет после первоначальной потери веса. Участникам необходимо было съедать на 500 калорий меньше ожидаемого в день.
Другие исследования также показали замедление метаболизма с потерей веса, но с гораздо меньшим снижением (примерно на 100 калорий в день меньше для поддержания веса). Однако нет уверенности в том, продолжится ли это замедление после стабилизации веса.
Адаптивный термогенез может замедлить снижение веса, даже если вы соблюдаете строгую диету.Rawpixel.comИсследования, кажется, показывают, что наиболее адаптивный термогенез происходит в фазе диеты как временная реакция на потерянный вес. В целом, у нас нет убедительных доказательств того, что скорость метаболизма остается замедленной в течение длительного времени (более года после диеты).
Стоит отметить, что на скорость метаболизма могут влиять многие факторы, поэтому его изменения после диеты могут различаться у разных людей. Например, одно исследование диет натощак показало, что в результате скорость метаболизма действительно снижается, но у тех, у кого было наибольшее снижение скорости метаболизма, уже была более высокая скорость метаболизма.Завышенная оценка скорости метаболизма в начале исследования или ошибки в прогнозировании скорости метаболизма после потери веса также могут повлиять на результаты исследования.
Принято считать, что скорость метаболизма замедляется из-за потери веса, как из-за уменьшения размера тела, так и для сохранения ключевых тканей и запасов топлива. Но в настоящее время нет единого мнения о том, насколько он замедляется. Количественная оценка и прогнозирование этого замедления — это то, чем мы сейчас занимаемся в Университете Суррея.
Метаболические изменения
Однако снижение скорости метаболизма — это всего лишь одно изменение, которое происходит с потерей веса.
Когда мы худеем, основное изменение, которое мы видим, — это уменьшение жировых отложений. Это уменьшение фактически связано с уменьшением размера наших жировых клеток — они фактически не исчезают. Это сокращение жировых клеток сигнализирует об истощении запасов топлива в организме, вызывая снижение уровня гормона лептина. Обычно лептин подавляет аппетит и увеличивает скорость метаболизма, но когда уровень лептина резко падает, скорость метаболизма замедляется, а чувство голода усиливается.
Кишечник также выделяет меньше инкретинов (гормонов, регулирующих аппетит), когда мы худеем, что может сохраняться и после диеты.Меньшее количество лептина и меньше инкретинов может вызвать у нас чувство голода и привести к перееданию.
Когда жировые клетки сокращаются, они могут более эффективно поглощать глюкозу и накапливать жир, чтобы помочь восстановить потерянное топливо. Ваше тело также создает больше жировых клеток, чтобы вы могли хранить больше жира в будущем, чтобы лучше справиться с этим «кризисом» калорий, когда он случится в следующий раз.
Но как бы противоречиво это ни звучало, все эти изменения на самом деле приводят к более эффективному и, в конечном итоге, более здоровому метаболизму.Например, более мелкие жировые клетки лучше для нашего здоровья, поскольку чрезмерно раздутые «больные» жировые клетки не помогают избавиться от излишков сахара и жира. Это может привести к высокому уровню сахара и жира в крови, повышая риск инсулинорезистентности, диабета и сердечно-сосудистых заболеваний.
Таким образом, диета технически не нарушает ваш метаболизм, а, скорее, улучшает его, помогая ему работать лучше. Но без осторожности это улучшение метаболизма может сговориться с вами, чтобы восстановить вес и даже превысить ваш первоначальный вес.
Исследования показывают, что упражнения (или просто физическая активность) могут быть одним из способов предотвратить восстановление веса, улучшая нашу способность поддерживать свой вес и потенциально сводя к минимуму замедление метаболизма. Упражнения также могут помочь регулировать аппетит и сжигание топлива в краткосрочной перспективе и могут сделать потерю веса более устойчивой в долгосрочной перспективе.
Как женский метаболизм меняется с возрастом: Элмер Р. Симонетт, доктор медицины: потеря веса в медицине
Во многих случаях дети могут есть столько фаст-фуда и конфет, сколько позволят их опекуны, не задумываясь о том, как набрать вес.Для тех же детей все меняется, когда они становятся старше, и они более склонны набирать вес, съев что-то простое, например, куриный салат с ранчо-заправкой. Для тех, кто знаком с поговоркой «с возрастом метаболизм замедляется», это не должно вызывать удивления, но почему это происходит? Ниже мы раскроем секреты того, как меняется метаболизм в возрасте двадцати, тридцати и сорока лет, и что вы можете сделать, чтобы эти изменения были минимальными.
Вам 20 летБольшинству женщин нравится самый высокий уровень основного обмена (BMR) или количество калорий, которые вы сжигаете при дыхании, сидении, отдыхе и т. Д.в их позднем подростковом или раннем двадцатилетнем возрасте. Некоторые женщины достигают своего пика раньше, а некоторые — позже, однако и генетика, и уровень активности играют большую роль в этом результате. По данным Американского совета по физическим упражнениям, ваш базальный уровень метаболизма падает примерно на 1-2 процента за десятилетие, и к концу двадцатых годов многие женщины заметят, что они не могут есть то же, что привыкли, без набора веса. Кроме того, вес не будет падать так легко, как раньше. РАЗГОВОР О СЕРДЦЕ!
В 30 летК сожалению, когда вы станете немного старше и вам за тридцать, вы начнете терять мышцы, и ваша естественная способность сжигать калории также снизится.Кэролайн Седерквист, доктор медицины и автор книги The MD Factor , утверждает, что по мере того, как женщины теряют мышцы и набирают жир, они могут превратить в мышцу , что приведет к увеличению веса и метаболической дисфункции. К тому же травма усугубляется тем, что в свои тридцать вы не вырабатываете столько гормона роста, как раньше, что также приводит к падению вашего метаболизма.
По мере того, как женщины теряют мышцы и набирают жир, может превратиться в мышцы, что приведет к увеличению веса и метаболической дисфункции.
К счастью, тренировки с отягощениями могут и изменят ужасающий реализм, который поджидает женщин в процессе естественного процесса старения. Силовые тренировки не только помогут нарастить мышцы, но и вырабатывают больше гормона роста человека. Обе эти вещи помогут поддерживать метаболизм так же или быстрее, чем когда вам было 20 лет.
Вам за 40Д-р Седерквист говорит, что около сорока человек готовится закрыть магазин, и у вас снижаются уровни эстрогена, прогестерона и (опять же) человеческого гормона роста, поэтому, к сожалению, ваш метаболизм пойдет по этому же пути.Уэсли Делбридж, доктор медицины, представитель Академии питания и диетологии, говорит, что это означает, что сокращение потребления калорий для поддержания веса будет очень важным. Если вы занимаетесь спортом, это может означать, что вы съедаете примерно на 150 калорий в день меньше, но если вы не занимаетесь спортом и большую часть дня сидите, вам, вероятно, придется сократить еще больше. Когда саркопения (естественное снижение мышечной массы) проходит примерно к сорока годам, наращивание мышечной массы становится неоспоримым. Тренировки с отягощениями повысят ваш основной метаболизм, а ежедневное включение достаточного количества белка в рацион также ускорит ваши усилия по укреплению сил.
Чтобы поговорить с квалифицированным врачом, чтобы оценить вашу базальную скорость метаболизма, здоровые способы ее увеличения в зависимости от вашего образа жизни и потребностей в фитнесе, а также составить для вас индивидуальный план диеты, запишитесь на прием онлайн или позвоните по телефону (909) 786-9272 для получения дополнительной помощи .
5 фактов, которые нужно знать о своем метаболизме
Станьте экспертом в области обмена веществ, диет и целого ряда пищевых компонентов с сертификатом питания от NASM .
Мы часто слышим, как люди говорят: «У меня медленный метаболизм» или «У них просто быстрый метаболизм», и все мы киваем головой в знак согласия. Но понимаем ли мы, что это значит?
Каков ваш метаболизм? Это может быть быстро или медленно? Повышает ли замедленный метаболизм склонность к полноте? Действительно ли ваш метаболизм «нарушается» при соблюдении диеты?
Это вопросы, по которым мы собираемся внести некоторую ясность в этой статье.
1.
Ваш метаболизм — это больше, чем одна вещьМы часто называем наш метаболизм чем-то особенным, как будто это черный ящик или маленький двигатель, в который все входит, а затем выходит.Но правда в том, что наш метаболизм — это совокупность множества вещей. На самом деле наш метаболизм — это сумма всех метаболических процессов в нашем организме.
Один из самых простых способов понять свой метаболизм — это считать его общими затратами энергии. Это означает, что ваш метаболизм — это кумуляция всей энергии, которую ваше тело тратит на функционирование. Мы будем называть это нашим общим дневным расходом энергии (TDEE).
Что означает общий дневной расход энергии (TDEE)?
Этот TDEE можно разделить на три основные категории:
- метаболизм в состоянии покоя (то, что большинство из нас называет метаболизмом)
- энергия, необходимая для обработки пищи, которую вы едите
- физическая активность (подробнее об этом чуть позже)
Метаболизм покоя
Ваш метаболизм в состоянии покоя — это сумма всех метаболических процессов, необходимых вам для жизни.Это означает, что ваши клетки используют энергию, чтобы делать такие вещи, как дышать, думать, перекачивать кровь и т. Д. Это составляет около 60-70% вашего TDEE.
Термический эффект пищи (TEF)
Следующая часть — это то, что мы называем термическим эффектом пищи (ТЭФ). Это просто энергия, необходимая для извлечения энергии, получаемой из пищи. Это относительно небольшое количество энергии и составляет около 10% от ваших общих дневных энергетических затрат (TDEE).
Физическая активность
Последняя составляющая вашего TDEE — это ваша физическая активность, то есть количество движений, которые вы делаете в течение дня.Это часто делится на две отдельные категории: физическая активность, возникающая в результате структурированных упражнений (мы называем это термогенезом активности упражнений), и физическая активность в результате неструктурированных упражнений (мы называем это термогенезом активности, не связанной с упражнениями).
2.
Ваш метаболизм адаптируетсяБольшинство из нас думает о своем метаболизме как о статике, которую мы не можем контролировать. Но как выясняется; это не так.
На самом деле, у нас есть блог, который покажет вам 5 способов ускорить метаболизм.Таким образом, здесь гораздо больше гибкости, чем многие предполагают.
Во-первых, вы только что узнали, что ваш метаболизм — это нечто большее, чем одно. Это совокупность множества различных аспектов вашего тела и его функций. Кроме того, вы узнали, что имеете некоторый контроль, по крайней мере, над его частью.
Во-вторых, ваш метаболизм вполне «адаптируется». Он будет регулироваться в зависимости от того, что вы делаете в повседневной жизни. Позвольте мне пояснить эти две идеи на нескольких примерах.
В одном из наиболее интересных исследований 1990-х годов ученые проверили, что происходит с людьми, когда они увеличивают или уменьшают количество калорий (1).Они обнаружили, что когда вы увеличиваете количество калорий, происходит кое-что очень интересное: они начинают сжигать больше калорий.
В первую очередь они увеличивают физическую активность, не связанную с физическими упражнениями; они начали больше двигаться. Скорость их метаболизма в состоянии покоя также увеличилась очень незначительно, причем часть этого связана с усилением термического эффекта пищи, но часть этого также происходит из-за увеличения массы тела.
То же самое произошло, когда они уменьшили калорийность , но в противоположном направлении.Когда люди уменьшили потребление калорий, их физическая активность снизилась, как и их термический эффект пищи и их метаболизм в состоянии покоя из-за уменьшения массы тела.
Короче говоря, их метаболизм адаптировался к сценарию, которому подвергалось их тело.
3.
Ваш NEAT важнее, чем вы думаетеХотя наш метаболизм в состоянии покоя составляет наиболее значительную часть нашего метаболизма, он не меняется так сильно, как люди думают.Он также не играет самой важной роли в похудании или увеличении веса. Большинство исследований, изучающих скорость метаболизма в состоянии покоя, обнаруживают, что она вообще не предсказывает прибавку или потерю веса.
Помимо метаболизма в состоянии покоя, термогенез физической активности (NEAT) является наиболее важным аспектом вашего метаболизма.
См. Также: NEAT и потеря веса
Удобно, но при этом максимально управляемый.
Одно исследование показало, что NEAT человека почти единолично определял, почему некоторые люди, которые «переедают», набирают много веса, а другие — нет (2).
Кроме того, два исследования, в которых участвовали участники телешоу о похудании «Самый большой проигравший», показали, что их физическая активность, включая NEAT, была наиболее значимым предиктором того, кто вернул вес, который они потеряли из шоу, а кто нет (3 , 4).
4.
Ваш метаболизм не «нарушается»Существует мем о том, что у людей может быть нарушенный метаболизм, из-за которого они набирают вес. К счастью, нет никаких доказательств того, что метаболизм может «нарушиться».”
Конечно, ваш метаболизм может снизиться, когда вы похудеете из-за меньшего веса тела, меньшего передвижения и меньшего термического эффекта пищи.
Ваш метаболизм также может снизиться, если у вас есть серьезные гормональные проблемы, такие как гипотиреоз. Но ваш метаболизм не «ломается»; он естественно приспосабливается к стимулам, которые вы ему даете.
5.
Ваш уровень метаболизма в покое не очень полезен для похуданияЕсть много способов измерить скорость метаболизма в состоянии покоя, некоторые из них более точны, чем другие.Однако точность этих тестов не слишком важна, потому что скорость метаболизма человека в состоянии покоя не является слишком полезным показателем по многим причинам.
Во-первых, мы не можем в значительной степени управлять скоростью метаболизма в состоянии покоя с помощью диеты или упражнений. Мы можем измерить такие вещи, как метаболические эквиваленты, которые зависят от скорости метаболизма, но точность все еще сомнительна.
Во-вторых, когда мы смотрим на большинство исследований, метаболизм в покое не имеет большого значения для похудания (5).Потребление пищи и NEAT гораздо более важны для похудания, чем уровень метаболизма в состоянии покоя.
Заключение
Мы часто думаем о нашем метаболизме как об одном. На самом деле это полная совокупность всех энергопроизводящих и энергозатратных процессов, происходящих в нашем организме. Он состоит из нашего метаболизма в состоянии покоя, энергии, необходимой для обработки пищи, и нашей физической активности.
Ваш метаболизм адаптируется к увеличению и уменьшению количества калорий, причем большая часть адаптации происходит за счет изменений в физической активности.Хотя метаболизм может снижаться, он не «ломается». Наконец, более низкий метаболизм в состоянии покоя, по-видимому, не способствует увеличению веса и сам по себе не является слишком полезным показателем для большинства людей.
Дополнительные ресурсы для ознакомления!
Что касается метаболизма в целом, обязательно посмотрите видео NASM Live ниже, поскольку они углубляются в общую тему и подходят к ней с разных сторон.
Если вы хотите узнать больше об энергетическом балансе и метаболизме, станьте сертифицированным тренером по питанию NASM. Этим темам посвящена целая глава.
Также не забудьте ознакомиться с нашим бесплатным мини-курсом по питанию, который поможет вам начать свой путь к становлению ЧПУ.
Правда о том, как ваш метаболизм меняется с возрастом
Независимо от того, каков ваш метаболизм в подростковом и 20-летнем возрасте, вам, вероятно, говорили, что все идет вниз, когда вам исполняется 30 лет. «Подождите, пока вам не исполнится 30». или «Ты не сможешь так есть, когда тебе исполнится 30» — обычно распространяются лакомые кусочки «советов» от наших старших.Это создает впечатление, будто внутренний переключатель щелкает, когда мы достигаем большого 3-0, и наши тела просто перестают знать, как эффективно использовать энергию. Хотя утверждение о том, что метаболизм у многих людей замедляется с возрастом, является правдой, это не так просто, как определить один конкретный день рождения, в который все меняется.
«Это факт, что метаболизм со временем меняется», — говорит SELF Кристен Ф. Грэдни, директор службы питания и обмена веществ в Региональном медицинском центре Богоматери Озера и представитель Академии питания и диетологии.Но будьте уверены, вы не проснетесь однажды утром с резко замедленным метаболизмом. «Со временем это происходит все более прогрессивно», — говорит она. Это потому, что гормональные изменения происходят медленно, а не в одночасье.
И хотя мы не можем избежать этих естественных изменений, которые происходят с возрастом, мы можем кое-что сделать, чтобы немного их оттолкнуть. Здесь эксперты объясняют, что на самом деле происходит, когда ваш метаболизм замедляется, и какие привычки образа жизни вы можете принять, чтобы сопротивляться этому дольше.
Метаболизм — это сложный биологический процесс, выполняемый нашим организмом для превращения калорий, которые мы едим и пьем, в энергию.
Даже когда мы сидим и ничего не делаем, нашему телу нужна энергия для основных вещей, таких как дыхание, регулировка гормонов и восстановление клеток. Количество калорий, которые мы сжигаем в состоянии покоя, называется нашей основной скоростью метаболизма. Вы можете использовать онлайн-калькулятор, чтобы найти свой, или измерить его в кабинете врача. Хотя калории, которые вы сжигаете каждый день, могут сильно различаться в зависимости от того, насколько вы активны, ваш BMR остается довольно постоянным.Это регулируется гормонами. Все люди разные, в зависимости от генетики, возраста, пола и телосложения. По мере того как мы стареем, «в нашем организме происходят реальные гормональные изменения, которые затем влияют на то, как мы накапливаем жир и теряем жир», — объясняет Грэдни. «Наша скорость метаболизма фактически снижается из-за этих различий в гормонах».
Тридцать называют магическим числом, но на самом деле можно ожидать, что самые большие изменения произойдут ближе к менопаузе.
Эпическое замедление обычно случается позже, чем мы думаем.Грэдни говорит: «Менопауза — это скорее индикатор того, когда она наступит, а в среднем около 50». Хотя несколько гормонов важны для регулирования метаболизма, снижение уровня эстрогена в период менопаузы имеет большое значение.
Мы также теряем мышечную массу с возрастом, что влияет на количество сжигаемой энергии нашим телом.
По данным Harvard Health, производство гормона роста гипофизом также более заметно замедляется с возрастом. Гормон роста стимулирует рост клеток, и это особенно важно, когда мы молоды и, да, растем.Но на протяжении всей нашей жизни гормон используется для наращивания мышечной массы, увеличения производства белка и эффективного использования жира. По словам Джеки Баумринд, доктора медицинских наук, доктора медицинских наук, диетолога Selvera Wellness, при снижении гормона роста ваше тело также не может создавать или поддерживать мышцы, и это может повлиять на то, насколько эффективно ваше тело расщепляет калории.
Изменения других гормонов и другие возрастные изменения, такие как повреждение клеток и воспаление, могут в дальнейшем привести к саркопении или возрастной потере мышечной массы.Мышечные волокна могут разрушаться быстрее и восстанавливаться медленнее. «Мышечная масса более метаболически активна, чем жировая», — говорит Баумринд, что означает, что она требует от нашего тела больше энергии, чтобы поддерживать себя. Меньшая мышечная масса означает, что наши тела будут сжигать меньше калорий в состоянии покоя.
Увеличение веса к 30 годам может быть частично связано с изменением метаболизма, но, вероятно, виноваты другие.
Грэдни говорит, что ваш метаболизм может начать очень медленно снижаться к 30-40 годам, но изменения в образе жизни в это время (о которых вы, возможно, даже не подозреваете) обычно более ответственны за набор веса.«Большинство людей в 20 лет намного активнее, чем в 30», — говорит Грэдни. «Оцените, какой у вас уровень физической активности с течением времени, и поддерживайте его», — предлагает она. Если ваш образ жизни изменился — возможно, у вас только что родился ребенок (который сопровождается собственными гормональными изменениями) или вы получили большое повышение по службе и работаете больше часов, — это может означать, что вы проявите изобретательность и хитрость в приспособлении к деятельности. То же самое и со здоровым питанием.
Хорошие новости: физическая активность и забота о своем теле могут дольше поддерживать ускоренный обмен веществ.
Ваша генетика, конечно, имеет значение, но то, как вы заботитесь о себе, также имеет значение. «Если у вас хорошие гены, но вы не занимаетесь спортом и не питаетесь правильно, все равно существует риск того, что вы заметите это снижение раньше», — говорит Грэдни. «Лучше всего оставаться физически активным, поддерживать мышечную массу и правильно питаться. Если вы будете поступать так, прогрессирующий спад будет медленнее ». Если генетика на вашей стороне, и вы прилагаете усилия, чтобы поддерживать здоровые привычки на протяжении многих лет, она говорит, что вы можете предотвратить большие изменения метаболизма, пока не приблизитесь к своим 60, а для некоторых — даже к началу 70.Тридцать шмирт.
Важность скорости метаболизма — Лечебная физкультура
Разве не было бы замечательно, если бы вы могли упростить и упростить поддержание заданной массы тела? Хорошая новость заключается в том, что в основе каждой программы поддержания веса лежит несколько основных принципов, которые подходят каждому. Если вы хотите сохранить свой текущий вес или сбросить несколько фунтов, вот несколько советов, которые помогут вам оставаться здоровым и добиваться поставленных целей.
Давайте сначала поговорим об основах.Человеческое тело всегда сжигает калории, даже когда спит. Калории, сжигаемые в состоянии покоя, используются для выполнения важных функций, таких как клеточное дыхание, поддержание температуры тела, доставка крови и питательных веществ к тканям и восстановление повреждений клеток. Количество калорий, сжигаемых вашим телом в состоянии покоя за один день, называется базовой скоростью метаболизма (BMR). Каждый человек имеет уникальный BMR, потому что этот показатель зависит от ряда переменных, включая возраст, генетику, пол, вес, жировые отложения и диету.
Таблица 1 : Базальный уровень метаболизма (BMR) — это количество калорий, которое человек сожжет в состоянии покоя за один день. Используйте следующую таблицу для расчета BMR для мужчин и женщин.
BMR для мужчин BMR = 66 + (6,23 x вес в фунтах) + (12,7 x рост в дюймах) — (6,76 x возраст в годах)
BMR для женщин BMR = 655 + (4,35 x вес в фунтах) + (4,7 x рост в дюймах) — (4,7 x возраст в годах)
Чтобы подсчитать, сколько калорий вы сжигаете за день — значение, известное как ваши общие дневные затраты энергии (TDEE), — вам также необходимо учесть количество физической активности, которую вы получить в течение недели.Если вы хотите сохранить свой текущий вес, вам нужно будет потреблять не больше или меньше калорий, которые вы сжигаете каждый день.
Таблица 2 : Общие дневные затраты энергии (TDEE) — это количество калорий, которое человек должен ежедневно потреблять для поддержания своего текущего веса тела. Используйте следующую таблицу для расчета TDEE на основе количества упражнений, выполняемых каждую неделю.
Сидячий BMR X 1,2 (мало или совсем не упражнения, работа за столом)
Легко активный BMR X 1.375 (легкие упражнения / спорт 1-3 дня / нед.)
Mod. активный BMR X 1,55 (умеренные упражнения / спорт 3-5 дней в неделю)
Очень активный BMR X 1,725 (тяжелые упражнения / спорт 6-7 дней в неделю)
Extr. активный BMR X 1.9 (тяжелые ежедневные упражнения / спорт и физическая работа или двухдневные тренировки, например, марафон, соревнования и т. д.)
Чтобы похудеть, ешьте меньше и сжигайте больше
Чтобы похудеть, у вас должен быть дефицит калорий, а это означает, что вам нужно сжигать больше калорий, чем вы едите. В одном фунте накопленного жира содержится примерно 3500 калорий.Чтобы сбросить один фунт, вам понадобится дефицит в 3500 калорий. Лучшая цель — каждый день иметь небольшой дефицит калорий. Если вы подсчитываете, сколько калорий требуется вашему организму каждый день (TDEE), эксперты рекомендуют вычесть 15–20 процентов из этой суммы, чтобы определить оценку ежедневного потребления калорий для здоровья. Результаты следует контролировать и корректировать в соответствии с метаболизмом каждого человека.
Использование силовых тренировок для увеличения скорости метаболизма
Один из простых способов увеличить ваш BMR — это увеличить мышечную массу тела с помощью силовых тренировок.Жировая ткань легко поддерживать в организме, а мышцы — нет. Мышцы требуют большого количества калорий для циркуляции крови, обмена газов, восстановления питательных веществ и регулирования температуры. Если вы увеличите свою мышечную массу и уменьшите жировые отложения, вы будете сжигать больше калорий, расслабляясь, сидя за столом, листая журналы и даже во сне. Известно, что мужчины имеют более высокую мышечную массу, поэтому их BMR обычно выше, чем у женщин, на 10-15 процентов.
Упражнения для увеличения расхода энергии
Увеличивая объем физической активности, которую вы выполняете каждую неделю, ваше тело сжигает больше калорий.Например, человек с BMR 2000 калорий будет сжигать 2740 калорий каждый день, если будет заниматься от одного до трех дней в неделю. Этот же человек может сжигать 3450 калорий каждый день, увеличив свой распорядок дня до шести или семи дней в неделю.
Управление весом — это не только ваша диета, это баланс между упражнениями и потреблением калорий, чтобы вы оставались в форме и здоровыми (чтобы увидеть, как были рассчитаны эти цифры, используйте информацию, представленную в Таблице № 2 выше).
Избегайте низкокалорийной диеты, которая снижает скорость метаболизма
Если вы слишком быстро сокращаете калории, ваш BMR может снизиться на 20–30 процентов, что означает, что ваша диета не дает вам сжигать калории.При чрезмерно ограничительной диете ваша щитовидная железа не будет работать должным образом, обмен веществ замедлится, а мышечная масса будет потеряна. Американский колледж спортивной медицины (ACSM) рекомендует НИКОГДА не опускаться ниже 1200 калорий для женщин и 1800 калорий в день для мужчин. Лучший способ достичь идеального веса — снизить дефицит калорий и увеличить еженедельный уровень активности.
Если у вас есть вопросы или опасения по поводу того, какие упражнения делать, проконсультируйтесь с вашим местным физиотерапевтом.
.
 Eur. Heart J., 28: 88-136.
Eur. Heart J., 28: 88-136. Bone Marrow Transplant., 34: 149-154.
Bone Marrow Transplant., 34: 149-154. J. Clin. Endocrinol. Metab., 91: 3171-3180.
J. Clin. Endocrinol. Metab., 91: 3171-3180. Circulation, 107: 448-454.
Circulation, 107: 448-454.