Повышенный лептин: Повышенный уровень лептина может влиять на протекание СМА
Повышенный уровень лептина может влиять на протекание СМА
Новое исследование установило, что практически у половины молодых людей с диагнозом спинальная мышечная атрофия (СМА) — особенно имеющих небольшой вес наблюдается аномально высокий уровень лептина, метаболического гормона, который может быть связан и с тяжестью течения болезни, и с ограничением подвижности.
Результаты исследования показывают, что СМА связана с аномальными метаболическими процессами. Ученые предлагают измерять уровень лептина перед тем, как использовать для пациентов высокоэнергетические диеты, а также использовать измерения лептина в качестве биомаркера течения болезни.
Исследование «Гиперлептинемия у детей с аутосомно-рецессивной спинальной мышечной атрофией I-III типа» появилась в журнале PLOS ONE. Оно подчеркивает важность изучения того, как метаболические и другие связанные со СМА механизмы взаимодействуют в повышении встречаемости метаболического синдрома при СМА.Хотя врачи и исследователи знают о том, что потеря веса или остановка прибавки в весе — это часть течения СМА, исследователи немецкого Университета Дуйсбург-Эссен отметили, что очень малое количество исследований изучали роль гормонов в энергетическом метаболизме таких пациентов. Поэтому они выбрали 43 пациента со СМА 1-3 типа в возрасте от полугода до 21 года 8 месяцев.
Исследователи измеряли ряд следующих факторов: параметры роста, нервно-мышечную функцию, уровень глюкозы в крови, инсулин, лептин и гемоглобин. Из 43 пациентов у 35 измерили лептин, исследователи обнаружили, что у 15 из них повышенный уровень лептина. Из них 60% имели недостаточный вес, 33% — нормальный вес и 7% — избыточный вес.
Уровень лептина соотносился и с типом СМА, и с тяжестью нарушения функций движения.
Исследователи также отметили, что индекс массы тела (ИМТ) и тип СМА соотносятся, принимая во внимание тот факт, что участники исследования со СМА 1 и 2 типа имели очень низкий вес. Кроме того, ученые обнаружили у 8 девочек из 21, принимавших участие в исследовании (38%), оволосение по мужскому типу, известное как гирсутизм — и у 7 из этих 8 девочек был повышенный уровень лептина.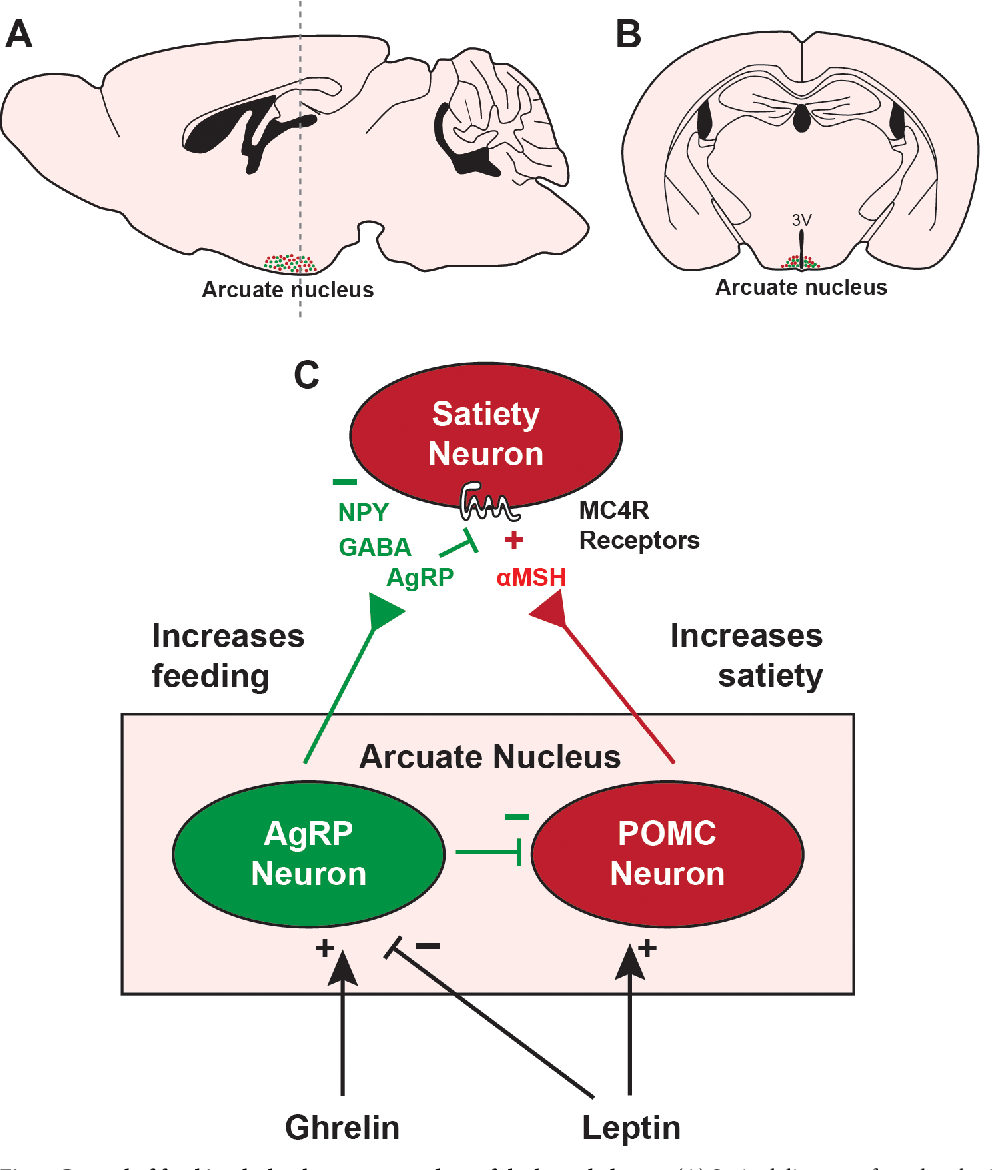
Лептин — это гормон, который выделяется из жировой ткани, и его повышенный уровень увеличивает расход энергии и расщепление жира, одновременно снижая чувство голода. У детей с нормальным развитием высокий уровень лептина — который часто называют гормоном насыщения — приводит к повышению ИМТ, однако ученым не удалось обнаружить такую связь у участников исследования.
Исследователи полагают, что потеря мышечной ткани — которая часто заменяется жиром — может привести к повышенному уровню лептина. Поэтому хотя ИМТ пациента с СМА может быть низким, большая часть ткани все же может состоять из жира. Ученые также сообщили, что нейродегенеративные изменения могут оказать влияние на регуляцию, что в свою очередь может привести к выделению лептина.
Источник: Smanewstoday . Перевод выполнен специально для БФ «Семьи СМА»«Благодаря развивающимся возможностям медицинской помощи и высоким стандартам программы обслуживания у пациентов с СМА увеличивается продолжительность жизни,» — заключили исследователи. «Повышенный брюшной жир, гирсутизм и преждевременное пубархе (преждевременное появление лобкового оволосения), преждевременное оволосение, которое чаще всего наблюдается у детей с СМА I-III типа, составляют факторы риска для развития метаболического синдрома. Врачебное наблюдение за такими пациентами с детских лет до зрелого возраста должно принимать эти факторы во внимание.»
24/04/2017
Анализы на уровень лептина в лаборатории СИНЭВО
Всем без исключения известны чувства голода, а также насыщения, но откуда они появляются?
 Этот гормон играет важную роль в нормальной жизнедеятельности человека и выполняет следующие функции:
Этот гормон играет важную роль в нормальной жизнедеятельности человека и выполняет следующие функции:- снижает аппетит;
- уменьшает общее потребление пищи;
- способствует формированию чувства голода;
- ускоряет липолиз или распад жиров;
- увеличивает синтез гликогена в мышечных тканях;
- способствует более быстрой утилизации глюкозы из крови;
- препятствует эктопическому отложению жиров в тканях при переедании.
Любые нарушения в процессе выработки этого важного гормона могут привести к избыточному употреблению пищи, что, в свою очередь, может стать причиной ожирения.
Среди факторов, негативно влияющих на общий уровень лептина в крови, можно выделить такие, как:
- чрезмерное употребление фруктозы;
- стрессовое состояние;
- недостаточное количество сна;
- повышенный уровень инсулина;
- чрезмерные физические нагрузки;
- большое употребление в пищу пектина или мучных изделий;
- переедание.
Стоит обязательно обратиться к врачу и пройти обследование, сдать анализы на уровень гормона в том случае, если вы заметили у себя следующие симптомы:
- очень рано появилось выраженное ожирение, что может свидетельствовать о генетическом дефиците лептина;
- нарушилась репродуктивная функция при чрезмерном снижении питания, а также слишком интенсивных физических нагрузках;
- имеются рецидивирующие тромбозы.
Определить уровень данного гормона в крови может быть полезным и при комплексном исследовании проблем, которые могут быть связаны со снижением или же повышением веса, с ранним выявлением риска различных сердечнососудистых заболеваний или же при диагностике диабета.
В качестве метода исследования лептина применяется иммуноанализ. Для проведения данной процедуры имеются определенные требования. Биоматериал, предназначенный для исследования, сдается только натощак. Причем к моменту забора крови после последнего употребления пищи должно пройти не меньше 8-12 часов. Для получения достоверных результатов прием любых других напитков кроме воды не допускается.
Для получения достоверных результатов прием любых других напитков кроме воды не допускается.
В большинстве случаев повышение уровня рассматриваемого гормона в крови вызывается такими заболеваниями, как:
- метаболический синдром;
- алиментарное ожирение, вызванное нерегулярным и неправильным питанием;
- переедание;
- инсулинонезависимый сахарный диабет (ИНСД).
Уровень ниже нормы может наблюдаться в следующих случаях:
- неполноценное и недостаточное питание;
- нарушения функции выработки гормона;
- нарушения и сбои в процессе работы рецепторов, отвечающих за проведение необходимых гормональных сигналов.
Проведение такой процедуры, как иммуноанализ, является очень важным и необходимым, так как позволяет не только определить причины патогенеза ожирения, но и провести полноценное обследование тех больных, которые страдают от метаболического синдрома.
За уровнем лептина в крови необходимо следить, потому что его повышение может привести к появлению тромбоза, инфарктов или инсультов, особенно у людей с избыточным весом. От него зависит и уровень артериального давления, а также концентрация атерогенных липопротеидов. В связи с тем, что данный гормон оказывает существенное влияние на эластичность артерий, даже при здоровом образе жизни у человека при повышенном его содержании могут появиться серьезные проблемы с сердечнососудистой системой.
Чем еще опасен лептин?
Его высокое содержание в крови активно подавляет выработку инсулина, что приводит к развитию такого заболевания, как сахарный диабет. Также при отказе от приемов пищи низкая концентрация гормона способствует появлению аменореи или отсутствию менструаций.
Исследования указывают на то, что у основной массы людей, страдающих от ожирения, наблюдается увеличение содержания данного гормона в крови в несколько раз. Причем причина этого кроется в потере чувствительности гипоталамуса к действиям вырабатываемого гормонального вещества. Мозг человека продолжает давать ложные сигналы о необходимости запасать энергию. Подобные процессы чаще всего являются генетическим дефектом. В таких случаях требуется квалифицированная помощь эндокринолога и других специалистов.
Мозг человека продолжает давать ложные сигналы о необходимости запасать энергию. Подобные процессы чаще всего являются генетическим дефектом. В таких случаях требуется квалифицированная помощь эндокринолога и других специалистов.
Где сдать анализ лептин
Ожирение и гормон лептин — fitLabs / Ирина Брехт
Принято считать, что толстые люди — безвольные, ленивые, слабые, неспособные взять себя в руки. Хотя причины ожирения сложны и разнообразны, современные исследования показывают, что дело не столько в силе воле, сколько в биохимии организма, и особое внимание уделяется гормону лептину, который был открыт совсем недавно (1).
Что такое лептин?
Лептин сообщает о том, сколько в организме запасено энергии. Когда его много, мозг понимает, что в организме достаточно жира (энергии). Как результат, нет сильного голода, а скорость обмена веществ на хорошем уровне (5).
Когда лептина мало, это сигнал, что и жировых запасов (энергии) мало, что означает голод и возможную смерть. В результате снижается обмен веществ, а голод растет.
Таким образом, главная роль лептина — долгосрочное управление энергетическим балансом (6). Он помогает поддерживать организм во время голода, давая сигнал мозгу включать аппетит и снижать метаболизм. Он же защищает от переедания, «выключая» голод (7).
Резистентность к лептину
У людей с ожирением высокий уровень лептина (10) По логике, мозг должен знать, что энергии запасено в организме более чем достаточно, но иногда чувствительность мозга к лептину нарушена. Это состояние называется лептин-резистентностью и в настоящее время считается основной биологической причиной ожирения (12).
Это состояние называется лептин-резистентностью и в настоящее время считается основной биологической причиной ожирения (12).
Когда мозга теряет чувствительность к лептину, нарушается управление энергетическим балансом. Жировых запасов в теле много, лептина производится тоже много, но мозг его не видит. Лептин-резистентность – это когда ваше тело думает, что вы голодаете (хотя это не так) и настраивает пищевое поведение и обмен веществ соответственно (11, 13, 14, 15):
- Человек может чувствовать голод постоянно, еда не насыщает, из-за чего он ест намного больше нормы.
- Снижается активность, уменьшаются траты калорий в состоянии покоя, снижается обмен веществ.
Человек ест слишком много, двигается мало, становится вялым, обмен веществ его и активность щитовидной железы снижены, лишний вес вплоть до ожирения — результат.
Это замкнутый круг:
- Он ест больше и накапливает больше жира.
- Больше жира в организме означает, что выделяется больше лептина.
- Высокий уровень лептина заставляет мозг снижать чувствительность своих рецепторов к нему.
- Мозг перестает воспринимать лептин и думает, что пришел голод и заставляет есть больше и тратить меньше.
- Человек ест больше, тратит меньше и накапливаете еще больше жира.
- Лептина еще больше. И так далее.
Что вызывает лептин-резистентность?
1. Воспалительные процессы
Воспаление в организме может протекать бессимптомно. У людей с ожирением подобные процессы могут происходить в подкожно-жировой клетчатке при сильном переполнении жировых клеток или в кишечнике из-за увлечения «западной» диетой, богатой на рафинированные, переработанные продукты.
К месту воспаления поступают иммунные клетки, называемые макрофагами, и выделяют воспалительные вещества, некоторые из которых мешают работе лептина.
Что делать:- Увеличить омега-3-кислоты в еде (жирная рыба, лён, добавки с рыбьим жиром).

- Биофлавоноиды и каротиноиды так же показывают противовоспалительные свойства. Ими богаты имбирь, вишня, черника, смородина, черноплодная рябина и другие темные ягоды, гранаты.
- Снижение уровня инсулина (о нем — ниже).
2. Фастфуд
Фастфуд и западная диета с большим количеством переработанных продуктов так же может быть причиной лептин-резистентности. Предполагается, что основной виновник этого — фруктоза, которая широко распространена в виде добавок в продукты питания и как одна из составляющих сахара (31).
Что делать:- Отказаться от переработанной еды (23).
- Употреблять в пищу растворимую клетчатку (24).
3. Хронический стресс
Хронически повышенный стрессовый гормон кортизол снижает чувствительность рецепторов мозга к лептину.
4. Нечувствительность к инсулину
Когда в организм поступает очень много углеводов, выделяется много инсулина, чтобы убрать глюкозу из крови. Если инсулина хронически много, клетки теряют чувствительность к нему. В этих условиях неиспользованная глюкоза превращается в жирные кислоты,что мешает транспорту лептина в мозг (28).
Что делать:- Силовые тренировки помогают возвращать чувствительность к инсулину.
- Ограничить простые углеводы в питании.
5. Лишний вес и ожирение
Чем больше жира в теле, тем больше производится лептина. Если лептина слишком много, мозг снижает количество рецепторов к нему, и его чувствительность к нему снижается. Так что это порочный круг: больше жира = больше лептина = больше резистентность к лептину = больше жира в организме.
Что делать:- Снизить вес с помощью правильного питания и физической активности (25, 30).
6. Генетика
Иногда встречается генетически нарушенная чувствительность рецепторов мозга к лептину или мутации в самой структуре лептина, которые не дает мозгу его увидеть. Считается, что до 20% страдающих ожирением, имеют эти проблемы.
Что делать?
Лучший способ узнать, есть ли у вас резистентность к лептину — узнать свой процент жира. Если у вас высокий процент жира, который говорит об ожирении, если у вас много лишнего веса особенно в области живота, есть вероятность.
Так же для первичной диагностики ожирения используется индекс массы тела (BMI — body mass index). Рассчитать его можно по формуле:
ИМТ = вес тела в кг : (рост в кв.м.)
Пример: 90 кг : (1,64 х 1.64) = 33.4
Хорошая новость в том, что лептин-резистентность в большинстве случаев обратима. Плохая — в том, что пока нет простого способа сделать это, как и не существует пока лекарства, которое способно улучшить чувствительность к лептину. Пока в арсенале худеющего знакомые всем советы по смене образа жизни — здоровая диета, контроль калорий, силовые тренировки и повышение ежедневной бытовой активности.
Печень — двигатель метаболизма — Остеопат Мушаилов Руслан Эрсельевич
Лептин так же контролирует иммунную систему в мозге. Химически он очень похож на воспалительное соединение, называемое IL-6 (интерлейкин-6), и у людей с высоким уровнем лептина (у толстых людей) мы видим высокие уровни белых кровяных клеток. Он так же модулирует все воспалительные цитокины, ассоциируемые с висцеральным жиром. Обычно, когда кто-то устойчив к лептину, он так же имеет низкие уровни витамина D. Это можно использовать в качестве прокси для оценки статуса лептина у пациентов.
Висцеральный жир — это жир, находящийся позади «кубиков» (мышц пресса) в брюшной полости. Это одно из наихудших мест расположения жира, потому что оно очень воспалительно. Так же это жир, наблюдаемый в клетках печени у диабетиков 2-го типа. Это называется «метаболический синдром» или «неалкогольная жировая болезнь печени». Повышенный лептин — это первый знак перед тем, как покажется повышенное давление, которое вызовет каскад физиологических проблем. Причина этого в том, что высокие уровни лептина разрушают другой белок, секретируемый бета-клетками поджелудочной железы, называемый амилин. Бета-клетки в поджелудочной железе производят инсулин. Теперь вы знаете, почему высокие уровни лептина (жира) вызывают диабеты 2-го типа. Высокий лептин поджаривает амилин в бета-клетках и, в конце концов, заставляет их перестать делать инсулин. Если это продолжается долгое время, это может вызвать диабет 2-го типа.
Бета-клетки в поджелудочной железе производят инсулин. Теперь вы знаете, почему высокие уровни лептина (жира) вызывают диабеты 2-го типа. Высокий лептин поджаривает амилин в бета-клетках и, в конце концов, заставляет их перестать делать инсулин. Если это продолжается долгое время, это может вызвать диабет 2-го типа.
Если этот процесс происходит быстро, например из-за аутоиммунного ответа, окружающего беременность, или из-за повышенной кишечной проницаемости (leaky gut), вы можете получить аутоиммунный диабет, часто называемый диабет типа 1.5. Единственная разница между типом 2 и 1.5 в том, что время меньше и иммунный ответ гораздо больше. Опять же, всё опосредовано устойчивостью к лептину. Хроническое повышение лептина приводит к лептиновой устойчивости, и обычно происходит за 5-7 лет до того, как человек становится устойчив к инсулину! (диабет 2 типа).Сегодняшняя медицина фокусируется на инсулине для лечения диабета. На мой взгляд, это удар совершенно мимо ворот.
Нет никакого смысла в лечении резистентности к инсулину после того, как она произошла. Имеет смысл целить по лептиновой резистентности, потому что она происходит за 5-7 лет перед инсулиновой! Теперь ясно, что ожирение — это воспалительное заболевание. Но мы знаем, ожирение имеет несколько причин. Ожирение не является болезнью излишка калорий.
Почему? Потому что тело имеет несколько встроенных способов борьбы с избытком калорий, благодаря которым вы никогда не потолстеете, если лептин работает должным образом в печени и мышцах. Эта тема будет рассмотрена в последующих статьях блога. Ожирение является воспалительным заболеванием и нарушением гормональной сигнализации. Вот почему вы хотите, чтобы ваш врач бдительно наблюдал за показателем уровня вашего высокочувствительного или сердечного C-реактивного белка (HS-CRP). Теперь вы знаете, почему я делаю этот тест у всех моих пациентов с проблемами с позвоночником.
Проблемы с лептином говорят мне, что у пациента будет возникать остеохондроз и остеопороз до тех пор, пока я наконец не решу его проблему с лептином. На мой взгляд, это тот тест, который в медицине необходимо контролировать больше, чем любой другой. Он может рассказать нам кучу всего о текущем клеточном рельефе. То, что происходит с вашими клетками, определяет и то, что в конечном счёте произойдёт и с вами. Если ваш уровень воспаления повышен, плохие вещи ожидают вас в будущем. Это ключевой момент, который нужно запомнить. Устойчивость к лептину всегда предшествует развитию устойчивости к инсулину… (минус травматическая потеря поджелудочной железы), и если обе устойчивости происходят достаточно долго, это ведёт к надпочечниковой усталости. А надпочечниковая усталость означает, что у вас будет проблема с КОРТИЗОЛОМ. Когда инсулин и кортизол повышаются одновременно и хронически, это именно то, как происходят рак и хронические заболевания, путем влияния на ген р53 (онкогенез). Все они начинаются с проблемы с лептином, а не инсулином.
На мой взгляд, это тот тест, который в медицине необходимо контролировать больше, чем любой другой. Он может рассказать нам кучу всего о текущем клеточном рельефе. То, что происходит с вашими клетками, определяет и то, что в конечном счёте произойдёт и с вами. Если ваш уровень воспаления повышен, плохие вещи ожидают вас в будущем. Это ключевой момент, который нужно запомнить. Устойчивость к лептину всегда предшествует развитию устойчивости к инсулину… (минус травматическая потеря поджелудочной железы), и если обе устойчивости происходят достаточно долго, это ведёт к надпочечниковой усталости. А надпочечниковая усталость означает, что у вас будет проблема с КОРТИЗОЛОМ. Когда инсулин и кортизол повышаются одновременно и хронически, это именно то, как происходят рак и хронические заболевания, путем влияния на ген р53 (онкогенез). Все они начинаются с проблемы с лептином, а не инсулином.
Двигатель метаболизма — это печень, а не щитовидная железа
Лептин для ИФА диагностики — Новамедлайн
Реагент Leptin Human ELISA предназначен для определения уровня гормона лептина в крови или других биологических жидкостях с использованием иммуноферментного метода.
Лептин вырабатывается специальными клетками жировой ткани — адипоцитами. Основная биологическая функция состоит в регуляции энергетического обмена, как следствие, массы тела. На физиологическом уровне лептин способен блокировать синтеза нейропептида Y, отвечающего за возбуждение аппетита. Лептин также влияет на синтез половых гормонов, участвует в регулировании менструации и овуляции, особенно повышается в пубертатном периоде, как у женщин, так и у мужчин. При ожирении у представителей мужского пола повышается уровень лептина, снижается выработка тестостерона, изменяется голос, фигура, становится более мягким характер, иными словами – организм перестраивается на работу в соответствии с женским фенотипом.
При этом ожирение развивается не в связи с уменьшением уровня лептина, а в результате снижения у рецепторов мозга чувствительности к нему.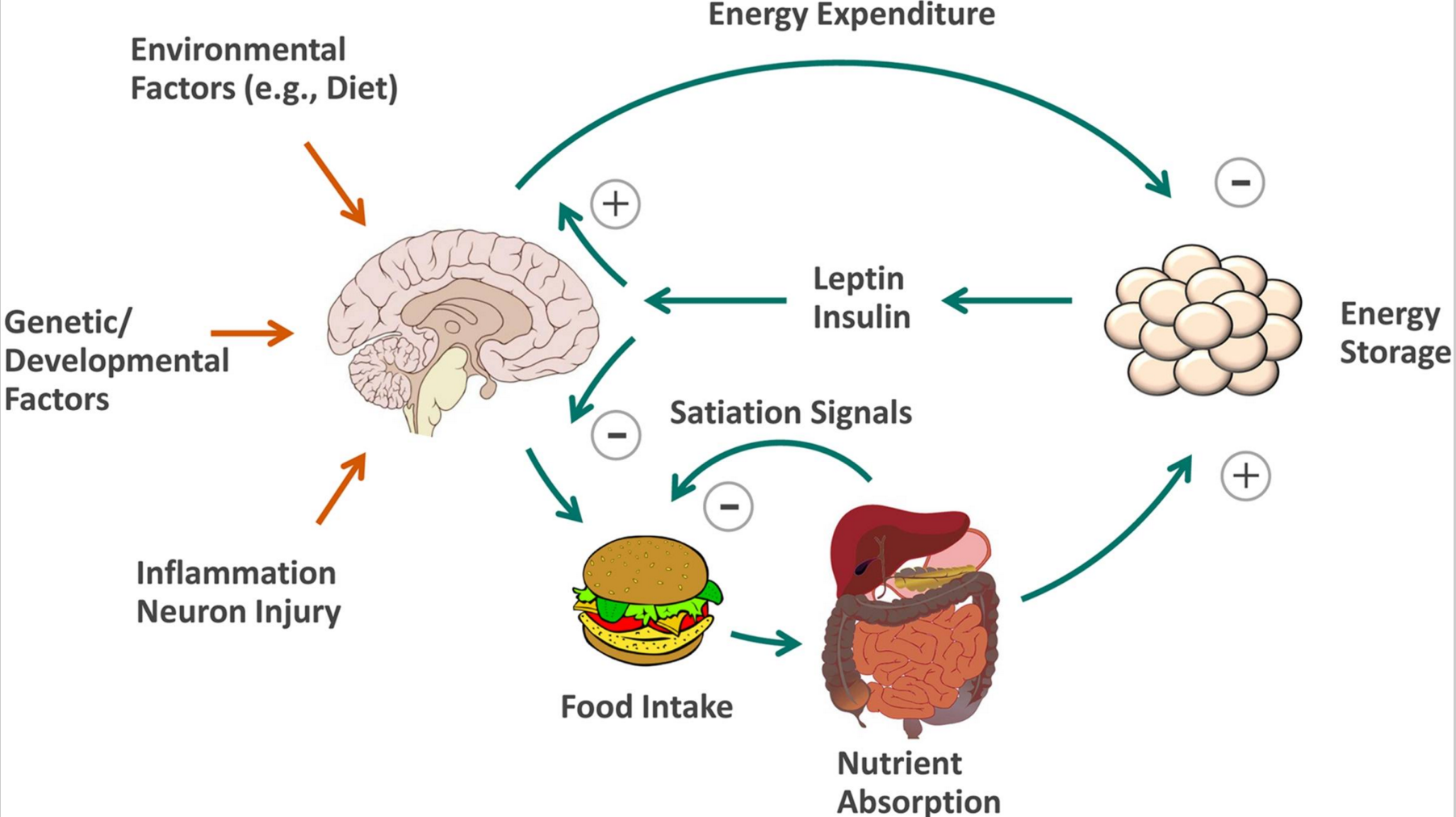 Только в редких случаях наследственного недостатка лептина развивается ожирение. При этом обычно у людей с ожирением наблюдаются повышенные показатели лептина. Считается, что проблема не в концентрации данного гормона, а в нарушении переноса лептина и восприятия его клетками коры головного мозга. Одновременно резистентность к лептину при диагностике считается одним из факторов повышения уровня сахара и, как следствие, сахарного диабета без выраженной инсулиновой зависимости. Повышенный уровень лептина влияет на сердечнососудистую систему и снижает эластичность сосудов, также может способствовать тромбообразованию, в результате – инсульту.
Только в редких случаях наследственного недостатка лептина развивается ожирение. При этом обычно у людей с ожирением наблюдаются повышенные показатели лептина. Считается, что проблема не в концентрации данного гормона, а в нарушении переноса лептина и восприятия его клетками коры головного мозга. Одновременно резистентность к лептину при диагностике считается одним из факторов повышения уровня сахара и, как следствие, сахарного диабета без выраженной инсулиновой зависимости. Повышенный уровень лептина влияет на сердечнососудистую систему и снижает эластичность сосудов, также может способствовать тромбообразованию, в результате – инсульту.
Предложенный набор для ИФА позволяет определить концентрацию гормона в исследуемом материале. Должен использоваться при необходимости диагностики заболеваний у пациентов, относящихся к группам риска, при:
- тромбозах;
- бесплодии на фоне недостатка питания;
- при диагностике диабета II типа;
- генетическом дефиците лептина.
Секреция лептина у женщин с избыточным весом в зависимости от степени нарушения углеводного обмена | Древаль
В настоящее время принято рассматривать жировую ткань как отдельный орган, являющийся местом синтеза различных гормонов и биологически активных пептидов, таких как лептин, адипонектин и многие другие, большинство из которых влияют на патогенетические механизмы развития сахарного диабета 2 типа (СД2) [1, 2].
Наиболее изученным в настоящее время является лептин, синтезируемый адипоцитами, основной функцией которого является снижение аппетита [1]. Участие лептина в механизмах нарушения углеводного и липидного обмена является предметом активного изучения клиницистов и патофизиологов. Известно, что лептин участвует в механизмах развития инсулинорезистентности (ИР), в частности повышает элиминацию глюкозы в мышечной и жировой ткани [3, 4] и снижает продукцию глюкозы печенью [4]. Важнейшим свойством лептина является его антистеатогенный эффект, препятствующий эктопическому, вне жировой ткани, накоплению триглицеридов, индуцирующих ИР [5]. При ожирении развиваются гиперлептинемия и лептинорезистентность, что ведет к развитию относительного дефицита лептина и, соответственно, снижению его физиологических эффектов [6].
При ожирении развиваются гиперлептинемия и лептинорезистентность, что ведет к развитию относительного дефицита лептина и, соответственно, снижению его физиологических эффектов [6].
Особенности секреции лептина в зависимости от степени нарушения углеводного обмена в современной литературе представлены недостаточно.
Цель настоящего исследования
— оценка секреции лептина у женщин с избыточной массой тела без нарушений углеводного обмена, с ранними нарушениями углеводного обмена (РНУО) и впервые выявленным СД2.
Материалы и методы
Исследование проведено на базе Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского (МОНИКИ). В исследование были включены 59 женщин, медиана возраста составила 54 [48–60] года, медиана индекса массы тела (ИМТ) – 33,2 [29,0–37,2] кг/м2. В исследование не включались больные, ранее получавшие сахароснижающую терапию, имеющие хроническую почечную недостаточность, повышение уровня печеночных трансаминаз более чем в 2 раза. Исключены лица, принимавшие глюкокортикоиды менее чем за 3 месяца до включения в исследование. Всеми больными подписано информированное согласие на участие в исследовании.
У больных производился сбор жалоб и анамнеза, физикальный осмотр.
Всем обследуемым (за исключением больных с уровнем гликемии более 7 ммоль/л не менее чем в двух повторных исследованиях) проводился пероральный глюкозотолерантный тест (ПГТТ). Диагнозы СД2 и РНУО были установлены в соответствии с диагностическими критериями ВОЗ 1999г.
Глюкоза плазмы крови исследовалась с помощью биохимического анализатора Hitachi 912 (Hoffmann-La Roche Ltd/Roche Diagnostics GmbH).
Исследование уровня гликированного гемоглобина (HbA1с) проводили методом жидкостной хроматографии на анализаторе гликозилированного гемоглобина DS5 Glycomat (фирма Drew Scientific, Нидерланды).
Инсулин определяли РИА-методом с помощью тест-систем Immunotech RIA (Чехия).
Индекс НОМА-IR (homeostasis model assessment – insulin resistance) рассчитывали по формуле:
НОМА-IR = (ИПН х ГПН)/22,5,
где ИПН – инсулин плазмы натощак (мкЕд/мл), для перевода пмоль/л в мкЕд/мл использовали формулу пмоль/л/6,945;
ГПН – глюкоза плазмы натощак (ммоль/л).
Лептин плазмы натощак (ЛПН) измеряли методом планшетного двухслойного иммуноферментного анализа (сэндвич-ИФА). Тест-система: набор для измерения лептина производства фирмы DRG Instruments GmbH (Германия).
Определение уровня общего холестерина (ОХ), липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ) оценивали с помощью биохимического анализатора Hitachi 912 (Hoffmann-La Roche Ltd/Roche Diagnostics GmbH, Швейцария-Германия).
Внутривенный тест толерантности к глюкозе (ВТТГ) проводили лицам с РНУО и больным СД2 путем внутривенного болюсного введения раствора 40% глюкозы (из расчета 0,75 г глюкозы на кг массы тела) с последующим забором крови для определения уровней глюкозы. Схема забора крови: -20, -10, 0 (точка введения глюкозы), 2, 3, 4, 5, 6, 8, 10, 14, 19, 22, 24, 27, 30, 40, 50, 70, 90, 120, 150, 180-я минута. В каждой точке определяли глюкозу в условиях биохимической лаборатории. Уровни инсулина и лептина оценивались натощак, через 70 и 120 минут после в/в введения глюкозы.
Статистическая обработка полученных результатов осуществлялась при помощи программ SPSS версия 13.4 для Windows. Результаты представлены в виде медианы и интерквартильного интервала Ме [25–75] (Ме – медиана; 25 и 75 – 1-й и 3-й квартили). Для сравнения парных количественных показателей использовался критерий Уилкоксона. Для сравнения непарных показателей использовался тест Манна-Уитни. Различия считали статистически значимыми при p <0,05 (95% уровень значимости). Для изучения взаимосвязи между количественными показателями применялся метод корреляции Спирмена.
Результаты
Медиана ЛПН обследуемой группы составила 27,4 [14,3–46,4] нг/мл, что соответствует верхней границе нормы (1,1–27,6 нг/мл). Группы исходно были сопоставимы по возрасту и ИМТ. Общая характеристика групп, участвующих в исследовании, представлена в таблице 1.
Между уровнем ЛПН и возрастом наблюдалась отрицательная корреляционная зависимость (r=–0,4, p <0,008), что может быть связано со снижением с возрастом у женщин уровня эстрогенов, стимулирующих продукцию лептина [7]. Таким образом, у женщин моложе 55 лет уровень лептина был в 2 раза выше, чем у женщин старше 55 лет (р <0,01) (табл. 2).
Таким образом, у женщин моложе 55 лет уровень лептина был в 2 раза выше, чем у женщин старше 55 лет (р <0,01) (табл. 2).
Между уровнем ЛПН и ИМТ отмечалась положительная корреляционная зависимость (r=0,6, р <0,0001). Полученные результаты совпадают с многочисленными литературные данными, отражающими прямую зависимость между жировой массой тела и продукцией лептина [8, 9].
Между уровнем ЛПН и уровнем ИПН выявлена положительная корреляционная зависимость (r=0,4, р <0,005), что подтверждает данные многих международных исследований о взаимосвязи гиперинсулинемии и гиперлептинемии [2, 9].
Медиана содержания лептина в группе женщин без нарушения углеводного обмена составила 42,0 [22–60] нг/мл, что почти в 2 раза превышало уровень лептина у лиц с РНУО и СД2 (р <0,05) (рис. 1). Поскольку продукция лептина связана с инсулинозависимым поступлением глюкозы в адипоциты [10, 11], то обнаруженное относительное снижение продукции лептина у лиц с РНУО, а также больных СД2 можно объяснить снижением потока глюкозы в жировую ткань вследствие выраженного относительного инсулинодефицита по сравнению с лицами без нарушений углеводного обмена, но с избыточной массой тела.
Медиана ЛПН у лиц с РНУО составила 29,1 [13,5–45,7] нг/мл, что несколько превышало данный показатель у больных СД2 – 21,1 [13,6–39,0] нг/мл, несмотря на более низкий ИМТ в подгруппе лиц с РНУО (рис. 1, табл. 1). Уровень HbA1c и ГПН в подгруппе больных СД2 был выше по сравнению с подгруппой с РНУО (р <0,05), что говорит о более выраженном относительном инсулинодефиците у больных СД2 и, как следствие, – снижении синтеза лептина.
У женщин, больных СД2, обнаружена отрицательная корреляционная зависимость между ЛПН и HbA1c (r=‑0,3, р <0,05).
При анализе уровня ЛПН в подгруппе СД2 выявлено, что если у больных уровень HbA1c был в пределах 7–8,5%, медиана ЛПН была более чем в 2 раза выше по сравнению с больными, у которых уровень HbA1c превышал 8,5%: 28,0 [16,8–47,5] и 12,6 [9,2–14,3] нг/мл соответственно (р <0,05) (рис. 2). Обратная зависимость между степенью декомпенсации диабета и уровнем ЛПН наблюдалась и в других исследованиях [8, 12]. Поскольку продукция лептина прямо зависит от концентрации инсулина в крови, то обнаруженное снижение уровня ЛПН у больных СД2 на фоне декомпенсации диабета можно объяснить увеличением относительного дефицита инсулина, что в условиях длительной ИР приводит к снижению инсулинзависимой секреции лептина, которая восстанавливается при назначении эффективной сахароснижающей терапии (компенсации диабета).
2). Обратная зависимость между степенью декомпенсации диабета и уровнем ЛПН наблюдалась и в других исследованиях [8, 12]. Поскольку продукция лептина прямо зависит от концентрации инсулина в крови, то обнаруженное снижение уровня ЛПН у больных СД2 на фоне декомпенсации диабета можно объяснить увеличением относительного дефицита инсулина, что в условиях длительной ИР приводит к снижению инсулинзависимой секреции лептина, которая восстанавливается при назначении эффективной сахароснижающей терапии (компенсации диабета).
Прогрессирование гиполептинемии при развитии нарушений углеводного обмена у лиц с избыточной массой тела (то есть в условиях лептинорезистентности) аналогично нарушению секреции инсулина (в условиях длительно существующей ИР). Снижение физиологических эффектов лептина ведет к уменьшению антилипотоксического эффекта, снижению элиминации глюкозы, увеличению продукции глюкозы печенью, то есть прогрессированию ИР. Таким образом, развивается «порочный круг»: прогрессирование гиперлептинемии в условиях лептинорезистентности приводит к развитию ИР за счет снижения физиологических эффектов лептина. В дальнейшем секреция лептина снижается в связи со снижением стимулированного инсулином синтеза лептина и развивается абсолютная гиполептинемия (рис. 3).
Уровень лептина через 2 ч после болюсного внутривенного введения глюкозы (ЛП2) снизился с 29,1 [13,5–45,7] нг/мл до 22,2 [11,3–30,8] нг/мл в подгруппе лиц с РНУО (р <0,05), и с 21,1 [13,6–39,0] нг/мл до 18,9 [11,8–31,8] нг/мл в подгруппе больных СД 2 типа (р <0,01) (табл. 3).
Между процентом снижения лептина в группе СД2 (11%) и процентом снижения лептина в группе лиц с РНУО (23,1%) выявлено достоверное различие (р=0,02). В группе больных СД2 наибольшее снижение лептина наблюдалось в подгруппе с умеренной декомпенсацией диабета (HbA1c 7–8,5%), где отмечалась наиболее выраженная стимуляция секреции инсулина (площадь под инсулинемической кривой (ПИК) – 21 425 [9832–36 776]) (табл. 4).
Наличие данных закономерностей позволило нам предположить, что при СД2 и РНУО степень снижения лептина через 2 ч после внутривенного введения глюкозы находится в прямой зависимости от степени стимулированной секреции инсулина. Наличие положительной корреляционной зависимости между степенью снижения лептина и процентом увеличения инсулина плазмы через 70 минут у больных СД2 после в/в введения глюкозы (r=0,5, p <0,05) показывает, что снижение лептина в условиях внутривенной нагрузки глюкозой находится в зависимости от второй фазы секреции инсулина. У лиц с РНУО обнаружена положительная корреляция между степенью снижения лептина и ПИК (r=0,4, р <0,05).
Наличие положительной корреляционной зависимости между степенью снижения лептина и процентом увеличения инсулина плазмы через 70 минут у больных СД2 после в/в введения глюкозы (r=0,5, p <0,05) показывает, что снижение лептина в условиях внутривенной нагрузки глюкозой находится в зависимости от второй фазы секреции инсулина. У лиц с РНУО обнаружена положительная корреляция между степенью снижения лептина и ПИК (r=0,4, р <0,05).
Итак, наблюдаются, фактически, два феномена зависимости секреции лептина и инсулина у женщин с метаболическим синдромом:
1) прямая зависимость между инсулинемией и уровнем ЛПН;
2) обратная зависимость между инсулинемией и лептинемией в условиях внутривенной углеводной нагрузки.
Первый феномен объясняется известной зависимостью секреции лептина от инсулинзависимого поступления глюкозы в адипоцит [8] – чем выше поступление энергетического субстрата (глюкозы) в клетку, тем интенсивнее идет синтез лептина.
Второй феномен можно объяснить тем, что инсулин обладает самостоятельным, не зависимым от стимуляции транспорта глюкозы в адипоцит, прямым подавляющим влиянием на секрецию лептина, что проявляется только при очень высоких концентрациях инсулина, заведомо выше, чем это необходимо для стимуляции утилизации глюкозы. В этом случае, несмотря на стимулированное поглощение глюкозы адипоцитами, секреция лептина подавляется.
В результате в условиях внутривенной углеводной нагрузки, а тем более при ИР, инсулинемия достигает достаточного для подавления продукции лептина уровня, и мы наблюдаем обратную зависимость между инсулинемией и уровнем лептина в ближайшие 2–3 ч после введения глюкозы. Этот механизм, вероятно, препятствует развитию гиперлептинемии (лептинорезистентности).
В подгруппе больных СД2 выявлена отрицательная зависимость между процентом снижения лептина и НОМА-R (r=-0,5, р <0,001). С другой стороны, процент снижения лептинемии через 2 ч прямо пропорционален инсулинемии во внутривенном тесте (r=0,5, р <0,001). Следовательно, как гиперинсулинемия натощак, так и в тесте связаны с процентом снижения лептина через 2 ч, причем, первый параметр – обратно пропорционально, а второй – прямо пропорционально. Подобные результаты были представлены группой японских ученых в 2005 г., показавших, что у мужчин с индексом НОМА <2,5 отмечалось снижение уровня лептина через 2 ч после пероральной нагрузки 75 г глюкозы, а в группе мужчин с НОМА >2,5 – отсутствие изменения лептина [13].
Следовательно, как гиперинсулинемия натощак, так и в тесте связаны с процентом снижения лептина через 2 ч, причем, первый параметр – обратно пропорционально, а второй – прямо пропорционально. Подобные результаты были представлены группой японских ученых в 2005 г., показавших, что у мужчин с индексом НОМА <2,5 отмечалось снижение уровня лептина через 2 ч после пероральной нагрузки 75 г глюкозы, а в группе мужчин с НОМА >2,5 – отсутствие изменения лептина [13].
Выводы
1. У женщин с ожирением и без нарушения углеводного обмена уровень ЛПН был повышен (42,0 [22,0–60,0] нг/мл) и он существенно снижался при присоединении РНУО (26,6 [13,5–45,2] нг/мл) или СД2 (21,1 [13,6–39,0] нг/мл), что связано с нарастанием инсулиновой недостаточности.
2. Степень снижения лептина через 2 ч в ВГТТ прямо зависит от инсулинемии – в группе лиц с РНУО оно было более выражено по сравнению с группой больных СД2 (23,1% и 11% соответственно, р=0,02), а в группе больных СД2 наибольшее снижение лептина наблюдалось в подгруппе с умеренной декомпенсацией диабета (HbA1c 7–8,5%).
3. Внутри группы РНУО наблюдалась положительная корреляция между степенью снижения лептина и площадью под инсулинемической кривой (r=0,4, р <0,05). Положительная корреляция между степенью снижения лептина и процентом увеличения инсулина плазмы через 70 минут в ВГТТ у больных СД2 (r=0,5, p <0,05) указывает на зависимость лептинемии от второй фазы секреции инсулина.
Авторы декларируют отсутствие конфликта интересов в связи с написанием данной статьи.
Leptin and the female reproductive system (review) | Ryazantseva
The review presents recent data on the biological properties of leptin and its involvement in the pubertal development and pathogenesis of various forms of ovarian failure
На рубеже ХХ–ХХI веков ожирение было охарактеризовано Всемирной организацией здравоохранения как неинфекционная эпидемия. В России ожирение имеет около 30 % населения. При этом избыточный вес наблюдается почти у половины жителей России. Среди женщин частота ожирения колеблется от 30 % до 40 %. Ожирение часто сочетается с гормональной недостаточностью яичников. Причинная роль ожирения в патогенезе нарушений функции репродуктивной системы подтверждается восстановлением овуляторного менструального цикла после нормализации массы тела. Важную роль в патогенезе гормональной недостаточности яичников играет сама жировая ткань. Для различных видов животных и человека существует «критическая» масса тела, необходимая для начала полового развития. [26]. У девочек возраст менархе совпадает с увеличением массы тела в среднем до 47 кг. Наибольшее значение для начала пубертатного периода имеет не столько масса тела, сколько количество подкожной жировой клетчатки и ее соотношение с массой тела. Результаты ряда исследований [14, 67] говорят о том, что у женщин с ожирением различные нарушения менструального цикла встречаются в 4 раза чаще, чем у женщин с нормальной массой тела: 45 % женщин с аменореей страдают ожирением, тогда как у женщин с ненарушенным менструальным циклом избыток массы тела встречается только в 9–13 % случаев. При анкетировании 26 638 женщин репродуктивного возраста с избыточной массой тела или ожирением оказалось, что больные с ИМТ более 25 имели нарушения менструального цикла в 3 раза чаще, чем женщины с нормальной массой тела. Ожирение в подростковом возрасте достоверно коррелирует с нарушениями менструального цикла и гирсутизмом в репродуктивном возрасте [62]. Увеличение массы жировой ткани приводит к усилению периферической конверсии андрогенов в эстрогены, которая происходит при участии фермента ароматазы. У женщин с ожирением ароматазная активность значительно выше, чем у женщин без ожирения. Соотношение эстрон/андростендион, отражающее ароматазную активность, у здоровых женщин составляет 33 и возрастает при ожирении до 50. Средний уровень эстрона в крови женщин с ожирением в 2 раза превышает уровень эстрона в крови женщин с нормальным весом.
В России ожирение имеет около 30 % населения. При этом избыточный вес наблюдается почти у половины жителей России. Среди женщин частота ожирения колеблется от 30 % до 40 %. Ожирение часто сочетается с гормональной недостаточностью яичников. Причинная роль ожирения в патогенезе нарушений функции репродуктивной системы подтверждается восстановлением овуляторного менструального цикла после нормализации массы тела. Важную роль в патогенезе гормональной недостаточности яичников играет сама жировая ткань. Для различных видов животных и человека существует «критическая» масса тела, необходимая для начала полового развития. [26]. У девочек возраст менархе совпадает с увеличением массы тела в среднем до 47 кг. Наибольшее значение для начала пубертатного периода имеет не столько масса тела, сколько количество подкожной жировой клетчатки и ее соотношение с массой тела. Результаты ряда исследований [14, 67] говорят о том, что у женщин с ожирением различные нарушения менструального цикла встречаются в 4 раза чаще, чем у женщин с нормальной массой тела: 45 % женщин с аменореей страдают ожирением, тогда как у женщин с ненарушенным менструальным циклом избыток массы тела встречается только в 9–13 % случаев. При анкетировании 26 638 женщин репродуктивного возраста с избыточной массой тела или ожирением оказалось, что больные с ИМТ более 25 имели нарушения менструального цикла в 3 раза чаще, чем женщины с нормальной массой тела. Ожирение в подростковом возрасте достоверно коррелирует с нарушениями менструального цикла и гирсутизмом в репродуктивном возрасте [62]. Увеличение массы жировой ткани приводит к усилению периферической конверсии андрогенов в эстрогены, которая происходит при участии фермента ароматазы. У женщин с ожирением ароматазная активность значительно выше, чем у женщин без ожирения. Соотношение эстрон/андростендион, отражающее ароматазную активность, у здоровых женщин составляет 33 и возрастает при ожирении до 50. Средний уровень эстрона в крови женщин с ожирением в 2 раза превышает уровень эстрона в крови женщин с нормальным весом. [2]. Эстрадиол стимулирует репликацию адипоцитов-предшественников и тем самым увеличивает синтез эстрогенов. Кроме того при ожирении угнетается реакция 2-гидроксилирования и увеличивается синтез 16-гидроксиэстрона и эстриола, что также способствует развитию и поддержанию состояния хронической гиперэстрогенемии. Пусковым моментом вторичного поликистоза яичников служит, вероятно, гиперэстрогенемия, сенсибилизирующая гонадотрофы гипофиза к гонадотропин-рилизинг-гормону (ГРГ). При этом снижается пороговый уровень эстрадиола, необходимый для начала овуляторного подъема ЛГ, в физиологических условиях происходящий при достижении доминантным фолликулом определенной степени зрелости. Гиперстимуляция незрелых фолликулов, вероятно, лежит в основе их кистозного перерождения. Инсулинорезистентность, возникающая при ожирении, приводит к повышению уровня инсулина в крови, что увеличивает чувствительность яичников к гонадотропной стимуляции и одновременно тормозит ароматизацию андрогенов в эстрогены. Определенную роль в патогенезе недостаточности яичников у больных ожирением играет лептин. Лептин (от «leptos» — худой, тощий) — белковый гормон, секретируемый адипоцитами, был идентифицирован в 1994 году. В 1995 году на 23 конгрессе FEBS (Federation of European Biochemical Societies) в Базеле Friedman J. M. [25] впервые сформулировал постулат о том, что лептин является продуктом экспрессии оb-гена, циркулирует в крови человека в количествах, пропорциональных массе жировой ткани и подавляет аппетит. Молекула лептина состоит из 167 аминокислот общей массой 16 кД. При этом 22–56 фрагменты полипептидной цепочки активно тормозят потребление пищи; фрагменты 116–167 лишь незначительно снижают потребление пищи, а фрагменты 57–92 вообще не оказывают влияния на аппетит. По кристаллической структуре лептин относится к группе спиральных белков, в которую входят пролактин, гормон роста и цитокины [55, 32]. Кроме жировой ткани, продукция лептина также выявлена в слизистой желудка, эпителии молочных желез, мышечной ткани, плаценте, яичниках, яичках, волосяных фолликулах [5, 65].
[2]. Эстрадиол стимулирует репликацию адипоцитов-предшественников и тем самым увеличивает синтез эстрогенов. Кроме того при ожирении угнетается реакция 2-гидроксилирования и увеличивается синтез 16-гидроксиэстрона и эстриола, что также способствует развитию и поддержанию состояния хронической гиперэстрогенемии. Пусковым моментом вторичного поликистоза яичников служит, вероятно, гиперэстрогенемия, сенсибилизирующая гонадотрофы гипофиза к гонадотропин-рилизинг-гормону (ГРГ). При этом снижается пороговый уровень эстрадиола, необходимый для начала овуляторного подъема ЛГ, в физиологических условиях происходящий при достижении доминантным фолликулом определенной степени зрелости. Гиперстимуляция незрелых фолликулов, вероятно, лежит в основе их кистозного перерождения. Инсулинорезистентность, возникающая при ожирении, приводит к повышению уровня инсулина в крови, что увеличивает чувствительность яичников к гонадотропной стимуляции и одновременно тормозит ароматизацию андрогенов в эстрогены. Определенную роль в патогенезе недостаточности яичников у больных ожирением играет лептин. Лептин (от «leptos» — худой, тощий) — белковый гормон, секретируемый адипоцитами, был идентифицирован в 1994 году. В 1995 году на 23 конгрессе FEBS (Federation of European Biochemical Societies) в Базеле Friedman J. M. [25] впервые сформулировал постулат о том, что лептин является продуктом экспрессии оb-гена, циркулирует в крови человека в количествах, пропорциональных массе жировой ткани и подавляет аппетит. Молекула лептина состоит из 167 аминокислот общей массой 16 кД. При этом 22–56 фрагменты полипептидной цепочки активно тормозят потребление пищи; фрагменты 116–167 лишь незначительно снижают потребление пищи, а фрагменты 57–92 вообще не оказывают влияния на аппетит. По кристаллической структуре лептин относится к группе спиральных белков, в которую входят пролактин, гормон роста и цитокины [55, 32]. Кроме жировой ткани, продукция лептина также выявлена в слизистой желудка, эпителии молочных желез, мышечной ткани, плаценте, яичниках, яичках, волосяных фолликулах [5, 65]. Ген ожирения (ob) экспрессируется в белой жировой ткани, желудке, плаценте и, возможно, в молочных железах [37]. Содержание лептина в крови повышается под влиянием инсулина, глюкокортикоидов, эстрогенов, фактора некроза опухоли-альфа и снижается под влиянием андрогенов, гормона роста, грелина, свободных жирных кислот. Лептин циркулирует в крови как в свободном состоянии, так и вместе с белком-носителем. Перенос лептина через гематоэнцефалический барьер осуществляется с помощью белка-носителя, состоящего из 146 аминокислот [1, 4]. Рецепторы лептина обнаружены в гипоталамусе, передней доле гипофиза, а также в периферических органах и тканях: печени, почках, поджелудочной железе, сердце, легких, яичниках, эндометрии, клетках Лейдига, трофобласте, скелетных мышцах и стволовых клетках костного мозга [22, 60]. В яичниках рецепторный аппарат лептина представлен во всех без исключения структурах и типах клеток (мРНК лептинового рецептора идентифицирована в ооцитах, премордиальных фолликулах, в гранулезных клетках фолликулов на различной стадии созревания, в цитоплазме клеток желтого тела и в текальных клетках [23, 36, 61]. Zachow R. J. и Magoffin D. A. [68] нашли, что тканевый лептин в большей степени коррелирует с поликистозом яичников и сахарным диабетом 2 типа, чем циркулирующий в крови. Рецепторы лептина принадлежат семейству рецепторов цитокинов gp 130, к которым относятся рецепторы интерферона, интерлейкинов и гормона роста. [29]. Идентифицировано несколько изоформ специфического рецептора (ob-R). Лептин действует посредством единственной удлиненной полнофункциональной формы рецептора. Функции остальных коротких изоформ до настоящего времени не определены. Однако столь широкая распространенность лептиновых рецепторов в организме может свидетельствовать о том, что лептин не только регулирует чувство насыщения, но и принимает участие в ряде метаболических процессов. Предполагают, что короткая изоформа лептиновых рецепторов, присутствующих в почках, регулирует клиренс лептина, а изоформы лептиновых рецепторов, находящиеся в эндотелии капилляров сосудистых сплетениий головного мозга, обеспечивают транспорт лептина из крови в интерстициальную ткань головного мозга и в спинномозговую жидкость.
Ген ожирения (ob) экспрессируется в белой жировой ткани, желудке, плаценте и, возможно, в молочных железах [37]. Содержание лептина в крови повышается под влиянием инсулина, глюкокортикоидов, эстрогенов, фактора некроза опухоли-альфа и снижается под влиянием андрогенов, гормона роста, грелина, свободных жирных кислот. Лептин циркулирует в крови как в свободном состоянии, так и вместе с белком-носителем. Перенос лептина через гематоэнцефалический барьер осуществляется с помощью белка-носителя, состоящего из 146 аминокислот [1, 4]. Рецепторы лептина обнаружены в гипоталамусе, передней доле гипофиза, а также в периферических органах и тканях: печени, почках, поджелудочной железе, сердце, легких, яичниках, эндометрии, клетках Лейдига, трофобласте, скелетных мышцах и стволовых клетках костного мозга [22, 60]. В яичниках рецепторный аппарат лептина представлен во всех без исключения структурах и типах клеток (мРНК лептинового рецептора идентифицирована в ооцитах, премордиальных фолликулах, в гранулезных клетках фолликулов на различной стадии созревания, в цитоплазме клеток желтого тела и в текальных клетках [23, 36, 61]. Zachow R. J. и Magoffin D. A. [68] нашли, что тканевый лептин в большей степени коррелирует с поликистозом яичников и сахарным диабетом 2 типа, чем циркулирующий в крови. Рецепторы лептина принадлежат семейству рецепторов цитокинов gp 130, к которым относятся рецепторы интерферона, интерлейкинов и гормона роста. [29]. Идентифицировано несколько изоформ специфического рецептора (ob-R). Лептин действует посредством единственной удлиненной полнофункциональной формы рецептора. Функции остальных коротких изоформ до настоящего времени не определены. Однако столь широкая распространенность лептиновых рецепторов в организме может свидетельствовать о том, что лептин не только регулирует чувство насыщения, но и принимает участие в ряде метаболических процессов. Предполагают, что короткая изоформа лептиновых рецепторов, присутствующих в почках, регулирует клиренс лептина, а изоформы лептиновых рецепторов, находящиеся в эндотелии капилляров сосудистых сплетениий головного мозга, обеспечивают транспорт лептина из крови в интерстициальную ткань головного мозга и в спинномозговую жидкость. [1, 35, 47]. Когда содержание лептина в сыворотке крови достигает 25–30 нг/мл, дальнейший его подъем не приводит к увеличению содержания лептина в ткани мозга и спинномозговой жидкости. Возможно, это одна из причин развития резистентности к лептину, способствующей развитию ожирения. Основные биологические функции лептина связаны с регуляцией аппетита и массы тела. В головном мозге лептиновые рецепторы расположены, главным образом, в аркуатном и вентромедиальном ядрах гипоталамуса, где находятся центры голода, насыщения и терморегуляции. Один из механизмов действия лептина — регуляция пищевого поведения посредством торможения синтеза нейропептида Y в аркуатных ядрах гипоталамуса. Нейропептид Y стимулирует прием пищи и снижает термогенез, стимулом к его высвобождению служит гипогликемия и чувство голода. Торможение продукции этого пептида лептином приводит к снижению аппетита и увеличению энергозатрат за счет изменения тонуса симпатической и парасимпатической системы. В процессе регуляции липидного обмена лептин взаимодействует с меланоцитостимулирующим гормоном, который связываясь с рецепторами проопиомеланокортина в гипоталамусе, оказывает анорексигенное действие. Лептин взаимодействует с меланоконцентрирующим гормоном и кокаин/амфетамин регулирующим пептидом, которые обладают аноректическим действием [21]. Действие лептина на рецепторы мозга инициирует целый каскад реакций, включая: снижение продукции белка, отвечающего за развитие белой жировой ткани; нарушение метаболизма митохондрий и повышение продукции активных форм кислорода, что приводит к усилению транскрипции и активации эндонуклеаз, протеаз и фосфорилаз. Эти энзимы способствуют инициации и развитию проапоптических реакций в жировых клетках [48]. Таким образом, лептин является гормоном, осуществляющим регуляцию количества жировой ткани по принципу обратной связи. Лептин обладает ингибирующим действием на секрецию инсулина и является антагонистом инсулина в печени и жировой ткани и тем самым способствует развитию инсулинорезистентности, наблюдаемой при ожирении и сахарном диабете 2 типа.
[1, 35, 47]. Когда содержание лептина в сыворотке крови достигает 25–30 нг/мл, дальнейший его подъем не приводит к увеличению содержания лептина в ткани мозга и спинномозговой жидкости. Возможно, это одна из причин развития резистентности к лептину, способствующей развитию ожирения. Основные биологические функции лептина связаны с регуляцией аппетита и массы тела. В головном мозге лептиновые рецепторы расположены, главным образом, в аркуатном и вентромедиальном ядрах гипоталамуса, где находятся центры голода, насыщения и терморегуляции. Один из механизмов действия лептина — регуляция пищевого поведения посредством торможения синтеза нейропептида Y в аркуатных ядрах гипоталамуса. Нейропептид Y стимулирует прием пищи и снижает термогенез, стимулом к его высвобождению служит гипогликемия и чувство голода. Торможение продукции этого пептида лептином приводит к снижению аппетита и увеличению энергозатрат за счет изменения тонуса симпатической и парасимпатической системы. В процессе регуляции липидного обмена лептин взаимодействует с меланоцитостимулирующим гормоном, который связываясь с рецепторами проопиомеланокортина в гипоталамусе, оказывает анорексигенное действие. Лептин взаимодействует с меланоконцентрирующим гормоном и кокаин/амфетамин регулирующим пептидом, которые обладают аноректическим действием [21]. Действие лептина на рецепторы мозга инициирует целый каскад реакций, включая: снижение продукции белка, отвечающего за развитие белой жировой ткани; нарушение метаболизма митохондрий и повышение продукции активных форм кислорода, что приводит к усилению транскрипции и активации эндонуклеаз, протеаз и фосфорилаз. Эти энзимы способствуют инициации и развитию проапоптических реакций в жировых клетках [48]. Таким образом, лептин является гормоном, осуществляющим регуляцию количества жировой ткани по принципу обратной связи. Лептин обладает ингибирующим действием на секрецию инсулина и является антагонистом инсулина в печени и жировой ткани и тем самым способствует развитию инсулинорезистентности, наблюдаемой при ожирении и сахарном диабете 2 типа. Имеющиеся данные о взаимосвязи уровней лептина и инсулина в крови противоречивыми. Некоторые авторы [57] считают, что инсулин является регулятором секреции лептина: при повышении уровня инсулина в крови выше физиологического усиливается продукция лептина. По данным других исследователей [44], колебания уровней лептина и инсулина в крови в течение суток отрицательно коррелируют между собой. Исследование Kolaczynski J. W. и соавт. [7] показало, что уровень лептина в крови больных сахарным диабетом 2 типа и без него практически не различается. Согласно исследованиям, проведенным Бородиной О. В. и соавт. [3], повышение базального уровня лептина у детей и подростков с ожирением прямо коррелирует с гиперинсулинемией и снижением чувствительности тканей к инсулину. Лептин является информатором гипоталамуса о содержании жировой ткани в организме, что необходимо для нормальной секреции ГРГ и продукции гонадотропинов. Лептин усиливает импульсную секрецию ГРГ гипоталамусом и ЛГ гипофизом[17]. При этом импульсы секреции лептина вполне самостоятельны, т.е. независимы от импульсов секреции ЛГ [20]. Вместе с тем установлено [59], что введение эстрогенов здоровым женщинам вызывает одновременное повышение в крови как ГРГ, так и лептина. Это указывает на вероятное участие лептина в реализации механизма положительной обратной связи в гипоталамо-гипофизарно-овариальной системе. В дополнение к центральному действию, лептин оказывает влияние непосредственно на гонады, что подтверждается наличием рецепторов лептина в клетках яичников — гранулезных, текальных и интерстициальных [23, 36, 61]. Врожденный дефицит лептина сопровождается гипогонадотропным гипогонадизмом. У животных с врожденной недостаточностью лептина наряду с ожирением наблюдаются задержка полового развития и бесплодие. Введение лептина приводит к повышению массы матки и яичников у женских особей и восстановлению фертильности [12]. При ожирении центральные рецепторы лептина защищены от гиперлептинемии посредством блока белка-носителя, переносящего лептин через гематоэнцефалический барьер, в то время как периферические рецепторы не защищены от повышенного содержания лептина в крови, что может приводить к торможению яичникового стероидогенеза. Лептин принимает участие в регуляции фолликулогенеза опосредованно через влияние на выработку ЛГ и ФСГ гипофизом. В исследованиях последних лет появились данные о возможном прямом влиянии лептина на фолликулогенез в яичниках. Наличие рецепторов лептина в ооцитах и предимплантационных эмбрионах позволяет предположить, что лептин прямо влияет на созревании, рост фолликулов и начальное дробление эмбриональных клеток [11]. Избыток лептина в крови женщин с ожирением может нарушать созревание доминантного фолликула и процесс овуляции. Повышение лептина в крови может тормозить также продукцию эстрадиола и прогестерона гранулезными клетками [23]. Лептин тормозит стероидогенез в клетках гранулезы и теки, стимулированных ФСГ, инсулином и инсулиноподобным фактором роста. В дозах, превышающих физиологические, лептин выступает антагонистом инсулина и инсулиноподобного фактора роста (ИПРФ) [60]. В исследовании Kikuchi N и соавт. [30] проводилась оценка влияния лептина на рост фолликулов у незрелых и половозрелых самок мышей. Для этого были взяты клетки фолликулов у 11-дневных мышей и 8-недельных взрослых самок, далее проводилась культивация клеток фолликулов в течение 4 суток. Рост фолликулов оценивался ежедневно, измерялся средний диаметр фолликулов и уровень эстрадиола и ингибина в культуре клеток. В преантральных фолликулах незрелых мышей отмечался значительный рост фолликулов на фоне стимуляции ГРГ (1 mIU/ ml), сочетанием ИПРФ-1 (100 ng/ ml) + ФСГ (100 mIU/ ml) и ГРГ (1 mIU/ml) + ФСГ (100 mIU/ml). Лептин в концентрации от 1–1000 ng/ ml не оказывал влияния на рост фолликулов при стимуляции ГРГ, но дозозависимо подавлял фолликулогенез при применении сочетания ГРГ + ФСГ и ИПРФ-1 + ФСГ. В результате возникло предположение, что лептин ослабляет эффект ФСГ. При культивации культуры преантральных фолликулов половозрелых мышей в присутствии ФСГ было показано, что лептин в зависимости от дозы оказывает подавляющий эффект на ФСГ-зависимый рост фолликулов. В связи с тем, что ФСГ стимулирует продукцию цАМФ, было изучено влияние лептина на фолликулогенез при культивировании клеток фолликулов незрелых и взрослых мышей с добавлением цАМФ или форсколина. На фоне применения форсколина и цАМФ отмечался значительный рост фолликулов в обеих группах. При добавлении в культуру клеток лептина у незрелых мышей выявлено значительное торможение фолликулогенеза, тогда как у взрослых особей никакого влияния на рост фолликулов не было выявлено. Эти результаты показали, что лептин оказывает влияние на рост преантральных фолликулов незрелых и взрослых мышей, но механизмы воздействия существенно отличаются. В препубертатных яичниках лептин стимулирует продукцию эстрадиола и подавление апоптоза [27, 39]. В отсутствие лептина наблюдается торможение процессов фолликулогенеза, ранняя атрезия фолликулов и активация апоптотических процессов [24]. Уровень лептина в крови женщин с синдромом поликистозных яичников (СПЯ) не отличается от показателя у здоровых женщин. У больных ожирением и СПЯ и у женщин с ожирением и сохраненным менструальным циклом содержание лептина в крови достоверно не различается [33, 49]. В одном из недавних исследований [56] было показано, что терапия метформином у больных с СПЯ приводит к значительному снижению уровня лептина в крови и восстановлению овуляции. У этих больных была выявлена положительная корреляция между уровнем лептина, индексом массы тела и уровнем тестостерона в крови, но не было найдено корреляции этих показателей с уровнем инсулина в крови. У женщин с СПЯ и ожирением повышенный уровень лептина в фолликулярной жидкости может способствовать резистентности яичников к стимуляции гонадотропинами [38]. Существует предположение о пермиссивном уровне лептина, необходимом для поддержания нормальной функции яичников. Повышение лептина в крови больных ожирением может приводить к нарушению как центральной, так и периферической регуляции функции яичников [43]. Показано, что рецепторы лептина присутствуют в эндометрии. На протяжении менструального цикла количество рецепторов лептина постепенно повышается, достигая максимума в ранней секреторной фазе [5]. Недостаточное количество лептиновых рецепторов в эндометрии выявлено у женщин с бесплодием и нормальной функцией яичников [63]. Существование лептиновых рецепторов в эндометрии подтверждает участие этого гормона в осуществлении подготовки и обеспечении имплантации оплодотворенной яйцеклетки. Лептин входит в группу гормонов, обеспечивающих пролиферативные процессы эпителия и стромы эндометрия [6]. Несостоятельность лептиновых рецепторов в эндометрии может вносить свой вклад в формирование так называемого «эндометриального фактора бесплодия» [64]. В экспериментальной работе на мышах с наследственной гиполептинемией было показано, что половое созревание у них наступает только после парентерального введения лептина [12]. У детей с ожирением отмечается раннее половое созревание. Возраст менархе имеет обратную зависимость от уровня лептина в крови [45]. При аменорее, возникшей вследствие интенсивных физических нагрузок, имеется низкий уровень лептина в крови и нарушение суточного ритма его секреции [34]. Ahima R. S. и соавт. [9] напротив, считают, что лептин непосредственно не влияет на начало полового развития. Уровень лептина в крови девочек повышается по мере полового созревания, в то время как у мальчиков повышение уровня лептина наблюдается только до определенной стадии полового развития с последующим снижением [19]. При ожирении половые различия в уровне лептина проявляются только на 5-й стадии полового развития по шкале Tanner, что связано, вероятно, с различием в уровне андрогенов и эстрогенов в их крови [32]. Известно, что эстрогены являются эффективным стимулятором синтеза лептина подкожными адипоцитами, в то время как андрогены, наоборот, подавляют секрецию лептина in vitro. Половые стероидные гормоны оказывают существенное действие на продукцию лептина [45]. Секреция лептина в жировых клетках сальника женщин значительно выше, чем в адипоцитах мужчин. В экспериментах in vitro было показано, что тестостерон не оказывает существенного влияния на выработку лептина ни в мужских, ни в женских адипоцитах, тогда как дегидроэпиандростерон (ДГЭА), дегидроэпиандростерон — сульфат (ДГЭА-S), андростендион и станозолол значительно снижают продукцию лептина в жировых клетках женщин и не изменяют ее у мужчин. Жировые клетки женщин более чувствительны к половым стероидам, чем мужские, причем эстрогены повышают, а андрогены снижают выработку лептина [31]. Содержание лептина в крови женщин приблизительно в 2 раза превышает соответствующий показатель у мужчин. Эти половые различия, вероятно, связаны со стимулирующим эффектом эстрогенов и прогестерон, а также с подавляющим действием андрогенов на продукцию лептина. Вместе с тем было показано, что содержание лептина в крови женщин достоверно выше, чем у мужчин, независимо от возраста, степени ожирения и характера распределения жировой ткани [58]. У подростков уровень лептина в крови повышается вместе с увеличением массы тела, достигая своего максимума к началу полового созревания [16]. Mantzoros C. S. с соавт. [50] полагает, что лептин может играть роль своеобразного пускового фактора в инициации полового созревания [66]. Лептин оказывает влияние на чувствительность гонадотрофов к ГРГ, стимулирует высвобождение гонадотрофами ЛГ и ФСГ и является важнейшим компонентом инициации полового созревания [18]. Уровень лептина в крови женщин меняется в зависимости от фазы менструального цикла. В течение менструального цикла уровень лептина в крови постепенно увеличивается на протяжении фолликулярной фазы, достигая максимума в лютеиновую фазу. В лютеиновую фазу менструального цикла уровень лептинемии в 1,5 раза выше, чем в фолликулярную. В течение цикла лептин коррелирует с уровнем прогестерона в крови [14]. В другом исследовании [41] не было выявлено зависимости между уровнями лептина, эстрадиола и прогестерона в крови. Обнаружено, что лептин содержится в фолликулярной жидкости в тех же концентрациях, что и в сыворотке крови [54]. Для изучение влияния лептина на стероидогенеза в клетках гранулезы фолликулов in vitro были взяты клетки гранулезы фолликулов человека, полученные при проведении процедуры экстракорпорального оплодотворения. Далее клетки, изолированные от фолликулярной жидкости, культивировали с применением среды M199, а также различных концентраций лептина (0, 10, 30, 100, 300 нг/мл) и человеческого менопаузального гонадотропина (чМГ, 0, 0,1, 0,2, 0,5, 1, 2, 5, 10 МЕ/мл). В течение 2 суток проводились измерения уровня эстрадиола и прогестерона в культуре клеток. Добавление изолированного лептина не привело к изменению уровня эстрадиола и прогестерона (P > 0,05) в клетках гранулезы. Сочетанное введение лептина в дозе 10–30 нг/ мл и чМГ в дозе 0,5 МЕ/мл вызвало дозозависимое подавление выработки эстрадиола (Р < 0,05). Никакого влияния лептина на стимулированную чМГ продукцию прогестерона выявлено не было. Был сделан вывод, что лептин непосредственно подавляет синтез эстрадиола в клетках гранулезы фолликулов человека, но не оказывает влияния на синтез прогестерона [28]. Цель исследования Ioannis E. Messinis с соавт [53] заключалась в оценке уровня лептина в сыворотке крови у женщин с нормальным менструальным циклом, получающих препараты эстрадиола и прогестерона. Было исследовано 3 группы женщин. Первая — женщины с нормальным менструальным циклом, вторая — женщины, получающие эстрадиол, третья — женщины, получающие эстрадиол + прогестерон. Эстрадиол вводился женщинам подкожно на 2, 3 и 4 дни цикла, а прогестерон вагинально на 3, 4 и 5 дни цикла. Ежедневно измерялся уровень лептина, эстрадиола, прогестерона, ФСГ и ЛГ в сыворотке крови. Во время исследования уровень эстрадиола и прогестерона в сыворотке крови значительно вырос. Уровень лептина в сыворотке крови женщин, получавших только эстрадиол, не отличался от уровня лептина в сыворотке крови женщин контрольной (1) группы. В 3 группе уровень лептина увеличился у всех женщин на 3-й день цикла (8,6 ± 1,1 нг/мл), на 5-й день цикла (12,2 ± 1,8 нг/ мл) и на 6 день цикла (11,9 ± 2,0),что значительно превышало значения в 1 (контрольной) группе. Среднее увеличение процента с 3-го дня до пика концентрации в дни 5 и 6 составило 62,6 ± 6,8 %. В 3 группе уровень лептина в сыворотке крови достоверно коррелировал с уровнем эстрадиола и прогестерона, и не зависел от уровня ФСГ и ЛГ. Результаты показывают, что секрецию лептина у женщин можно стимулировать путем введения эстрадиола и прогестерона. Этим можно объяснить увеличение уровня лептина в крови в лютеиновую фазу менструального цикла.С другой стороны, J. Kitawaki и соавт. [42] были получены данные о стимулирующем действии лептина на синтез эстрогенов непосредственно через активацию ароматазы в клетках гранулезы. Уровень лептина в крови пуповины новорожденных прямо пропорционален массе тела и массе жировой ткани, снижен при курении матери, недоношенности, гипотрофии и повышен у крупных новорожденных. [40, 46]. Трансплацентарный переход лептина от матери к плоду маловероятен, так как уровень лептина в их крови существенно отличается. Секретируемый плацентой лептин поступает в кровоток матери [52]. Во время беременности уровень лептина в крови повышается вместе со сроком гестации в большей степени, чем это соответствует увеличению массы тела, что позволяет сделать вывод о том, что беременность представляет собой состояние физиологической гиперлептинемии и лептинорезистентности [19]. После родов уровень лептина в крови резко снижается, что может отражать энергетические затраты лактационного процесса. Уровень лептина при анорексии значительно снижен как в крови, так и в цереброспинальной жидкости и коррелирует с количеством жировой ткани. Импульсный ритм выработки лептина у женщин с дефицитом массы тела нарушается [9]. Отмечено снижение уровня лептина в крови женщин под влиянием интенсивных физических нагрузок. На фоне усиленного питания у таких женщин повышение уровня лютеинизирующего гормона происходит практически одновременно с повышением уровня лептина в крови [13]. Уровень лептина в крови больных ожирением обычно пропорционален степени ожирения. Экспрессия гена-ob в адипоцитах больных ожирением в 2 раза выше, чем у людей с нормальным весом. Показано, что у больных ожирением, несмотря на снижение веса, через определенное время уровень лептина и экспрессия гена ob вновь повышаются [8]. Продукция лептина в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. Секреция лептина происходит циркадно, с преобладанием ночной секреции над дневной, достигая максимальных значений к 3 часам ночи [51, 15]. Уровень лептина в крови после еды не изменяется, что свидетельствует о том, что лептин не является фактором, определяющим насыщение. При переедании лептин не способен предотвратить развитие ожирения как у экспериментальных животных, так и у человека [16]. Лечение ожирения включает в себя гипокалорийную диету, физические нагрузки и медикаментозную терапию. Перспективным в лечении ожирения является использование рекомбинантного человеческого лептина, который проникает в цереброспинальную жидкость через гематоэнцефалический барьер. В исследовании Farooqi и соавт. [10] показано, что ежедневное подкожное введение лептина имеет выраженный положительный эффект для снижения массы тела и уменьшение жировой массы у детей с врожденным дефицитом лептина. Введение лептина ребенку с задержкой полового развития привело к нормализации полового развития. Подкожное введение биосинтетического лептина женщинам с алиментарным ожирением приводит к снижению массы тела за счет уменьшения массы жировой ткани. Требуются дополнительные исследования для изучения эффективности лептина в лечении алиментарного ожирения [54]. Таким образом, лептин является «тканевым гормоном», принимающим участие в регуляции аппетита, секреции ГРГ гипоталамусом и гонадотропинов гипофизом. Представленные данные позволяют по-новому оценить значение «критической» массы жировой ткани в процессе полового развития, в патогенезе овариальной недостаточности, обусловленной ожирением и дефицитом массы тела. Вместе с тем, противоречивость данных литературы в отношении влияния лептина на фолликулогенез и стероидогенез в яичниках, диктует необходимость дальнейшего изучения этой проблемы.
Имеющиеся данные о взаимосвязи уровней лептина и инсулина в крови противоречивыми. Некоторые авторы [57] считают, что инсулин является регулятором секреции лептина: при повышении уровня инсулина в крови выше физиологического усиливается продукция лептина. По данным других исследователей [44], колебания уровней лептина и инсулина в крови в течение суток отрицательно коррелируют между собой. Исследование Kolaczynski J. W. и соавт. [7] показало, что уровень лептина в крови больных сахарным диабетом 2 типа и без него практически не различается. Согласно исследованиям, проведенным Бородиной О. В. и соавт. [3], повышение базального уровня лептина у детей и подростков с ожирением прямо коррелирует с гиперинсулинемией и снижением чувствительности тканей к инсулину. Лептин является информатором гипоталамуса о содержании жировой ткани в организме, что необходимо для нормальной секреции ГРГ и продукции гонадотропинов. Лептин усиливает импульсную секрецию ГРГ гипоталамусом и ЛГ гипофизом[17]. При этом импульсы секреции лептина вполне самостоятельны, т.е. независимы от импульсов секреции ЛГ [20]. Вместе с тем установлено [59], что введение эстрогенов здоровым женщинам вызывает одновременное повышение в крови как ГРГ, так и лептина. Это указывает на вероятное участие лептина в реализации механизма положительной обратной связи в гипоталамо-гипофизарно-овариальной системе. В дополнение к центральному действию, лептин оказывает влияние непосредственно на гонады, что подтверждается наличием рецепторов лептина в клетках яичников — гранулезных, текальных и интерстициальных [23, 36, 61]. Врожденный дефицит лептина сопровождается гипогонадотропным гипогонадизмом. У животных с врожденной недостаточностью лептина наряду с ожирением наблюдаются задержка полового развития и бесплодие. Введение лептина приводит к повышению массы матки и яичников у женских особей и восстановлению фертильности [12]. При ожирении центральные рецепторы лептина защищены от гиперлептинемии посредством блока белка-носителя, переносящего лептин через гематоэнцефалический барьер, в то время как периферические рецепторы не защищены от повышенного содержания лептина в крови, что может приводить к торможению яичникового стероидогенеза. Лептин принимает участие в регуляции фолликулогенеза опосредованно через влияние на выработку ЛГ и ФСГ гипофизом. В исследованиях последних лет появились данные о возможном прямом влиянии лептина на фолликулогенез в яичниках. Наличие рецепторов лептина в ооцитах и предимплантационных эмбрионах позволяет предположить, что лептин прямо влияет на созревании, рост фолликулов и начальное дробление эмбриональных клеток [11]. Избыток лептина в крови женщин с ожирением может нарушать созревание доминантного фолликула и процесс овуляции. Повышение лептина в крови может тормозить также продукцию эстрадиола и прогестерона гранулезными клетками [23]. Лептин тормозит стероидогенез в клетках гранулезы и теки, стимулированных ФСГ, инсулином и инсулиноподобным фактором роста. В дозах, превышающих физиологические, лептин выступает антагонистом инсулина и инсулиноподобного фактора роста (ИПРФ) [60]. В исследовании Kikuchi N и соавт. [30] проводилась оценка влияния лептина на рост фолликулов у незрелых и половозрелых самок мышей. Для этого были взяты клетки фолликулов у 11-дневных мышей и 8-недельных взрослых самок, далее проводилась культивация клеток фолликулов в течение 4 суток. Рост фолликулов оценивался ежедневно, измерялся средний диаметр фолликулов и уровень эстрадиола и ингибина в культуре клеток. В преантральных фолликулах незрелых мышей отмечался значительный рост фолликулов на фоне стимуляции ГРГ (1 mIU/ ml), сочетанием ИПРФ-1 (100 ng/ ml) + ФСГ (100 mIU/ ml) и ГРГ (1 mIU/ml) + ФСГ (100 mIU/ml). Лептин в концентрации от 1–1000 ng/ ml не оказывал влияния на рост фолликулов при стимуляции ГРГ, но дозозависимо подавлял фолликулогенез при применении сочетания ГРГ + ФСГ и ИПРФ-1 + ФСГ. В результате возникло предположение, что лептин ослабляет эффект ФСГ. При культивации культуры преантральных фолликулов половозрелых мышей в присутствии ФСГ было показано, что лептин в зависимости от дозы оказывает подавляющий эффект на ФСГ-зависимый рост фолликулов. В связи с тем, что ФСГ стимулирует продукцию цАМФ, было изучено влияние лептина на фолликулогенез при культивировании клеток фолликулов незрелых и взрослых мышей с добавлением цАМФ или форсколина. На фоне применения форсколина и цАМФ отмечался значительный рост фолликулов в обеих группах. При добавлении в культуру клеток лептина у незрелых мышей выявлено значительное торможение фолликулогенеза, тогда как у взрослых особей никакого влияния на рост фолликулов не было выявлено. Эти результаты показали, что лептин оказывает влияние на рост преантральных фолликулов незрелых и взрослых мышей, но механизмы воздействия существенно отличаются. В препубертатных яичниках лептин стимулирует продукцию эстрадиола и подавление апоптоза [27, 39]. В отсутствие лептина наблюдается торможение процессов фолликулогенеза, ранняя атрезия фолликулов и активация апоптотических процессов [24]. Уровень лептина в крови женщин с синдромом поликистозных яичников (СПЯ) не отличается от показателя у здоровых женщин. У больных ожирением и СПЯ и у женщин с ожирением и сохраненным менструальным циклом содержание лептина в крови достоверно не различается [33, 49]. В одном из недавних исследований [56] было показано, что терапия метформином у больных с СПЯ приводит к значительному снижению уровня лептина в крови и восстановлению овуляции. У этих больных была выявлена положительная корреляция между уровнем лептина, индексом массы тела и уровнем тестостерона в крови, но не было найдено корреляции этих показателей с уровнем инсулина в крови. У женщин с СПЯ и ожирением повышенный уровень лептина в фолликулярной жидкости может способствовать резистентности яичников к стимуляции гонадотропинами [38]. Существует предположение о пермиссивном уровне лептина, необходимом для поддержания нормальной функции яичников. Повышение лептина в крови больных ожирением может приводить к нарушению как центральной, так и периферической регуляции функции яичников [43]. Показано, что рецепторы лептина присутствуют в эндометрии. На протяжении менструального цикла количество рецепторов лептина постепенно повышается, достигая максимума в ранней секреторной фазе [5]. Недостаточное количество лептиновых рецепторов в эндометрии выявлено у женщин с бесплодием и нормальной функцией яичников [63]. Существование лептиновых рецепторов в эндометрии подтверждает участие этого гормона в осуществлении подготовки и обеспечении имплантации оплодотворенной яйцеклетки. Лептин входит в группу гормонов, обеспечивающих пролиферативные процессы эпителия и стромы эндометрия [6]. Несостоятельность лептиновых рецепторов в эндометрии может вносить свой вклад в формирование так называемого «эндометриального фактора бесплодия» [64]. В экспериментальной работе на мышах с наследственной гиполептинемией было показано, что половое созревание у них наступает только после парентерального введения лептина [12]. У детей с ожирением отмечается раннее половое созревание. Возраст менархе имеет обратную зависимость от уровня лептина в крови [45]. При аменорее, возникшей вследствие интенсивных физических нагрузок, имеется низкий уровень лептина в крови и нарушение суточного ритма его секреции [34]. Ahima R. S. и соавт. [9] напротив, считают, что лептин непосредственно не влияет на начало полового развития. Уровень лептина в крови девочек повышается по мере полового созревания, в то время как у мальчиков повышение уровня лептина наблюдается только до определенной стадии полового развития с последующим снижением [19]. При ожирении половые различия в уровне лептина проявляются только на 5-й стадии полового развития по шкале Tanner, что связано, вероятно, с различием в уровне андрогенов и эстрогенов в их крови [32]. Известно, что эстрогены являются эффективным стимулятором синтеза лептина подкожными адипоцитами, в то время как андрогены, наоборот, подавляют секрецию лептина in vitro. Половые стероидные гормоны оказывают существенное действие на продукцию лептина [45]. Секреция лептина в жировых клетках сальника женщин значительно выше, чем в адипоцитах мужчин. В экспериментах in vitro было показано, что тестостерон не оказывает существенного влияния на выработку лептина ни в мужских, ни в женских адипоцитах, тогда как дегидроэпиандростерон (ДГЭА), дегидроэпиандростерон — сульфат (ДГЭА-S), андростендион и станозолол значительно снижают продукцию лептина в жировых клетках женщин и не изменяют ее у мужчин. Жировые клетки женщин более чувствительны к половым стероидам, чем мужские, причем эстрогены повышают, а андрогены снижают выработку лептина [31]. Содержание лептина в крови женщин приблизительно в 2 раза превышает соответствующий показатель у мужчин. Эти половые различия, вероятно, связаны со стимулирующим эффектом эстрогенов и прогестерон, а также с подавляющим действием андрогенов на продукцию лептина. Вместе с тем было показано, что содержание лептина в крови женщин достоверно выше, чем у мужчин, независимо от возраста, степени ожирения и характера распределения жировой ткани [58]. У подростков уровень лептина в крови повышается вместе с увеличением массы тела, достигая своего максимума к началу полового созревания [16]. Mantzoros C. S. с соавт. [50] полагает, что лептин может играть роль своеобразного пускового фактора в инициации полового созревания [66]. Лептин оказывает влияние на чувствительность гонадотрофов к ГРГ, стимулирует высвобождение гонадотрофами ЛГ и ФСГ и является важнейшим компонентом инициации полового созревания [18]. Уровень лептина в крови женщин меняется в зависимости от фазы менструального цикла. В течение менструального цикла уровень лептина в крови постепенно увеличивается на протяжении фолликулярной фазы, достигая максимума в лютеиновую фазу. В лютеиновую фазу менструального цикла уровень лептинемии в 1,5 раза выше, чем в фолликулярную. В течение цикла лептин коррелирует с уровнем прогестерона в крови [14]. В другом исследовании [41] не было выявлено зависимости между уровнями лептина, эстрадиола и прогестерона в крови. Обнаружено, что лептин содержится в фолликулярной жидкости в тех же концентрациях, что и в сыворотке крови [54]. Для изучение влияния лептина на стероидогенеза в клетках гранулезы фолликулов in vitro были взяты клетки гранулезы фолликулов человека, полученные при проведении процедуры экстракорпорального оплодотворения. Далее клетки, изолированные от фолликулярной жидкости, культивировали с применением среды M199, а также различных концентраций лептина (0, 10, 30, 100, 300 нг/мл) и человеческого менопаузального гонадотропина (чМГ, 0, 0,1, 0,2, 0,5, 1, 2, 5, 10 МЕ/мл). В течение 2 суток проводились измерения уровня эстрадиола и прогестерона в культуре клеток. Добавление изолированного лептина не привело к изменению уровня эстрадиола и прогестерона (P > 0,05) в клетках гранулезы. Сочетанное введение лептина в дозе 10–30 нг/ мл и чМГ в дозе 0,5 МЕ/мл вызвало дозозависимое подавление выработки эстрадиола (Р < 0,05). Никакого влияния лептина на стимулированную чМГ продукцию прогестерона выявлено не было. Был сделан вывод, что лептин непосредственно подавляет синтез эстрадиола в клетках гранулезы фолликулов человека, но не оказывает влияния на синтез прогестерона [28]. Цель исследования Ioannis E. Messinis с соавт [53] заключалась в оценке уровня лептина в сыворотке крови у женщин с нормальным менструальным циклом, получающих препараты эстрадиола и прогестерона. Было исследовано 3 группы женщин. Первая — женщины с нормальным менструальным циклом, вторая — женщины, получающие эстрадиол, третья — женщины, получающие эстрадиол + прогестерон. Эстрадиол вводился женщинам подкожно на 2, 3 и 4 дни цикла, а прогестерон вагинально на 3, 4 и 5 дни цикла. Ежедневно измерялся уровень лептина, эстрадиола, прогестерона, ФСГ и ЛГ в сыворотке крови. Во время исследования уровень эстрадиола и прогестерона в сыворотке крови значительно вырос. Уровень лептина в сыворотке крови женщин, получавших только эстрадиол, не отличался от уровня лептина в сыворотке крови женщин контрольной (1) группы. В 3 группе уровень лептина увеличился у всех женщин на 3-й день цикла (8,6 ± 1,1 нг/мл), на 5-й день цикла (12,2 ± 1,8 нг/ мл) и на 6 день цикла (11,9 ± 2,0),что значительно превышало значения в 1 (контрольной) группе. Среднее увеличение процента с 3-го дня до пика концентрации в дни 5 и 6 составило 62,6 ± 6,8 %. В 3 группе уровень лептина в сыворотке крови достоверно коррелировал с уровнем эстрадиола и прогестерона, и не зависел от уровня ФСГ и ЛГ. Результаты показывают, что секрецию лептина у женщин можно стимулировать путем введения эстрадиола и прогестерона. Этим можно объяснить увеличение уровня лептина в крови в лютеиновую фазу менструального цикла.С другой стороны, J. Kitawaki и соавт. [42] были получены данные о стимулирующем действии лептина на синтез эстрогенов непосредственно через активацию ароматазы в клетках гранулезы. Уровень лептина в крови пуповины новорожденных прямо пропорционален массе тела и массе жировой ткани, снижен при курении матери, недоношенности, гипотрофии и повышен у крупных новорожденных. [40, 46]. Трансплацентарный переход лептина от матери к плоду маловероятен, так как уровень лептина в их крови существенно отличается. Секретируемый плацентой лептин поступает в кровоток матери [52]. Во время беременности уровень лептина в крови повышается вместе со сроком гестации в большей степени, чем это соответствует увеличению массы тела, что позволяет сделать вывод о том, что беременность представляет собой состояние физиологической гиперлептинемии и лептинорезистентности [19]. После родов уровень лептина в крови резко снижается, что может отражать энергетические затраты лактационного процесса. Уровень лептина при анорексии значительно снижен как в крови, так и в цереброспинальной жидкости и коррелирует с количеством жировой ткани. Импульсный ритм выработки лептина у женщин с дефицитом массы тела нарушается [9]. Отмечено снижение уровня лептина в крови женщин под влиянием интенсивных физических нагрузок. На фоне усиленного питания у таких женщин повышение уровня лютеинизирующего гормона происходит практически одновременно с повышением уровня лептина в крови [13]. Уровень лептина в крови больных ожирением обычно пропорционален степени ожирения. Экспрессия гена-ob в адипоцитах больных ожирением в 2 раза выше, чем у людей с нормальным весом. Показано, что у больных ожирением, несмотря на снижение веса, через определенное время уровень лептина и экспрессия гена ob вновь повышаются [8]. Продукция лептина в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. Секреция лептина происходит циркадно, с преобладанием ночной секреции над дневной, достигая максимальных значений к 3 часам ночи [51, 15]. Уровень лептина в крови после еды не изменяется, что свидетельствует о том, что лептин не является фактором, определяющим насыщение. При переедании лептин не способен предотвратить развитие ожирения как у экспериментальных животных, так и у человека [16]. Лечение ожирения включает в себя гипокалорийную диету, физические нагрузки и медикаментозную терапию. Перспективным в лечении ожирения является использование рекомбинантного человеческого лептина, который проникает в цереброспинальную жидкость через гематоэнцефалический барьер. В исследовании Farooqi и соавт. [10] показано, что ежедневное подкожное введение лептина имеет выраженный положительный эффект для снижения массы тела и уменьшение жировой массы у детей с врожденным дефицитом лептина. Введение лептина ребенку с задержкой полового развития привело к нормализации полового развития. Подкожное введение биосинтетического лептина женщинам с алиментарным ожирением приводит к снижению массы тела за счет уменьшения массы жировой ткани. Требуются дополнительные исследования для изучения эффективности лептина в лечении алиментарного ожирения [54]. Таким образом, лептин является «тканевым гормоном», принимающим участие в регуляции аппетита, секреции ГРГ гипоталамусом и гонадотропинов гипофизом. Представленные данные позволяют по-новому оценить значение «критической» массы жировой ткани в процессе полового развития, в патогенезе овариальной недостаточности, обусловленной ожирением и дефицитом массы тела. Вместе с тем, противоречивость данных литературы в отношении влияния лептина на фолликулогенез и стероидогенез в яичниках, диктует необходимость дальнейшего изучения этой проблемы.
- Метаболический синдром у женщин (патофизиология и клиника) / Беляков Н. А. [и др.]. — СПб., 2005. — 440 с.
- Ожирение и гормональная функция яичников / Мишарина Е. В. [и др.] // Эфферентная терапия. — 2007. — Т. 13, N 1. — С. 42–45.
- Особенности секреции лептина у детей и подростков / Бородина О. В. [и др.] // Проблемы эндокринологии. — 2003. — Т. 49,№ 5. — С. 20–23.
- Панков Ю. А. Лептин в регуляции нейроэндокринной системы // Актуальные проблемы нейроэндокринологии: III Всерос. науч.практ. конф.— М., 2003.
- A nutrient-sensing pathway regulates leptin gene in muscle and fat / Wang J. [at al.] // Nature. — 1998. — Vol. 393. — Р. 684–688.
- Aberrant expression of leptin in human endometriotic stromal cells is induced by elevated levels of hypoxia inducible factor- 1alpha / Wu M.H. [et al.] // Am. J. Patho. — 2007. — Vol. 170, N 2. — P. 590–598.
- Acute and chronic effects of insulin on leptin production in humans — studies in vivo and in vitro / Kolaczynski J. W. [at al.] // Diabetes. — 1996. — Vol. 45. — Р. 699–701.
- Adipose tissue leptin production and plasma leptin kinetics in humans / Klein S. [at al.] // Diabetes. — 1996. — Vol. 45. — Р. 984–987.
- Ahima R. S. Revisiting leptons role in obesity and weight loss // J. Clin. Endocr. Metab. — 2008. — Vol. 118. — Р. 2380–2383.
- Beneficial effects of leptin on obesity, T-cell hyporesponsiveness, and neuroendocrine/metabolic dysfunction of human congenital leptin deficiency / Farooqi I. S. [ et al.] // J. Clinical Investigation. — 2002. —Vol. 110. — P. 1093–1103.
- Brannian J. D., Hansen K. A. Leptin and ovarian folliculogenesis: implications for ovulation induction and ART outcomes // Semin. Reprod. Med. — 2002. — Vol. 20, N 2. — P. 103–112.
- Chehab F. F., Lim M. E., Li R. Correction of the sterility defect in obese female mice by treatment with the human recombinant leptin // Nat. Genet. — 1996. — Vol. 12. — Р. 318–320.
- Circulating leptin in women: a longitudinal studybin the menstrual cycle and during pregnancy / Hardie L. [at al.] // Clin.Endocrinol.— 1997. — Vol. 47. — Р. 101–106.
- Decreased soluble leptin receptor levels in women with polycystic ovary syndrome / Hahn S. [et al.] // Eur. J. Endocrinol. — 2006. — Vol. 154, N 2. — P. 287–294.
- Diurnal and ultradian rhythmicity of plasmа leptin: effects of gender and adiposity / Saad M. F. [ et al.] // J. Clin. Endocrin. Metab. — 1998. — Vol. 83. — P. 453–459.
- Effect of puberty on the relationship between circulating leptin and body composition / Horlick M.B. [at al.] // J. Clin. Endocrinol. Metab. — 2000. — Vol. 85. — Р. 2509–2518.
- Effects of in vivo and in vitro administration of ghrelin, leptin and neuropeptide mediators on pulsatile gonadotrophin-releasing hormone secretion from male rat hypothalamus before and after puberty / Lebrethon M. C. [et al.] // J. Neuroendocrinol. — 2007. — Vol. 19, N 3. — P. 181–188.
- Effects of leptin on gonadotropin secretion in juvenile female rat pituitary cells / Tezuka M.[et al.] // Eur. J. Endocrinol. — 2002. — Vol. 146, N 2. — P. 261–266.
- Elevated leptin concentrations in pregnancy and lactation: possible role as a modulator of substrate utilization / Mukherjta R. [at al.] // Life Sci. — 1999. — Vol. 65. — Р. 1183–1193.
- Episodic leptin release is independent of luteinizing hormone secretion / Sir-Petermann T. [et al.] // Hum. Reprod. — 1999. — Vol. 14, N 11. — P. 2695–2699.
- Evidence of free and bound leptin in human circulation. Studies in lean and obese subjects and during short-term fasting / Sinha M. K. [at al.] // Clin. Invest. — 1996. — Vol. 98. — Р.1277–1282.
- Expression of leptin receptor in human endometrium and fluctuation during the menstrual cycle / Kitawaki J. [at al.] // J. Clin. Endocrinol. Metab. — 2000. — Vol. 85. — Р. 1946–950.
- Expression of functional leptin receptors in rodent Leydig cells / Caprio M. [at al.] // Endocrinology. — 1999. — Vol. 140, N 49. — Р. 39–47.
- Folliculogenesis is impaired and granulosa cell apoptosis is increased in leptin-deficient mice / Hamm M.L. [et al.] // Biol. Reprod. — 2004. — Vol. 71, N 1. — P. 66–72.
- Friedman J. M. // Abstracts of 23 Meeting of the FEBS. — Basel, 1995. — p. 12.
- Frisch R. Body fat, puberty and fertility // Biol. Rev. — 1984. — Vol. 59. — Р. 161–188.
- Gh and IGF-I increase leptin receptor expression in prepubertal pig ovaries: the role of leptin in steroid secretion and cell apoptosis / Gregoraszczuk E. L. [ et al.] // Acta Vet. Hung. — 2006. — Vol. 54, N 3. — P. 413–426.
- Guo X., Chen S., Xing F. Effects of leptin on estradiol and progesterone production by human luteinized granulosa cells in vitro // Zhonghua Fu Chan Ke Za Zhi. — 2001. — Vol. 36, N 2. — P. 95–97.
- Identification and expression cloning of a leptin receptor Ob-R / Tartaglia R. A. [at al.] // Cell. — 1995. — Vol. 83. — Р. 1263–1271.
- Inhibitory action of leptin on early follicular growth differs in immature and adult female mice / Kikuchi N. [et al.] // Biol. Reprod. —2001. — Vol. 65, N 1. — P. 66–71.
- Inverse correlation between serum testosterone and leptin in men / Luukkaa V. [at al.] // J. Clin. Endocr. Metab. — 1998. —Vol. 83. — Р. 3243–3246.
- Kershaw E. S. Adipose tissue as an endocrine organ // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89, N 6. — Р. 2548–2556.
- Kowalska I., Kinalski M., Wolczinski S. The influence of obesity on ovarian function. Plasma leptin concentration in women with polycystic ovary syndrome // Gynecol. Pol. — 1999. — R. 70, N 6. — S.428–432.
- Laughlin G. A., Yen S. S. C. Hypoleptinemia in women athlets: absence of a diurnal rhythm with amenorrhea // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — Р. 318–321.
- Leibowitz S. F. Central physiological determinants of eating behavior and weigt // Eating Disorders and Obesity / eds. K. D. Brownell, C. G. Fairbum. — London, 1995. — Р. 3–7.
- Leptin and its receptors in human fetal and adult ovaries / Abir R. [et al ] // Fertil. Steril. — 2005. — Vol. 84, N 6. — P. 1779–1782.
- Leptin and leptin receptor mRNA and protein expression in the murine fetus and placenta / Hoggard N.[at al.] // Proc. Natl. Fcad. Sci. USA. — 1997. — Vol. 94. — Р. 11073–11078.
- Leptin and leptinbinding activity in the preovulatory follicle of polycystic ovary syndrome patients / Fedocsak P. [at al.] // Scandinavian J. Clin. Lab. Investigation. — 2000. — Vol. 60, N 8. — Р. 649–655.
- Leptin attenuates follicular apoptosis and accelerates the onset of puberty in immature rats / Almog B. [et al.] // Mol. Cell Endocrinol. — 2001. — Vol. 183, N 1–2. — P. 179–191.
- Leptin concentration in amniotic fluid, venous and arterial cord blood and maternal serum — high leptin synthesis in the fetus and inverse correlation with placental weight / Schubring C. [at al.] // Letter Eur. J. Pediatr. — 1996. — Vol. 155. — P. 830–834.
- Leptin concentration in relation to body mass index and tumor necrosis factor-alpha system in humans / Mantzoros C. S. [at al.] // J. Clin. Endocr. Metab. — 1997. — Vol. 82. — P. 3408–3413.
- Leptin directly stimulates aromatase activity in human luteinized granulosa cells / Kitawaki J. [et al.] // Mo. Hum. Reprod. — 1999. — Vol. 5, N 8.—P. 708–713.
- Leptin in reproduction / Caprio M. [at al.] // Trends Endocrinol. Metab. — 2001. — Vol. 12. — P. 62–67.
- Leptin inhibits insulin secretion and reduces insulin mRNA levels in rat isolated pancreatic islets / Pallett A. L. [at al.] // Biochim. Biophys. Res. Commun. — 1997. — Vol. 238 — P. 267–270.
- Leptin is inversely related to age at menarche in human females / Matkowic V. [at al.] // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 3239–3245.
- Levels of leptin in maternal serum, amniotic fluid, and arterial and venous cord blood, relation to neonatal and placental weight / Schubring C. [at al.] // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 1480–1483.
- Localization of leptin receptor Mma and the long form splice variant Ob-Rb in moust hypothalamus and adolescent brain regions by in situ hybridization / Mercer J. G. [at al.] // Febslett. — 1996. — Vol. 387. — P. 113–116.
- Mantzoros C. S. Leptin and the hypothalamus: neuroendocrint regulation of food intake // Mol. Psychiatry. — 1999. — Vol. 4. — P. 8–12.
- Mantzoros C. S., Dunaif A., Flier J. S. Leptin concentrations in the polycystic ovary syndrome // J. Clin. Endocrinol. Metab. — 1999. — Vol. 82, N 6. — P. 1687–1691.
- Mantzoros C. S., Flier J. S., Rogol A. R. A longitudinal assessment of hormonal and physical alterations during normal puberty in boys. Rising leptin levels may signal the onset of puberty //J. Clin.Endocrinol. Metab. — 1997. — Vol. 82. — P. 1066–1070.
- Nocturnal rise of leptin in lean, obese, and non-insulin-dependent diabetes mellitus subjects / Sinha M. K. [at al.] // J. Clin. Invest. — 1996. — Vol. 97. — P. 1344–1347.
- Nonadipose tissue production of leptin, leptin as a novel placenta — derived hormone in humans / Masuzaki H. [at al.] // Nat. Med. — 1997. — Vol. 3. — P. 1029–1033.
- Oestradiol plus progesterone treatment increases serum leptin concentrations in normal women / Ioannis E. Messinis [et al] // Oxford J. Medicine Human Reproduction. — 2001. — Vol. 16.— P. 1827–1832.
- Panday S., Maheshwari A., Bhattacharya S. The impact of female on the outcome of fertility treatment // J. Hum. Reprod. Sci. — 2010. — Vol. 32. — P. 62–67.
- Positional cloning of the mouse obese gene and its human homologue / Zhang Y. [at al.] // Nature. — 1994. — Vol. 372. — P. 425–432.
- Prena U., Rehan H.S., Vikas Seth. Serum leptin changes with metformin treatment in polycystic ovarian syndrome, correlation with ovulation, insulin and testosterone levels // EXCLI Journal. — 2011. — Vol. 10. — P. 9–15.
- Role of brain insulin receptor in control of body weight and reproduction / Bruning J. C. [at al.] // Science. — 2000. — Vol. 289. — P. 2122–2125.
- Serum immunoreactive — leptin concentrations in normal-weight and obese humans / Considine R.V. [at al.] // N. Engl. J. Med. — 1996. — Vol. 334. — P. 292–295.
- Simultaneous increases of leptin and gonadotropin-releasing hormone following exogenous estrogen administration in women with normally menstrual cycle / Lin K. C. [ et al.] // Endocrinol. J. — 2005. — Vol. 52, N 4. — P. 449–454.
- Spicer J. L., Francisco C. C. Adipose obese gene product, leptin, inhibits bovine ovarian thecal cell steroidogenesis // Biol. Reprod. — 1998. — Vol. 58. — P. 207–212.
- Study of effects of leptin on cultured human luteinized granulosa cell function / Huang H. [et al.] // Zhonghua Fu Chan Ke Za Zhi. — 2002. — Vol. 37, N 3. — P. 152–154.
- The effects of ovarian steroids, epidermal growth factor, insulin and insulin-like growth factor-1 on ovarian stromal growth / Franks S. [et al.] // Proceeding of the Endocrine Society, 79- th Annual Meeting, June 11–14, 1997. — San Diego: Endocr. Soc Pres, 1997. — P. 389.
- The endometrium as a novel target for leptin: differences in fertility and subfertility / Alfer J. [at al.] // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 3408–3413.
- The endometrium as a novel target for leptin: differences in fertility and subfertility / Alfer J. [et al.] // Mol. Hum. Reprod. — 2000. — Vol. 6, N 7. — P. 595–601.
- The stomach in a source of leptin / Bado A. [at al.] // Nature. — 1998. — Vol. 394. — P. 790–793.
- Vogel G. Leptin: a trigger for puberty? // Science. — 1996. — Vol. 274. —P. 1466–1467.
- Weight loss in obese infertile women results in improvement in reproductive outcome for all forms of fertility treatment / Clark A.M. [et al.] // Hum. Reprod . — 1998. — Vol. 13. — P. 1502–1505.
- Zachow R. J., Magoffin D. A. Direct intraovarian effects of leptin: impairment of the synergistic action of insulin-like growth factor-I on follicle-stimulating hormone-dependent estradiol-17 beta production by rat ovarian granulosa cells // Endocrinology. — 1997. —Vol. 138. — Р. 847–850.
Views
Abstract — 815
PDF (Russian) — 358
Cited-By
Article Metrics
PlumX
Dimensions
Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия лептина
Других названий гормона не существует, но ген, кодирующий лептин, известен как ген ob.
Что такое лептин?
Лептин — гормон, выделяемый жировыми клетками жировой ткани. Лептин передает сигналы в мозг, в частности в область, называемую гипоталамусом. Лептин не влияет на прием пищи от приема пищи до приема пищи, но вместо этого действует, изменяя прием пищи и контролируя расход энергии в долгосрочной перспективе.Лептин оказывает более сильное действие, когда мы теряем вес и уровень гормона падает. Это стимулирует огромный аппетит и повышенное потребление пищи. Гормон помогает нам поддерживать нормальный вес и, к сожалению для людей, сидящих на диете, мешает сбросить лишние килограммы!
Как контролируется лептин?
Поскольку лептин вырабатывается жировыми клетками, количество выделяемого лептина напрямую связано с количеством жира в организме; Таким образом, чем больше у человека жира, тем больше лептина будет циркулировать в его крови.Уровни лептина увеличиваются, если человек увеличивает свою жировую массу в течение определенного периода времени, и, аналогично, уровни лептина снижаются, если человек уменьшает свою жировую массу в течение определенного периода времени.
Что произойдет, если у меня будет слишком много лептина?
У тучных людей необычно высокий уровень лептина. Это связано с тем, что у некоторых людей с ожирением мозг не реагирует на лептин, поэтому они продолжают есть, несмотря на адекватные (или чрезмерные) жировые запасы, концепция, известная как «резистентность к лептину». Это заставляет жировые клетки производить еще больше лептина.Это похоже на то, как люди с диабетом 2 типа имеют необычно высокий уровень инсулина, поскольку их организм устойчив к воздействию инсулина. Причина резистентности к лептину до сих пор не выяснена.
Что произойдет, если у меня слишком мало лептина?
Существует чрезвычайно редкое состояние, называемое врожденной недостаточностью лептина, которое является генетическим заболеванием, при котором организм не может вырабатывать лептин. В Великобритании всего около четырех семей, затронутых этим генетическим заболеванием.
Отсутствие лептина заставляет организм думать, что в нем совсем нет жира, что приводит к неконтролируемому приему пищи и тяжелому детскому ожирению.Кроме того, дефицит лептина может вызвать задержку полового созревания и плохую функцию иммунной системы. Это состояние хорошо лечится инъекциями лептина, которые вызывают резкую потерю веса.
Последний раз отзыв: март 2018
Лептин и поддержание повышенной массы тела
Катлер Д. М., Глезер Э. Л. и Шапиро Дж. М. Почему американцы стали более тучными? J. Econ. Перспектива. 17 , 93–118 (2003).
Google Scholar
Коули, Дж. И Мейерхофер, К. Затраты на медицинское обслуживание ожирения: метод инструментальных переменных. J. Health Econ. 31 , 219–230 (2012).
Google Scholar
Шварц, М. В., Вудс, С. К., Порт, Д., Сили, Р. Дж. И Баскин, Д. Г. Контроль центральной нервной системы при приеме пищи. Nature 404 , 661–671 (2000).
CAS Google Scholar
Rosenbaum, M. et al. Низкие дозы лептина обращают вспять адаптацию скелетных мышц, вегетативной и нейроэндокринной систем к поддержанию пониженного веса. J. Clin. Вкладывать деньги. 115 , 3579–3586 (2005).
CAS PubMed PubMed Central Google Scholar
Ингаллс, А. М., Дики, М. М. и Снелл, Г. Д. Обезе, новая мутация у домовой мыши. J. Hered. 41 , 317–318 (1950).
CAS Google Scholar
Zhang, Y. et al. Позиционное клонирование гена ожирения мыши и его человеческого гомолога. Nature 372 , 425–432 (1994). В этой статье описывается оригинальное клонирование лептина, показывающее, что это гормон, вырабатываемый белой жировой тканью, и что он может снижать потребление пищи у нормальных мышей и мышей с дефицитом лептина.
CAS Google Scholar
Frederich, R.C. et al. Уровни лептина отражают содержание липидов в организме мышей, что свидетельствует о резистентности к действию лептина, вызванной диетой. Nat. Med. 1 , 1311–1314 (1995).
CAS Google Scholar
Farooqi, S. et al. Эффекты терапии рекомбинантным лептином у ребенка с врожденной недостаточностью лептина. N. Engl. J. Med. 341 , 879–884 (1999).
CAS Google Scholar
Chua, S.C. Jr et al. Фенотипы мыши с диабетом и крысы жирной из-за мутаций в рецепторе ob (лептина). Наука 271 , 994–996 (2016).
Google Scholar
Flak, J. N. & Myers, M. G. Мини-обзор: ЦНС механизмы действия лептина. Mol Endocrinol. 30 , 3–12 (2016).
CAS Google Scholar
De Luca, C. et al. Полное спасение от ожирения, диабета и бесплодия у мышей db / db с помощью нейрон-специфичных трансгенов LEPR-B. J. Clin. Вкладывать деньги. 115 , 3484–3493 (2005).
CAS PubMed PubMed Central Google Scholar
Лу, П.-ЧАС. и другие. Снижение массы тела и увеличение расхода энергии у трансгенных мышей со сверхэкспрессией растворимого рецептора лептина. PLoS ONE 5 , e11669 (2010).
PubMed PubMed Central Google Scholar
Ahima, R. S. et al. Роль лептина в нейроэндокринной реакции на голодание. Nature 382 , 250–252 (1996). В этом исследовании голодных мышей лечили лептином, обращая вспять многие компоненты нейроэндокринной реакции на голодание (гиперкортизолизм, гипотиреоз, снижение расхода энергии и бесплодие).Таким образом, снижение лептина, сопровождающее ограничение калорийности, способствует активации реакции нейроэндокринного голодания.
CAS Google Scholar
Эллисон, М. Б. и Майерс, М. Г. Связь передачи сигналов лептина с биологической функцией. J. Endocrinol. 223 , T25 – T35 (2014).
CAS PubMed PubMed Central Google Scholar
Пайпер, М.Л., Унгер, Э. К., Майерс, М. Г. и Сюй, А. В. Конкретные физиологические роли преобразователя сигнала и активатора транскрипции 3 в нейронах, экспрессирующих рецептор лептина. Мол. Эндокринол. 22 , 751–759 (2008).
CAS Google Scholar
Bates, S.H. et al. Передача сигналов STAT3 необходима для лептиновой регуляции энергетического баланса, но не воспроизводства. Nature 421 , 856–859 (2003).
CAS Google Scholar
Jiang, L. et al. Тирозин-зависимые и независимые действия рецептора лептина в контроле энергетического баланса и гомеостаза глюкозы. Proc. Natl Acad. Sci. США 105 , 18619–18624 (2008).
CAS Google Scholar
Niswender, K. D. et al. Внутриклеточная передача сигналов: ключевой фермент лептин-индуцированной анорексии. Nature 413 , 794–795 (2001).
CAS Google Scholar
Wang, Y. et al. Роль астроцитов в передаче сигналов лептина. J. Mol. Neurosci. 56 , 829–839 (2015).
CAS PubMed PubMed Central Google Scholar
Allison, M. B. et al. TRAP-seq определяет маркеры для новых популяций нейронов LepRb гипоталамуса и ствола мозга. Мол. Метаб. 4 , 299–309 (2015).
CAS PubMed PubMed Central Google Scholar
Кэмпбелл, Дж. Н. и др. Молекулярный учет дугообразных типов клеток гипоталамуса и среднего возвышения. Nat. Neurosci. 20 , 484–496 (2017).
CAS PubMed PubMed Central Google Scholar
Уотерсон, М.Дж. И Хорват, Т. Л. Нейрональная регуляция энергетического гомеостаза: за пределами гипоталамуса и кормления. Cell Metab. 22 , 962–970 (2015).
CAS Google Scholar
Kim, J. G. et al. Передача сигналов лептина в астроцитах регулирует нейронные цепи гипоталамуса и питание. Nat. Neurosci. 17 , 908–910 (2014).
CAS Google Scholar
Ван Де Валл, Э.и другие. Коллективные и индивидуальные функции нейронов, модулируемых рецептором лептина, контролирующих метаболизм и прием пищи. Эндокринология 149 , 1773–1785 (2008).
CAS Google Scholar
Vong, L. et al. Действие лептина на ГАМКергические нейроны предотвращает ожирение и снижает тормозящий тонус нейронов РОМС. Нейрон 71 , 142–154 (2011). Это исследование показывает, что лептин действует через ингибирующие нейроны, не экспрессирующие AGRP, чтобы косвенно контролировать активность клеток POMC, что является первым доказательством важной непрямой регуляции нейронов POMC лептином.
CAS PubMed PubMed Central Google Scholar
Garfield, A. S. et al. Динамическая ГАМКергическая афферентная модуляция нейронов AgRP. Nat. Neurosci. 19 , 1628–1635 (2016). Это исследование показывает, что ГАМКергические нейроны LEPR в DMH иннервируют клетки AGRP, чтобы контролировать их активность, предполагая, что важный компонент регуляции нейронов AGRP лептином является косвенным.
CAS PubMed PubMed Central Google Scholar
Лешань, р.Л., Гринвальд-Ярнелл, М., Паттерсон, С. М., Гонсалес, И. Э. и Майерс, М. Г. Действие лептина через нейроны, экспрессирующие синтазу-1 оксида азота, регулируют энергетический баланс. Nat. Med. 18 , 820–823 (2012). Это исследование показывает, что нейроны LEPR, не являющиеся POMC, которые экспрессируют Nos1 , контролируют экспрессию гена в клетках POMC, показывая, что лептин косвенно контролирует многие аспекты функции нейрона POMC.
CAS PubMed PubMed Central Google Scholar
Резай-Заде, К.и другие. Нейроны рецептора лептина в дорсомедиальном гипоталамусе являются ключевыми регуляторами расхода энергии и массы тела, но не приема пищи. Мол. Метаб. 3 , 681–693 (2014).
CAS PubMed PubMed Central Google Scholar
Додд, Г. Т. и др. Термогенный эффект лептина зависит от отдельной популяции пролактин-высвобождающих пептидных нейронов в дорсомедиальном гипоталамусе. Cell Metab. 20 , 639–649 (2014).
CAS PubMed PubMed Central Google Scholar
Dhillon, H. et al. Лептин непосредственно активирует нейроны SF1 в VMH, и это действие лептина необходимо для нормального гомеостаза массы тела. Нейрон 49 , 191–203 (2006).
CAS Google Scholar
Hawke, Z. et al. Нейроны PACAP в вентромедиальном ядре гипоталамуса являются мишенями для центральной передачи сигналов лептина. J. Neurosci. 29 , 14828–14835 (2009).
CAS PubMed PubMed Central Google Scholar
Leinninger, G.M. et al. Действие лептина через нейроны нейротензина контролирует орексин, мезолимбическую дофаминовую систему и энергетический баланс. Cell Metab. 14 , 313–323 (2011).
CAS PubMed PubMed Central Google Scholar
Лак, А.и другие. Лептин модулирует получение питательных веществ за счет ингибирующего действия галанина на нейроны орексина. Мол. Метаб. 4 , 706–717 (2015).
CAS PubMed PubMed Central Google Scholar
Лю, Дж., Перес, С. М., Чжан, В., Лодж, Д. Дж. И Лу, X.-Y. Селективная делеция рецептора лептина в дофаминовых нейронах вызывает анксиогенное поведение и увеличивает дофаминергическую активность в миндалине. Мол.Психиатрия 16 , 1024–1038 (2011).
CAS PubMed PubMed Central Google Scholar
Гофорт, П. Б., Лейннингер, Г. М., Паттерсон, К. М., Сатин, Л. С. и Майерс, М. Г. Лептин действует через нейроны нейротензина латеральной области гипоталамуса, подавляя нейроны орексина с помощью множества ГАМК-независимых механизмов. J. Neurosci. 34 , 11405–11415 (2014).
PubMed PubMed Central Google Scholar
Хо, Л., Maeng, L., Bjørbk, C. & Grill, H. J. Leptin и контроль приема пищи: нейроны в ядре единственного тракта активируются как растяжением желудка, так и лептином. Эндокринология 148 , 2189–2197 (2007).
CAS Google Scholar
Morton, G.J. et al. Действие лептина в переднем мозге регулирует реакцию заднего мозга на сигналы сытости. J. Clin. Вкладывать деньги. 115 , 703–710 (2005).
CAS PubMed PubMed Central Google Scholar
Уильямс, Д. Л., Баскин, Д. Г. и Шварц, М. В. Регулирование лептином анорексической реакции на стимуляцию рецептора глюкагоноподобного пептида-1. Диабет 55 , 3387–3393 (2006).
CAS Google Scholar
Гриль, Х. Дж. Доказательства того, что хвостовой ствол мозга является мишенью для ингибирующего действия лептина на прием пищи. Эндокринология 143 , 239–246 (2002).
CAS Google Scholar
Hayes, M. R. et al. Эндогенная передача сигналов лептина в каудальном ядре солитарного тракта и в области postrema необходима для регуляции энергетического баланса. Cell Metab. 11 , 77–83 (2010).
CAS PubMed PubMed Central Google Scholar
Скотт, М.M. et al. Лептин нацелен на мозг мыши. J. Comp. Neurol. 514 , 518–532 (2009).
CAS PubMed PubMed Central Google Scholar
Паттерсон, К. М., Лешан, Р. Л., Джонс, Дж. К. и Майерс, М. Г. Молекулярное картирование областей мозга мыши, иннервируемых клетками, экспрессирующими рецептор лептина. Brain Res. 1378 , 18–28 (2011).
CAS Google Scholar
Ядав, В.K. et al. Серотонин-зависимый механизм объясняет лептиновую регуляцию костной массы, аппетита и расхода энергии. Cell 138 , 976–989 (2009).
CAS PubMed PubMed Central Google Scholar
Lam, D. D. et al. Лептин не влияет напрямую на серотониновые нейроны ЦНС, влияя на аппетит. Cell Metab. 13 , 584–591 (2011).
CAS PubMed PubMed Central Google Scholar
Flak, J.N. et al. Ингибированные лептином нейроны PBN усиливают реакцию на гипогликемию при отрицательном энергетическом балансе. Nat. Neurosci. 17 , 1744–1750 (2014).
CAS PubMed PubMed Central Google Scholar
Flak, J. N. et al. Контур, регулируемый лептином, контролирует мобилизацию глюкозы во время вредных раздражителей. J. Clin. Вкладывать деньги. 127 , 3103–3113 (2017).
PubMed PubMed Central Google Scholar
Каноски, С.Э. и Гриль, Х. Дж. Вклад гиппокампа в контроль потребления пищи: мнемонические, нейроанатомические и эндокринные механизмы. Biol. Психиатрия 81 , 748–756 (2017).
Google Scholar
El-Haschimi, K., Pierroz, D. D., Hileman, S. M., Bjørbk, C. & Flier, J. S. Два дефекта способствуют устойчивости гипоталамуса к лептину у мышей с ожирением, вызванным диетой. J. Clin. Вкладывать деньги. 105 , 1827–1832 (2000).
CAS PubMed PubMed Central Google Scholar
Джеймсон Дж. Синдромы гормональной резистентности . (Springer Science & Business Media, 1999).
Google Scholar
Münzberg, H., Flier, J. S. & Bjørbæk, C. Регион-специфическая резистентность к лептину в гипоталамусе мышей с ожирением, вызванным диетой. Эндокринология 145 , 4880–4889 (2004).
Google Scholar
Bjørbaek, C., Elmquist, J. K., Frantz, J. D., Shoelson, S. E. & Flier, J. S. Идентификация SOCS-3 как потенциального медиатора центральной резистентности к лептину. Мол. Ячейка 1 , 619–625 (1998).
Google Scholar
Bjørbæk, C. et al. Дивергентные роли SHP-2 в активации ERK рецепторами лептина. Дж.Биол. Chem. 276 , 4747–4755 (2001).
Google Scholar
Бьёрбек, К., Эль-Хашими, К., Франц, Дж. Д. и Флиер, Дж. С. Роль SOCS-3 в передаче сигналов лептина и устойчивости к лептину. J. Biol. Chem. 274 , 30059–30065 (1999).
Google Scholar
Bjornholm, M. et al. Мыши, у которых отсутствуют сигналы тормозящего рецептора лептина, худые, с нормальной эндокринной функцией. J. Clin. Вкладывать деньги. 117 , 1354–1360 (2007).
CAS PubMed PubMed Central Google Scholar
Mori, H. et al. Дефицит Socs3 в головном мозге повышает чувствительность к лептину и придает устойчивость к ожирению, вызванному диетой. Nat. Med. 10 , 739–743 (2004).
CAS Google Scholar
Заболотный, Ю.M. et al. PTP1B регулирует передачу сигнала лептина in vivo . Dev. Ячейка 2 , 489–495 (2002).
CAS Google Scholar
White, C. L. et al. Диета с HF увеличивает гипоталамический PTP1B и индуцирует резистентность к лептину через как лептин-зависимые, так и независимые механизмы. AJP Endocrinol. Метаб. 296 , E291 – E299 (2008).
Google Scholar
Бенце, К.K. et al. Нейрональный PTP1B регулирует массу тела, ожирение и действие лептина. Nat. Med. 12 , 917–924 (2006).
CAS PubMed PubMed Central Google Scholar
Loh, K. et al. Повышенный уровень TCPTP в гипоталамусе при ожирении способствует устойчивости клеток к лептину. Cell Metab. 14 , 684–699 (2011).
CAS PubMed PubMed Central Google Scholar
Люменг, К.N. & Saltiel, A.R. Воспалительные связи между ожирением и нарушением обмена веществ. J. Clin. Вкладывать деньги. 121 , 2111–2117 (2011).
CAS PubMed PubMed Central Google Scholar
Thaler, J. et al. Ожирение связано с повреждением гипоталамуса у грызунов и людей. J. Clin. Вкладывать деньги. 122 , 153 (2011). Это исследование показывает, что ожирение связано с увеличением числа гипоталамических астроцитов и их активацией у людей, а также на моделях грызунов.
PubMed PubMed Central Google Scholar
Zhang, X. et al. Гипоталамический стресс IKKb / NF-kB ER связывает переедание с энергетическим дисбалансом и ожирением. Cell 135 , 61–73 (2008).
CAS PubMed PubMed Central Google Scholar
Benoit, S.C. et al. Пальмитиновая кислота опосредует гипоталамическую резистентность к инсулину, изменяя субклеточную локализацию PKC-θ у грызунов. J. Clin. Вкладывать деньги. 119 , 2577–2589 (2009).
CAS PubMed PubMed Central Google Scholar
Romanatto, T. et al. TNF-альфа действует в гипоталамусе, подавляя прием пищи и увеличивая респираторный коэффициент — воздействуя на сигнальные пути лептина и инсулина. Пептиды 28 , 1050–1058 (2007).
CAS Google Scholar
Арруда, А.P. et al. Низкая степень воспаления гипоталамуса приводит к нарушению термогенеза, инсулинорезистентности и нарушению секреции инсулина. Эндокринология 152 , 1314–1326 (2011).
CAS Google Scholar
Sabio, G. et al. Роль оси гипоталамус-гипофиз-тиреоид в регуляции метаболизма с помощью JNK1. Genes Dev. 24 , 256–264 (2010).
CAS PubMed PubMed Central Google Scholar
Цаусиду, Э.и другие. Различная роль активации JNK и IKK в агути-связанных пептидных нейронах в развитии ожирения и инсулинорезистентности. Cell Rep. 9 , 1495–1506 (2014).
CAS PubMed PubMed Central Google Scholar
Benzler, J. et al. Центральное ингибирование передачи сигналов IKKb / NF-kB снижает ожирение и непереносимость глюкозы, вызванное диетой с высоким содержанием жиров. Диабет 64 , 2015–2027 (2015).
CAS Google Scholar
Milanski, M. et al. Насыщенные жирные кислоты вызывают воспалительную реакцию преимущественно за счет активации передачи сигналов TLR4 в гипоталамусе: последствия для патогенеза ожирения. J. Neurosci. 29 , 359–370 (2009).
CAS PubMed PubMed Central Google Scholar
Бутти, Э.и другие. Отсутствие интратекальной иммунной реакции на зависимый от помощника аденовирусный вектор, доставленный в спинномозговую жидкость нечеловеческих приматов. Gene Ther. 15 , 233–238 (2008).
CAS Google Scholar
Ропелл, Э. Р. и др. Противовоспалительная активность IL-6 и IL-10 связывает упражнения с гипоталамической чувствительностью к инсулину и лептину через ингибирование стресса IKKβ и ER. PLoS Biol. 8 , e1000465 (2010).
PubMed PubMed Central Google Scholar
Донг, З. М., Гутьеррес-Рамос, Дж. К., Коксон, А., Майадас, Т. Н. и Вагнер, Д. Д. Новый класс генов ожирения кодирует рецепторы адгезии лейкоцитов. Proc. Natl Acad. Sci. USA 94 , 7526–7530 (1997).
CAS Google Scholar
Langhans, W. Сигналы, вызывающие анорексию во время острого заболевания. Proc. Nutr. Soc. 66 , 321–330 (2007).
CAS Google Scholar
Valdearcos, M. et al. Микроглия определяет влияние потребления насыщенных жиров на воспаление гипоталамуса и нейрональную функцию. Cell Rep. 9 , 2124–2139 (2014).
CAS PubMed PubMed Central Google Scholar
Дорфман, М.D. et al. Половые различия в передаче сигналов CX3CR1 микроглии определяют предрасположенность мышей к ожирению. Nat. Commun. 8 , 14556 (2017).
CAS PubMed PubMed Central Google Scholar
Schafer, D. P. et al. Микроглия формирует постнатальные нейронные цепи в зависимости от активности и комплемента. Нейрон 74 , 691–705 (2012).
CAS PubMed PubMed Central Google Scholar
Аллен, Н.J. Регуляция синаптического поведения астроцитами. Annu. Rev. Cell Dev. Биол. 30 , 439–463 (2014).
CAS Google Scholar
Йе, Дж. И МакГиннесс О. П. Воспаление при ожирении — это не все плохо: данные исследований на животных и людях. AJP Endocrinol. Метаб. 304 , E466 – E477 (2013).
CAS Google Scholar
Озджан, Л.и другие. Стресс эндоплазматического ретикулума играет центральную роль в развитии резистентности к лептину. Cell Metab. 9 , 35–51 (2009). Это исследование показывает, что ожирение связано с активацией путей, связанных со стрессом ER в гипоталамусе, и что повышенный стресс ER может притупить передачу сигналов лептина.
CAS Google Scholar
Бэк, С. Х. и Кауфман, Р. Дж. Стресс эндоплазматического ретикулума и диабет 2 типа. Annu. Rev. Biochem. 81 , 767–793 (2012).
CAS PubMed PubMed Central Google Scholar
Marciniak, S.J. & Ron, D. Передача сигналов стресса эндоплазматического ретикулума при заболевании. Physiol. Ред. 86 , 1133–1149 (2006).
CAS Google Scholar
Williams, K. W. et al. Xbp1s в нейронах pomc связывает стресс ER с энергетическим балансом и гомеостазом глюкозы. Cell Metab. 20 , 471–482 (2014).
CAS PubMed PubMed Central Google Scholar
Лю, Дж., Ли, Дж., Эрнандес, М. А. С., Мазичек, Р., Озкан, У. Лечение ожирения с помощью целастрола. Ячейка 161 , 999–1011 (2015).
CAS PubMed PubMed Central Google Scholar
Ли, Дж.и другие. Витаферин А является сенсибилизатором лептина с сильными антидиабетическими свойствами у мышей. Nat. Med. 22 , 1023–1032 (2016).
CAS PubMed PubMed Central Google Scholar
Ottaway, N. et al. У мышей с ожирением, вызванным диетой, сохраняется действие эндогенного лептина. Cell Metab. 21 , 877–882 (2015).
CAS PubMed PubMed Central Google Scholar
Рыцарь, З.А., Ханнан, К. С., Гринберг, М. Л. и Фридман, Дж. М. Гиперлептинемия необходима для развития резистентности к лептину. PLoS ONE 5 , e11376 (2010). В этом исследовании используются мыши с «ограниченным» уровнем лептина, чтобы показать, что тучные мыши, у которых не наблюдается высоких уровней лептина, остаются чувствительными к экзогенному лептину. Таким образом, высокий уровень лептина, а не другие процессы, связанные с ожирением, представляет собой главный фактор, ограничивающий действие лептина при ожирении.
PubMed PubMed Central Google Scholar
Флиер, Дж.С. & Маратос-Флиер, Э. Лептин. Физиологическая роль: император энергетического баланса голый? Cell Metab. 26 , 24–26 (2017).
CAS Google Scholar
Müller, T. D. et al. Восстановление реакции на лептин у мышей с ожирением, вызванным диетой, с использованием оптимизированного аналога лептина в комбинации с эксендином-4 или FGF21. J. Pept. Sci. 18 , 383–393 (2012).
Google Scholar
Рот, Дж.D. et al. Реакция на лептин, восстановленная агонизмом амилина при ожирении, вызванном диетой: данные доклинических и клинических исследований. Proc. Natl Acad. Sci. США 105 , 7257–7262 (2008).
CAS Google Scholar
Берк, Л. К. и Хейслер, Л. К. 5-гидрокситриптаминовые препараты для лечения ожирения. J. Neuroendocrinol. 27 , 389–398 (2015).
CAS Google Scholar
Солинас, Г.и другие. JNK1 в гематопоэтических клетках способствует воспалению, вызванному диетой, и инсулинорезистентности, не влияя на ожирение. Cell Metab. 6 , 386–397 (2007).
CAS Google Scholar
Nguyen, M. T. A. et al. Субпопуляция макрофагов инфильтрирует гипертрофическую жировую ткань и активируется свободными жирными кислотами через toll-подобные рецепторы 2 и 4 и JNK-зависимые пути. Дж.Биол. Chem. 282 , 35279–35292 (2007).
CAS Google Scholar
Saberi, M. et al. Специфическая делеция гематопоэтических клеток Toll-подобного рецептора 4 улучшает инсулинорезистентность печени и жировой ткани у мышей, получавших пищу с высоким содержанием жира. Cell Metab. 10 , 419–429 (2009).
CAS PubMed PubMed Central Google Scholar
Ван Х.и другие. Дефицит липопротеинлипазы в нейронах изменяет регуляцию энергетического баланса и приводит к ожирению. Cell Metab. 13 , 105–113 (2011).
CAS PubMed PubMed Central Google Scholar
Ридаура, В. К. и др. Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей. Наука 341 , 1241214 (2013).
Google Scholar
Рейндерс, Д.и другие. Влияние манипуляции кишечной микробиоты антибиотиками на метаболизм хозяина у людей с ожирением: рандомизированное двойное слепое плацебо-контролируемое исследование. Cell Metab. 24 , 63–74 (2016).
CAS Google Scholar
Simonds, S.E. et al. Лептин опосредует повышение артериального давления, связанное с ожирением. Cell 159 , 1404–1416 (2014).
CAS PubMed PubMed Central Google Scholar
Лорд, Г.M. et al. Лептин модулирует иммунный ответ Т-клеток и устраняет иммуносупрессию, вызванную голоданием. Nature 394 , 897–901 (1998).
CAS Google Scholar
Рон Д. и Уолтер П. Интеграция сигнала в развернутом белковом ответе эндоплазматического ретикулума. Nat. Rev. Mol. Клетка. Биол. 8 , 519–529 (2007).
CAS Google Scholar
Генри, Ф.Э., Сугино, К., Тозер, А., Бранко, Т., Стернсон, С. М. Типоспецифическая транскриптомика гипоталамических энергочувствительных нейронов в ответ на потерю веса. eLife 4 , e09800 (2015).
PubMed PubMed Central Google Scholar
Лептин | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Deck, C. et. др. (7 апреля 2017 г.). Оценка функциональной роли лептина в энергетическом гомеостазе и ответной реакции на стресс у позвоночных. Фронт-эндокринол (Лозанна). 2017; 8: 63. Доступно в Интернете по адресу https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5384446/. Проверено 01.05.17.
Londraville, R. et. al. (2017 10 апреля). О молекулярной эволюции лептина, лептинового рецептора и эндоспанина. Фронт-эндокринол (Лозанна). 2017; 8: 58. Доступно в Интернете по адресу https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5385356/. Проверено 01.05.17.
Kruljac, I. et. al. (2016). Изменения метаболических гормонов после бариатрической хирургии и их прогнозирующее влияние на потерю веса.Клиническая эндокринология Medscape от Clin Endocrinol. 2016; 85 (6): 852-860. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/872569. Проверено 01.05.17.
(© 2017). Что делает лептин? Сеть гормонального здоровья. Доступно в Интернете по адресу http://www.hormone.org/hormones-and-health/what-do-hormones-do/cortisol/leptin. Проверено 01.05.17.
Lee, C. et. al. (2015). Ожирение, адипокины и рак: обновление. Клиническая эндокринология Medscape от Clin Endocrinol. 2015; 83 (2): 147-156. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/848555_1. Проверено 01.05.17.
McCall, B. (17 ноября 2016 г.). Новости конференции Medscape. Низкий уровень витамина B12 и лептина: связь с метаболическим риском у следующего поколения? Доступно в Интернете по адресу http://www.medscape.com/viewarticle/872008. Проверено 01.05.17.
Чавла, Дж. И Парк, Ю. (обновлено 29 июня 2016 г.). Анатомия эндокринной системы. Медицинские препараты и болезни, Анатомия. Доступно на сайте http: // emedicine.medscape.com/article/1948709-overview#showall. Проверено 01.05.17.
Источники, использованные в предыдущих обзорах
Hamdy, O. (Обновлено 24 января 2013 г.). Ожирение. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/123702-overview#showall. По состоянию на февраль 2013 г.
(© 1995-2013). Лептин. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/
.По состоянию на февраль 2013 г.Miehle, K. et. al. (2012). Лептин, адипонектин и другие адипокины при гестационном сахарном диабете и преэклампсии. Medscape от Clin Endocrinol . 2012; 76 (1): 2-11 [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/755467. По состоянию на февраль 2013 г.
Лоусон, Э. (2012). Уровни лептина связаны со снижением депрессивных симптомов у женщин любого веса, независимо от жира в организме. Medscape от Clin Endocrinol .2012; 76 (4): 520-525 [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/760937. По состоянию на февраль 2013 г.
Шварц, С. и Виндл, М. (Обновлено 12 декабря 2012 г.). Ожирение у детей. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/985333-overview. По состоянию на февраль 2013 г.
Чавла Дж. И Янгсук П. (Обновлено 3 октября 2012 г.). Анатомия эндокринной системы. Справочник по Medscape [Он-лайн информация]. Доступно на сайте http: // emedicine.medscape.com/article/1948709-overview#showall. По состоянию на февраль 2013 г.
Ахима, Р. (1 июля 2008 г.). Возвращаясь к роли лептина в ожирении и потере веса. J Clin Invest. V 118 (7): 2380–2383. [Он-лайн информация]. Доступно в Интернете по адресу http://www.jci.org/articles/view/36284. По состоянию на февраль 2013 г.
Koh, K. et. al. (2008). Современные обзоры сердечно-сосудистой медицины, лептина и сердечно-сосудистых заболеваний, ответ на терапевтические вмешательства [он-лайн информация]. Тираж v 117: 3238-3249. [Он-лайн информация]. Доступно в Интернете по адресу http://circ.ahajournals.org/content/117/25/3238.full. По состоянию на февраль 2013 г.
Ahmet Ursavas, A. et. al. (2010 июль — сентябрь). Уровни грелина, лептина, адипонектина и резистина при синдроме апноэ во сне: роль ожирения. Энн Торак Мед . Июль-сентябрь 2010 г .; 5 (3): 161–165 [Он-лайн информация]. Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2930655/. По состоянию на февраль 2013 г.
Шеер, Ф. (17 марта 2009 г.). Неблагоприятные метаболические и сердечно-сосудистые последствия смещения циркадных ритмов. PNAS v 106 (11) 4453-4458 [Он-лайн информация]. Доступно в Интернете по адресу http://www.pnas.org/content/106/11/4453.long. По состоянию на февраль 2013 г.
Carlson, J. et. al. (11 августа 2009 г.). Уровни гормона аппетита до и после приема пищи у женщин с нормальным весом и с тяжелым ожирением. Питание и обмен веществ v 6 (32) [Он-лайн информация]. Доступно в Интернете по адресу http: // www.Nutritionandmetabolism.com/content/6/1/32. По состоянию на февраль 2013 г.
Фаруки, С. и О’Рахилли, С. (1 декабря 2006 г.). Генетика ожирения у людей. Обзоры эндокринной системы v 27 (7) 710-718. [Он-лайн информация]. Доступно в Интернете по адресу http://edrv.endojournals.org/content/27/7/710.full. По состоянию на февраль 2013 г.
Franks, P. et. al. (2007 май). Расход энергии при физической активности может опосредовать взаимосвязь между уровнем лептина в плазме и ухудшением инсулинорезистентности независимо от ожирения. Журнал прикладной физиологии c 102 (5) 1921-1926. [Он-лайн информация]. Доступно в Интернете по адресу http://jap.physiology.org/content/102/5/1921.full. По состоянию на февраль 2013 г.
Stella L. Volpe, S. et. al. (2008 апрель). Влияние диеты и упражнений на состав тела, потребление энергии и уровни лептина у женщин и мужчин с избыточным весом. J Am Coll Nutr v 27 (2) 195-208 [Он-лайн информация]. Доступно в Интернете по адресу http://www.jacn.org/content/27/2/195.full. По состоянию на февраль 2013 г.
Chiesa, C. et. al. (2008) Грелин, Лептин, IGF-1, IGFBP-3 и концентрации инсулина при рождении: есть ли связь с ростом плода и неонатальной антропометрией? Clinical Chemistry v 54 (3) 550–558 [Он-лайн информация]. Доступно в Интернете по адресу http://www.clinchem.org/content/54/3/550.full. По состоянию на февраль 2013 г.
Хенсон М. и Кастракейн В. (1 февраля 2006 г.). Лептин при беременности: обновление. Биология репродукции v 74 (2) 218-229 [Он-лайн информация].Доступно в Интернете по адресу http://www.biolreprod.org/content/74/2/218.full. По состоянию на февраль 2013 г.
S17 Шоке, Х. и Мейр, Д. (май 2011 г.) Генетика ожирения: что мы узнали? Curr Genomics v 12 (3): 169–179. [Он-лайн информация]. Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3137002/. По состоянию на февраль 2013 г.
Considine, R, et al. Концентрации иммунореактивного лептина в сыворотке крови у людей с нормальным весом и ожирением. N Engl J Med 1996; 334: 292-295.Доступно в Интернете по адресу http://www.nejm.org/doi/full/10.1056/NEJM199602013340503#t=articleTop. По состоянию на февраль 2013 г.
Нирав Р. Шах, Эрик Р. Браверман. Измерение ожирения у пациентов: полезность индекса массы тела (ИМТ), процента жира в организме и лептина. PLoS One. Опубликовано 2 апреля 2012 г. Доступно в Интернете по адресу http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0033308. По состоянию на февраль 2013 г.
лептина: меньше значит больше | Диабет
Введение
Знаменательное открытие гена Lep и демонстрация физиологической роли лептина вызвали большой интерес в области метаболизма (1,2).Наряду с лептином, идентификация второго важного гормона адипоцитов, адипонектина (3), коренным образом изменила наше представление о жировой ткани и ее связи с другими органами в середине 1990-х годов. Жировая ткань больше не считалась просто поглотителем энергии; скорее, мы начали ценить его роль как высокоактивного эндокринного органа. Ранние исследования также подчеркнули важность жировой ткани как таковой как ключевого регулятора системного энергетического метаболизма.
Лептин, продукт гена Lep , представляет собой пептидный гормон из 167 остатков.Он в первую очередь секретируется жировой тканью. Функциональная инактивация гена Lep приводит к неопределяемым уровням лептина в кровообращении (4). После попадания жировой тканью в кровоток лептин достигает своих целей, включая гипоталамус, с помощью различных механизмов (5). Хотя механизмы все еще несколько неясны, сообщалось, что лептин достигает головного мозга посредством прямого транспорта через окружные желудочковые органы, насыщаемого транспорта через гематоэнцефалический барьер (6) и поглощения в паренхиме мозга и сосудистом сплетении (7).Связывание лептина с длинной формой его рецептора (LepRb) активирует хорошо изученный нижестоящий сигнальный путь, который регулирует потребление пищи и расход энергии (8). Центральная система меланокортина является мишенью лептина для регулирования энергии и гомеостаза глюкозы (9). Эта система состоит из смешанных нейронов, экспрессирующих проопиомеланокортин (POMC), и нейронов, продуцирующих агути-родственный белок (AgRP), которые соответственно активируются и ингибируются лептином. В частности, нейроны POMC, экспрессирующие LepR, регулируют гомеостаз глюкозы в печени (9), а нейроны AgRP, экспрессирующие LepR, регулируют потребление пищи и расход энергии (10).
В отличие от инсулина, который хранится в гранулах для немедленного высвобождения в ответ на соответствующий стимул (11), скорость высвобождения лептина в первую очередь зависит от скорости транскрипции и трансляции гена Lep . В адипоците отсутствует классический «запускаемый» экзоцитарный путь, и в лучшем случае он отвечает индуцибельным образом, высвобождая факторы, которые задерживаются на уровне эндоплазматического ретикулума в течение 15–30-минутной задержки. Другими словами, уровни лептина в циркуляции достаточно стабильны на краткосрочной основе (т.е. от еды к еде) и требуют (при нормальных физиологических условиях) часов, а не минут / секунд, чтобы отреагировать на различные метаболические стимулы. Точно так же остается загадкой, как лептин регулирует ежедневное потребление пищи. Повышенные уровни инсулина и глюкокортикоидов являются сильными стимуляторами секреции лептина. Напротив, симпатическая нервная система посредством активации адренергических рецепторов значительно подавляет высвобождение лептина (9).
Острое и хроническое введение рекомбинантного лептина худым людям или мышам (мышам дикого типа или мышам с дефицитом лептина ob / ob ) дает ряд ответных реакций, таких как снижение потребления пищи и массы тела (12).Это и другие наблюдения легли в основу лептиновой терапии для одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США лечения людей с дефицитом лептина и генерализованной липодистрофией (13). Первоначально ожидалось, что лептиновая терапия будет иметь такой же успешный потенциал для лечения ожирения, вызванного диетой, как и инсулин для лечения диабета (14). Однако было быстро установлено, что подавляющее большинство людей с ожирением не испытывают недостатка в лептине. Скорее, наиболее распространенные формы ожирения связаны с чрезмерным уровнем лептина в кровотоке (получившее название «гиперлептинемия»), что приводит к еще не определенному состоянию «резистентности к лептину» (15).Наиболее распространенное определение устойчивости к лептину — это неспособность фармакологических доз лептина подавлять потребление пищи и массу тела. Однако «селективная резистентность к лептину» также предлагается для объяснения сохранения действия лептина при гипертонии и репродуктивной оси в контексте ожирения, вызванного диетой (16). В отличие от инсулинорезистентности, которую можно хотя бы частично преодолеть за счет дальнейшего повышения уровня инсулина, повышение циркулирующих уровней лептина совершенно неэффективно.Таким образом, многочисленные попытки восстановить физиологическую роль лептина на протяжении многих лет не увенчались успехом. Как следствие, первоначальная идея о том, что лептиновую терапию можно использовать для эффективного преодоления ожирения, вызванного диетой, в доклинических и клинических условиях, пришлось отказаться.
Гиперлептинемия: причина или следствие ожирения?
По мере того, как ожирение постепенно прогрессирует с увеличением массы жировой ткани (в результате дисбаланса между потреблением энергии и ее расходом), обычно наблюдается сопутствующее заметное повышение уровней лептина в кровотоке.В нормальных физиологических условиях циркулирующие уровни лептина пропорциональны массе жировой ткани для данного человека, несмотря на значительные колебания при любом заданном ИМТ. Таким образом, кажется правдоподобным, что гиперлептинемия, связанная с ожирением, может быть следствием ожирения. Следовательно, считалось, что гиперлептинемия не играет прямой роли в возникновении расстройств, связанных с ожирением. Однако, учитывая сильную и положительную связь гиперлептинемии со многими метаболическими нарушениями, такими как инсулинорезистентность, заболевание почек и сердечно-сосудистые заболевания, возможно ли, что роль гиперлептинемии была упущена из виду? Другими словами: способствует ли гиперлептинемия как таковая метаболической дисфункции, обычно наблюдаемой у лиц с ожирением (17)? Например, было показано, что гиперлептинемия, независимая от ожирения, является прогностическим фактором прогрессирования сердечно-сосудистых заболеваний (18).Мы предполагаем, что вклад хронической гиперлептинемии (в пределах физиологического диапазона) не получил должного внимания.
Следует отметить, что высокие (фармакологические) уровни лептина необходимы, но недостаточны для индукции резистентности к лептину. В отсутствие других стимулирующих факторов, таких как диета с высоким содержанием жиров (HFD), гиперлептинемия улучшает метаболизм глюкозы и чувствительность к инсулину, что наблюдается у трансгенных худых мышей со сверхэкспрессией лептина и у мышей, получающих хронические интрацеребровентрикулярные заболевания (т.е.c.v.) перфузии лептина (12,19). При воздействии HFD гиперлептинемия способствует развитию резистентности к лептину (20). Хронически повышенный уровень лептина у мышей (за счет конститутивной сверхэкспрессии очень высокого уровня лептина из трансгенной кассеты в жировой ткани) приводит к повышенной восприимчивости к ожирению, вызванному диетой (21), а также к увеличению массы жировой ткани с возрастом. В соответствии с этими наблюдениями, мы недавно сообщили, что дальнейшее повышение уровней лептина даже в пределах физиологического диапазона в контексте существовавшего ранее ожирения (за счет использования титруемой доксициклин [Dox] -индуцируемой кассеты гиперэкспрессии лептина, специфичной для жировой ткани) ускоряет вызванное диетой ожирением и резко ухудшает инсулинорезистентность, связанную с ожирением (22).Удивительно, но менее чем удвоение концентрации лептина в кровотоке было достаточно, чтобы вызвать эти очень глубокие метаболические изменения. Это контрастирует с предыдущими подходами, которые доставляли лептин на фармакологическом уровне (12,19). Основываясь на этих наблюдениях, мы предположили, что в контексте ожирения любое вмешательство, прямо или косвенно способствующее секреции лептина, можно рассматривать в долгосрочной перспективе как «фактор ожирения» с негативными метаболическими последствиями. Эта модель подтверждается рядом наблюдений.Например, инсулин и глюкокортикоиды, оба гормона, которые стимулируют высвобождение лептина, также способствуют ожирению, вызванному диетой (9,15). Более того, определенные воспалительные факторы, такие как фактор некроза опухоли-α и липополисахарид, усиливают секрецию лептина, обеспечивая решающую связь между ожирением и связанными с ним метаболическими нарушениями.
Однако одна постоянная проблема заключается в том, что ни одна из этих моделей не может функционально отделить изменения уровней лептина от других изменений, происходящих одновременно на уровне адипоцитов.
Гиперлептинемия в эволюции
Долгосрочная эволюционная проблема заключалась в нехватке пищи, а не в ее избытке. Давление отбора было явно направлено на разработку ряда стратегий, позволяющих эффективно справиться с голоданием, чтобы выжить в период нехватки калорий. В ответ на голодание снижение уровня лептина вызывает ряд характерных нейроэндокринных реакций, включая повышение аппетита, снижение фертильности, замедление скорости метаболизма и подавление роста, для увеличения потребления пищи и подавления некритических физиологических функций для выживания (2) .Другими словами, уровни лептина в пределах физиологического диапазона информируют мозг о том, что сейчас не время дефицита энергии. Эта хорошо сохранившаяся реакция голодания может быть основной функциональной целью падения лептина. Однако в контексте переизбытка пищи связанная с ожирением гиперлептинемия, а не вызванное голоданием падение уровня лептина, становится главным эффектором лептина в кровотоке. Однако нейроны по-прежнему реагируют на изменения повышенного уровня лептина на основании многочисленных наблюдений.Во-первых, у мышей с ожирением уровни рецепторов лептина в гипоталамической области увеличиваются, а не снижаются (23). Во-вторых, базальные уровни фосфо-STAT3 у мышей с ожирением, вызванным диетой, скорее увеличиваются, чем снижаются (24). В-третьих, полный блок действия рецептора лептина с помощью антагонистов рецептора лептина или специфических ингибиторов дополнительно увеличивает потребление пищи и прибавку в весе (25). В-четвертых, внутривенная инъекция лептина тучным мышам по-прежнему эффективна для значительного снижения веса и чувствительности к инсулину (26).
Все эти наблюдения подтверждают модель, в которой подмножества цепей, реагирующих на лептин, могут быть задействованы даже в контексте ожирения. Более того, мы прогнозируем, что устойчивость к лептину при ожирении по-разному запускается в разных группах нейронов. Например, лептин-чувствительные нейроны, регулирующие питание, становятся резистентными раньше, чем лептин-чувствительные нейроны, которые регулируют вегетативный отток, включая кровяное давление. Этот прогноз является расширением концепции «селективной резистентности к лептину» (27).Эта модель аналогична концепции селективной инсулинорезистентности в печени, описанной Брауном и Голдштейном (28), в которой инсулин не может подавить выработку глюкозы в печени, но высокий уровень инсулина продолжает стимулировать липогенез. Эти реакции, возникающие после повышения уровня лептина, могут способствовать увеличению потребления пищи и метаболическим нарушениям, связанным с ожирением, таким как диабет, гипертония и сердечно-сосудистые заболевания. Все это в конечном итоге приводит к снижению продолжительности здоровья и продолжительности жизни (29).В этом смысле ограничение действия лептина в низком «физиологическом» диапазоне может фактически улучшить физическую форму.
Частичное снижение лептина: полезно или источник дальнейшего ухудшения метаболизма?
Учитывая возможность того, что гиперлептинемия способствует ожирению и связанным с ним метаболическим нарушениям, мы исследовали любые потенциально полезные эффекты, связанные со снижением циркулирующих уровней лептина. Примечательно, что мы оценивали эффекты частичного снижения лептина в двух разных условиях: 1 ) в контексте высокой чувствительности к лептину и 2 ) в контексте исходной устойчивости к лептину.
В контексте повышенной чувствительности к лептину (наблюдаемой в очень худом состоянии и в молодом возрасте) уровни циркулирующего лептина низкие. В этих условиях реакция на дальнейшее снижение уровней лептина совпадает с классической моделью, которая подчеркивает, что низкие уровни циркулирующего фактора, производного адипоцитов (например, лептина), отражают дефицит энергии и вызывают увеличение потребления пищи и снижение расхода энергии ( 30). Как и ожидалось, мы наблюдали быстрое увеличение веса при снижении лептина у худых и молодых людей, что было продемонстрировано при использовании молодых худых мышей с индуцибельным нокаутом лептина (22).Это также очевидно у мышей и людей, гетерозиготных по одной из функциональных копий гена Lep (31,32). В гетерозиготном состоянии доза гена составляет всего 50%, и, следовательно, степень гиперлептинемии, достигаемая при ожирении, также снижается на 50%. В состоянии повышенной чувствительности к лептину дальнейшее снижение уровней лептина в кровотоке нежелательно. В этом контексте лечение рекомбинантным лептином является эффективным подходом к улучшению метаболизма глюкозы, что продемонстрировано впечатляющими результатами, полученными при лечении лептином ob / ob мышей и пациентов с липодистрофией.Подгруппа лиц с ожирением демонстрирует более низкие уровни лептина, что указывает на состояние повышенной чувствительности к лептину, и, как таковые, эти люди с ожирением адекватно реагируют на терапию лептином (33).
Однако кривая биологической доза-ответ для действия лептина по ингибированию приема пищи и стимулированию расхода энергии находится в относительно узком диапазоне, то есть переходе от состояния дефицита энергии с низким уровнем лептина к «энергетической достаточности», вызванной даже незначительным более высокий уровень лептина.Ответ лептина быстро выходит на плато на более высоких уровнях, после чего лептин остается абсолютно неэффективным. Следовательно, даже в условиях чувствительности к лептину, уровни лептина необходимо поддерживать строго в пределах физиологического уровня. Например, гиперлептинемия также вызывает резистентность к лептину даже у высокочувствительных к лептину мышей ob / ob (34).
В отличие от состояния, чувствительного к лептину, в контексте резистентности к лептину подход к снижению уровня лептина демонстрирует положительные антидиабетические и антиобезогенные эффекты.Эту модель поддерживает ряд независимых наблюдений. Снижение уровней лептина (вызванное либо генетическими стратегиями, либо нейтрализацией моноклональных антилептиновых антител) восстанавливает чувствительность к лептину в контексте ожирения, что сопровождается снижением потребления пищи и значительной потерей веса (22). Более того, лечение агонистом β3-адренергических рецепторов ингибирует стимулируемую инсулином секрецию лептина (9), вызывая снижение прибавки в весе при кормлении HFD (35). Кроме того, лечение обратным агонистом периферического рецептора каннабиноида-1 (CB1R) снижает экспрессию и секрецию лептина из адипоцитов и увеличивает клиренс лептина через почки; это коллективно противодействует развитию ожирения (36).Эти антиобезогенные эффекты проявляются лептин-зависимым образом, о чем свидетельствует наблюдение, что обратные агонисты CB1R полностью лишены каких-либо эффектов у мышей ob / ob или db / db . Кроме того, фенольные соединения, такие как ресвератрол, которые ингибируют экспрессию лептина в адипоцитах, защищают мышей от ожирения (37). Аналогичным образом было показано, что интерлейкин-6 снижает ожирение лептин-зависимым образом (38). Метформин, противодиабетический препарат первой линии с плейотропным положительным действием на энергетический гомеостаз, также подавляет секрецию лептина адипоцитами (39).Все эти наблюдения подтверждают модель, согласно которой «частичное снижение лептина» восстанавливает чувствительность к лептину и проявляет антиобезогенные эффекты в контексте состояний резистентности к лептину. Если дополнительные исследования подтверждают эту модель, это приводит к провокационному предсказанию, что любое соединение или терапевтическое вмешательство, которое прямо или косвенно ингибирует уровни лептина (за счет снижения транскрипции или секреции), потенциально может быть полезным для контроля веса и метаболического гомеостаза при ожирении.
Наши мыши с индуцибельным нокаутом лептина (полученные путем индуцибельной делеции гена Lep во время эмбрионального развития) являются средством непосредственного тестирования компонентов этой модели (рис. 1). У этих мышей наблюдается снижение уровня лептина в кровотоке более чем на 90%. С рождения до 6 недель кормления чау-диетой мыши с индуцибельным лептин-дефицитом демонстрируют быстрое увеличение веса по сравнению с контрольными мышами из одного помета. Однако при переходе на HFD скорость набора веса у мышей с дефицитом лептина намного ниже, чем у контрольных однопометников.Это говорит о том, что неспособность повышать уровень лептина в контексте ожирения сохраняет некоторую степень чувствительности к лептину, что делает мышей устойчивыми к ожирению, вызванному диетой.
Рисунок 1Масса тела индуцибельных мышей ob / ob и контрольных однопометников. Индуцибельных мышей ob / ob и контрольных однопометных мышей (Ctrl) помещали на диету с Dox 600 от рождения до 6-недельного возраста с последующим переходом на диеты HFD плюс Dox 600 и только HFD в указанные недели.Вес тела контролировали еженедельно.
Снижение веса за счет ограничения калорийности является первой рекомендацией при ожирении и связанных с ним метаболических нарушениях (40). Многочисленные исследования документально подтвердили благотворное влияние ограничения калорий на снижение веса и замедление прогрессирования множественных метаболических нарушений. Снижение лептина за счет ограничения калорийности увеличивает чувствительность к лептину и, как ожидается, в дальнейшем будет способствовать снижению веса или поддержанию веса (41). Однако этот прогноз не подтверждается наблюдением быстрого восстановления потерянного веса после ограничения калорийности (42).Серия клинических исследований, проведенных лабораторией Leibel, продемонстрировала, что восполнение запасов лептина у людей после потери веса обращает вспять скелетные мышцы, вегетативную и нейроэндокринную адаптацию для достижения снижения веса (43,44). Таким образом, снижение уровня лептина было предложено как причина восстановления массы тела (45). Альтернативное объяснение состоит в том, что как только ожирение установлено, вызываются изменения в ключевых центральных цепях, так что новый, повышенный уровень массы тела и жировой массы биологически защищается.Однако некоторые другие клинические отчеты предполагают, что люди с ожирением и более высоким базальным уровнем лептина более склонны к восстановлению веса (46). Более сильное снижение уровня лептина лучше коррелирует с поддержанием потери веса (47). Совсем недавно другое клиническое исследование пришло к выводу, что снижение лептина не противодействует потере веса и действительно коррелирует с дальнейшей потерей веса в долгосрочной перспективе (48). Будущие исследования потребуются, чтобы определить, способствует ли частичное снижение лептина при ожирении дальнейшей потере веса или, по крайней мере, фенотипу поддержания веса.
Основные механизмы, участвующие в положительных эффектах частичного снижения лептина
Изучение существующей литературы позволяет выявить еще много примеров генетических или фармакологических вмешательств, которые приводят к метаболическим улучшениям, связанным с выраженным снижением уровней лептина. Мы сами наблюдали критические эффекты, напрямую связывающие снижение уровня лептина с улучшением метаболизма. Комбинируя эти наблюдения с существующей литературой, мы утверждаем, что есть убедительные аргументы в пользу того, что снижение уровня лептина является основной движущей силой метаболически благоприятных эффектов многих вмешательств.
Механически, как достигается сенсибилизация лептином? Было предложено несколько механизмов (15,16), в том числе 1 ) лептин более эффективно транспортируется в мозг, 2 ) тот факт, что это приводит к устранению механизма подавления обратной связи для усиления передачи сигналов лептина, и 3 ) восстановление восприятия лептина в ключевых «метаболических» нейронах, таких как клетки POMC и AgRP.
Центральные механизмы восприятия лептина критически зависят от изменений концентрации лептина в периферической циркуляции (14).Уровень лептина в краткосрочной перспективе довольно стабилен; однако существует значительная степень колебаний в течение дня как часть суточных колебаний (49). Хотя физиологическое значение этих суточных колебаний все еще неясно, изменения в циркулирующем лептине могут «перезагружать» центральный сигнальный путь лептина. В контексте гиперлептинемии, связанной с ожирением, мы предполагаем, что «сглаженные» пики и впадины в суточных вариациях приводят к снижению реакции гипоталамических нейронов на действие лептина.Таким образом, экзогенно навязанное снижение лептина может восстановить колебания лептина и восстановить правильную передачу сигналов в нейронах гипоталамуса. Поэтому мы предполагаем, что снижение уровня лептина, вызванное голоданием, быстро восстанавливает передачу сигналов лептина, что приводит к усилению передачи сигналов лептина в период пониженных концентраций лептина на периферии. Это падение уровня лептина, которое резко непропорционально потере жировой массы, является критическим сигналом для нейронов для координации реакции на голодание (2). Острая реакция на лечение лептин-нейтрализующими антителами (которые очень эффективно снижают уровень лептина) может быть противоречивым образом связана с усилением передачи сигналов лептина.Эта модель потребует прямой оценки с использованием репортерных мышей, которые могут быстро обеспечить центральные считывания сигналов как лептина, так и инсулина.
Также хорошо известно, что лептин оказывает многие из своих эффектов, воздействуя на ключевые группы нейронов. Примечательно, что недавние данные свидетельствуют о том, что ключевые нейроны, включая нейроны POMC, регулируют динамику транскрипции и секреции лептина (50). Таким образом, чувствительность к лептину в ключевых нейронах может потребоваться для поддержания чувствительности к лептину в глобальном масштабе.Передача сигналов лептина в гипоталамусе регулируется обратной связью, чтобы предотвратить гиперактивацию. Ключевые механизмы обратной связи выполняются супрессором передачи сигналов цитокинов 3 (SOCS3) и фосфатазами, включая протеинтирозинфосфатазу 1B (PTP1B) и Т-клеточную протеинтирозинфосфатазу (TCPTP) (51,52). Связывание лептина с LepRb приводит к активации, фосфорилированию и транслокации STAT3 в ядро, чтобы модулировать экспрессию важных генов, включая SOCS3 (53). Затем SOCS3 связывается с янус-киназой 2 (JAK2), подавляя ее активность (54).Как классическая схема ингибирования с обратной связью, это эффективно ослабляет передачу сигналов лептина (55). Действительно, экспрессия SOCS3 в гипоталамической области зависит от лептина; более высокие уровни лептина способствуют увеличению экспрессии SOCS3 (53). Кроме того, подобно SOCS3, PTP1B также функционирует как часть механизма обратной связи для снижения передачи сигналов лептина (56). Связанная с ожирением гиперлептинемия индуцирует экспрессию PTP1B и способствует устойчивости к лептину (56).
Таким образом, в контексте ожирения основной причиной нарушения действия лептина может быть не дефект передачи сигналов лептина как таковой, а скорее мощные механизмы обратной связи, вызванные конститутивной активацией передачи сигналов лептина.Важно отметить, что это также влияет на передачу сигналов инсулина (57). Частичное снижение действия лептина в гипоталамусе улучшает эти механизмы обратной связи передачи сигналов лептина и восстанавливает как лептин, так и чувствительность к инсулину. Это может быть справедливо и для других областей мозга и на периферии, что приводит к сильным общесистемным сенсибилизирующим эффектам к инсулину, даже до потери веса.
Применение терапии частичного снижения лептина
В контексте ожирения частичная делеция лептина (достигнутая с помощью моноклональных лептин-нейтрализующих антител) вызывает значительную потерю веса, сопровождающуюся антидиабетическими исходами.Монотерапия лептин-нейтрализующими антителами может дополняться комбинированной терапией с другими противодиабетическими препаратами и препаратами против ожирения. Например, было показано, что агонисты рецептора GLP-1, уникальное семейство соединений с сильным действием на потерю веса, ингибируют прием пищи и способствуют расходу энергии за счет воздействия на центральную нервную систему. Кроме того, было продемонстрировано, что GLP-1 усиливает центральное действие лептина и проявляет свои анорексические эффекты в синергии с лептином. В предыдущих сообщениях изучалась потенциальная комбинированная терапия агонистов GLP-1 с лептином.Однако эта комбинация требует диеты с низким содержанием липидов (т. Е. Перехода с HFD на диету с пищей), сопровождаемой резкой потерей веса (более ~ 28%), чтобы наблюдать восстановление реакции на лептин (58). В этом контексте привлекательным подходом может быть комбинированная терапия частичного снижения лептина с агонистами рецептора GLP-1.
Подобно GLP-1, FGF21 вызывает значительную потерю веса у мышей с ожирением, прежде всего за счет регулирования метаболизма глюкозы и расхода энергии (59). FGF21 и его производные служат потенциальными мишенями для лекарств и, как таковые, в настоящее время находятся в стадии разработки.Последние данные предполагают, что потеря веса, вызванная FGF21, опосредуется централизованно, поскольку рецепторы FGF21 были идентифицированы в медиобазальном гипоталамусе, области мозга, которая также сильно обогащена рецепторами лептина. Это создает привлекательную возможность для синергетических эффектов для FGF21 и лептина. Однако комбинированная терапия лептином с FGF21 сталкивается с теми же проблемами, что и комбинированная терапия GLP-1 / лептин (58). Это говорит о том, что терапия частичного снижения лептина может быть лучшим выбором для комбинации.В дополнение к этому, нежелательные побочные эффекты в отношении потери костной массы, связанные с FGF21, значительно снижают его клинический потенциал. Лептин является мощным ингибитором костеобразования in vivo, и поэтому снижение уровня лептина увеличивает костную массу (60). В совокупности комбинированная терапия FGF21 и лептин-нейтрализующим антителом может быть рациональной стратегией для обращения вспять потери костной массы, вызванной FGF21.
Розиглитазон, мощный агонист PPARγ, повышает чувствительность к инсулину и служит эффективным средством лечения диабета 2 типа.Однако лечение розиглитазоном часто связано с увеличением веса, потенциальным снижением плотности костей и предполагаемыми побочными эффектами со стороны сердечно-сосудистой системы (которые на данном этапе подвергаются сомнению). Все вместе это ослабило энтузиазм по поводу широкого использования розиглитазона в лечении людей с диабетом 2 типа (61). Влияние агонистов PPARγ на лептин до сих пор не установлено. Промотор лептина содержит неканонический сайт связывания PPARγ / RXRα из 17 пар оснований, что позволяет предположить, что экспрессия гена лептина напрямую регулируется PPARγ (62).Возникает неопределенность относительно того, являются ли побочные эффекты розиглитазона лептин-зависимыми или лептин-независимыми. Потребуются прямые исследования, чтобы оценить, может ли терапия частичного снижения лептина облегчить некоторые побочные эффекты агонистов PPARγ.
Наконец, заместительная терапия инсулином является наиболее широко применяемой терапией при лечении диабета как 1-го, так и 2-го типа. Однако одним из наиболее документированных побочных эффектов инсулинотерапии является значительное увеличение веса (63). Как упоминалось выше, инсулин также является мощным физиологическим стимулятором секреции лептина.Остается неясным, является ли увеличение веса, индуцированное инсулином, лептин-зависимым или лептин-независимым. Наши исследования показывают, что частичное снижение лептина у мышей с ожирением оказывает положительное влияние на потерю веса. Важно отметить, что физиология лептина чрезвычайно хорошо сохраняется от мышей к человеку. Таким образом, комбинированные подходы к лечению инсулина и лептин-нейтрализующих антител могут дать очень положительный эффект для будущего лечения диабета и ожирения.
Выводы
В контексте физиологического состояния повышенной чувствительности к лептину (наблюдаемого у мышей с дефицитом лептина ob / ob , при липодистрофии и у небольшой группы лиц с ожирением) терапия лептином эффективно влияет на глюкозу и организм контроль веса и улучшение метаболического здоровья.В контексте резистентности к лептину (что широко наблюдается при ожирении, вызванном диетой, после генетического или фармакологически индуцированного снижения лептина, самого по себе или в сочетании с другими фармакологическими вмешательствами), может наблюдаться восстановление чувствительности к лептину в нейронах гипоталамуса, что приводит для уменьшения потребления пищи, значительного снижения массы тела и улучшения чувствительности к инсулину. Повышение чувствительности к инсулину может происходить в результате вмешательств, направленных на прямое снижение уровней лептина в крови.Улучшение метаболизма в этом контексте в значительной степени зависит от снижения уровня лептина в кровообращении. Это предлагает новую основу для объяснения механизма, лежащего в основе метаболических улучшений, наблюдаемых при многочисленных вмешательствах.
Опасности высокого уровня лептина и факторы, снижающие его уровень
Высокий уровень лептина связан с ожирением, перееданием и воспалением, и если уровень лептина остается высоким в течение длительного времени, может возникнуть резистентность к лептину. Узнайте здесь о причинах, симптомах и естественных факторах, снижающих уровень лептина.
Что такое лептин?Лептин — гормон сытости, который способствует снижению веса . Его производят жировые клетки [1].
Когда человек ест достаточно еды, лептин попадает в кровоток, откуда он попадает в мозг, сигнализируя о том, что он насыщен и может сжигать калории с нормальной скоростью [2, 3, 4].
Чтобы узнать больше о нормальном уровне лептина и о том, что этот гормон делает в организме, прочитайте первую часть этой серии.
Этот пост будет посвящен опасностям, связанным с высоким содержанием лептина. Повышенный уровень лептина связан с ожирением, перееданием и заболеваниями, связанными с воспалениями, включая высокое кровяное давление, метаболический синдром и болезни сердца [5].
Роль лептина в весеНапомним, лептин — один из четырех больших гормонов, определяющих вес. Он вырабатывается в жировой ткани, а его рецепторы расположены в двух важных областях мозга (гипоталамус и гиппокамп) [6].
Лептин действует как сигнал для мозга, запрещающий прием пищи и позволяющий накапливать излишки калорий (в жировых клетках).
В то же время он защищает нежировую ткань от жировой перегрузки. Повышенный уровень лептина связан с более высокой жировой массой, увеличением размера отдельных жировых клеток, перееданием и чрезмерным голодом. У грызунов он увеличивает расход энергии за счет использования бурого жира для получения энергии [7].
Чем больше жира, тем больше вырабатывается лептина. Эта петля обратной связи при нормальном функционировании поддерживает гомеостаз массы тела: употребление большего количества пищи увеличивает жировые отложения, что увеличивает секрецию лептина, что снижает аппетит и увеличивает расход энергии [8].
Высокий уровень лептина Основные условияСчитается, что высокий уровень лептина вызван, среди прочего:
- Перееданием [9, 10]
- Эмоциональным стрессом [11]
- Воспалением [9, 12]
- Ожирение [10]
- Беременность [13]
- Преэклампсия [13]
- Гестационный диабет [13]
- Апноэ во сне [14]
Если вы считаете, что ваша лептиновая система неуравновешена, поговорите Обратитесь к врачу о любых основных состояниях, которые могут потребовать внимания.
Негативное воздействие на здоровье 1) ВоспалениеЛептин является маркером воспаления, поскольку он реагирует на воспалительные цитокины из жировой ткани. Аутоиммунные заболевания связаны с повышенной секрецией лептина [15]. Как по структуре, так и по функциям лептин напоминает IL-6.
Лептин увеличивает высвобождение провоспалительных цитокинов TNF-альфа, IL-2, IL-6 и IL-12 [16].
Он также увеличивает уровень С-реактивного белка (СРБ) [17].
Лептин вызывает высвобождение провоспалительных цитокинов из многих типов клеток, включая микроглию в головном мозге [18], и является медиатором вызываемого цитокинами болезненного поведения (CFS) [19].
Многочисленные исследования продемонстрировали повышенный уровень лептина при хронических воспалительных заболеваниях [20].
Он также увеличивает количество красных и белых кровяных телец [15].
Повышенный уровень лептина связан с более высоким количеством лейкоцитов (WBC) как у мужчин, так и у женщин [21].
2) УсталостьСчитается, что лептин вызывает воспалительную усталость [22].Уровень лептина выше у женщин даже при контроле веса, и у женщин чаще диагностируется синдром хронической усталости (СХУ) [23].
Полагают, что отчасти это связано с тем, что тестостерон подавляет лептин у мужчин (клинические испытания) [24].
Повышение уровня лептина было связано с более высокими показателями утомляемости у людей с СХУ. Некоторые исследователи считают, что он играет причинную роль в СХУ; однако хроническая усталость — это противоречивое и малоизученное состояние, и этот вывод отнюдь не является единодушным [25].
Уровни лептина в крови также связаны с выраженностью утомляемости у пациентов с хроническим гепатитом С и синдромом раздраженного кишечника (СРК) [22].
У людей с диагнозом СХУ уровень лептина увеличивается в большей степени в ответ на кортизол [26].
3) Th2 иммунитетЛептин активирует путь JAK2– STAT3 [27], а способствует Th2 ответам [15].
Стимулируя STAT3, он также может стимулировать ответы Th27 [28]. Лептин также изменял дендритные клетки (ДК) человека, направляя их в сторону доминирования Th2 [29].
Было также обнаружено, что он необходим для Th2-зависимых воспалительных процессов, действуя как критический регулятор Т-лимфоцитов CD4 [30].
Эффект лептин-поляризующих Т-клеток в отношении ответа Th2, по-видимому, опосредован стимуляцией синтеза IL-2, IL-12 и IFN-гамма (всех цитокинов Th2) и ингибированием продукции IL-10 и IL- 4 [31, 32].
Доминирование Th2 коррелирует с избытком лептина в этом исследовании диализных пациентов [33]. Если у вас преобладает Th3, это не значит, что лептин не вызывает проблем.Это просто означает, что он вызывает различных проблем.
4) Тучные клеткиТучные клетки кожи, легких, кишечника и урогенитального тракта человека содержат лептин и рецепторы лептина [34], что позволяет предположить, что лептин взаимодействует с тучными клетками.
Похоже, лептин вызывает воспаление тучных клеток [35].
У пациентов с метаболическим синдромом наблюдалась положительная корреляция между уровнем лептина и количеством тучных клеток жировой ткани, что позволяет предположить, что лептин может стимулировать тучные клетки [36].
Лептин коррелирует с активацией тучных клеток (вероятно, увеличивает) у детей с астмой, которые тренируются [37].
Он частично подавляет аппетит за счет увеличения высвобождения гистамина и активации гистаминовых рецепторов h2 в гипоталамусе [38, 39].
5) Регуляторные Т-клеткиЛептин препятствует продукции Treg-клеток. Treg являются важной частью иммунной системы, которая создает толерантность к агентам, которые в противном случае вызывали бы иммунный ответ [15].
6) Ось HPAЛептин увеличивает стрессовую реакцию и активность симпатической нервной системы (борьба или бегство) [40].
Он активирует ось HPA и снижает вариабельность сердечного ритма (ВСР) [41].
7) РакЛептин способствует росту и распространению рака. Это одна из причин, почему ожирение считается фактором риска рака [42].
Увеличивает ангиогенез за счет увеличения уровня фактора роста эндотелия сосудов (VEGF).
8) Болезнь сердцаРецепторы лептина находятся в сердце [43]. Исследования связывают высокий уровень лептина с повышенным риском сердечно-сосудистых заболеваний [43].
У лиц с ожирением уровни лептина являются наиболее значимым предиктором более высоких уровней фибриногена, фактора свертывания крови, который считается одним из наиболее важных факторов риска сердечных заболеваний [44].
Тем не менее, высокие уровни лептина также связаны с высоким кровяным давлением [45], хотя это может быть связано с резистентностью к лептину, поскольку введение лептина крысам снижает кровяное давление [46].
Лептин увеличивает выработку эндотелина-1, который является сильнодействующим вазоконстриктором [45]. Сужая кровеносные сосуды, лептин / эндотелин-1 может играть роль в развитии сердечных заболеваний [45].
9) Чувствительность к болиБолее высокий уровень лептина в организме может вызвать усиление болевой чувствительности. Это потому, что он может вызывать воспаление, которое играет роль в боли [47].
В исследовании 3 пациентов с фибромиалгией они сообщили о более высоком уровне боли в те дни, когда у них было повышенное содержание лептина в крови.Когортное исследование 5600 женщин в постменопаузе показало аналогичные результаты [47].
Лептин может усиливать боль, активируя маркеры воспаления (IL-1B, IL-6, IL-18) или предотвращая передачу сигналов, модулирующих боль [47].
10) Всасывание питательных веществОн секретируется желудком и попадает в тонкий кишечник. Несколько исследований показали, что лептин препятствует усвоению некоторых питательных веществ.
Он усиливает поглощение бутирата [48], кишечный транспорт фруктозы [49] и олигопептидов [50].
Лептин снижает поглощение глюкозы [51] и галактозы [52]. Он также ингибировал абсорбцию пролина, бета-аланина и глутамина [53].
С одной стороны, я видел, что это и плохо, и хорошо. Если он блокирует всасывание глюкозы и аминокислот, он может помочь похудеть.
Однако блокирование поглощения глюкозы дает больше шансов для возникновения SIBO или недостаточного питания из-за того, что не усваиваются аминокислоты.
11) Резистентность к лептинуМногие исследователи утверждали, что хронически высокие уровни лептина могут приводить к резистентности к лептину, так же как хронически высокие уровни инсулина могут приводить к резистентности к инсулину.Симптомы резистентности к лептину включают [54]:
- Увеличение веса и трудности с похуданием
- Желание перекусить вскоре после еды
В этой публикации более подробно рассказывается о резистентности к лептину.
Факторы, влияющие на уровень лептинаУровень лептина увеличивается после еды, причем больше за счет углеводов, чем за счет жира как у тучных, так и у здоровых людей [55, 56].
При стрессе организм вырабатывает лептин, и повышенный уровень лептина связан с повышенным потреблением удобной пищи [57].
1) ДиетаПереедание во время еды способствует увеличению выработки лептина. Напротив, меньшие порции еды и более высокое содержание белка может снизить уровень лептина [12, 58].
Диета с низким содержанием углеводов и жиров может снизить выброс лептина [59].
Противовоспалительные продукты, такие как жирная рыба, оливковое масло, орехи, фрукты и овощи, также могут снижать выработку лептина [60].
Голодание
Кратковременное голодание снижает уровень лептина (24-72 часа) [61].
Прерывистое голодание считается наиболее безопасным и доступным видом голодания. Поговорите со своим врачом, прежде чем вносить существенные изменения в свой рацион [61].
2) СтрессЭмоциональный стресс, гормон стресса кортизол и противовоспалительные стероидные препараты увеличивают лептин. Снижение стресса может снизить уровень лептина [11, 62].
3) УпражнениеУпражнение снижает выработку лептина [63, 64].
4) Воздействие токсинов и воспалениеЕсли вы страдаете от воспалительных симптомов, особенно если они сохраняются более двух недель, поговорите со своим врачом о возможных основных причинах этого воспаления.
5) ЭстрогенЭстроген увеличивает лептин. Обычно это плохо, особенно у мужчин, и потому что избыток эстрогенов связан с резистентностью к лептину [70]
6) Апноэ во снеАпноэ во сне связано с повышенным содержанием лептина у тучных людей. В одном исследовании уровень лептина вернулся к норме после лечения CPAP [14].
7) Холодный душВоздействие низких температур может снизить уровень лептина [12, 71].
Другие факторыВсе перечисленные ниже факторы снизили лептин в различных исследованиях.Однако они не представляют подходящих стратегий для снижения лептина и улучшения здоровья.
Дополнительная литература
Лептин — обзор | ScienceDirect Topics
Физиологические эффекты лептина
Было показано, что лептин вызывает большое количество физиологических эффектов, особенно у мышей ob / ob, которые из-за отсутствия лептина очень чувствительны к эффектам лептина. Текущие данные показывают, что большинство, если не все, эффекты лептина опосредуются через небольшое количество нейронов в гипоталамусе.Такая возможность подозревалась, потому что повреждение гипоталамуса вызывает множество симптомов, таких как увеличение потребления пищи и веса тела, а также нейроэндокринные нарушения, подобные тем, которые наблюдаются у мышей ob / ob. Гипотеза была решительно подтверждена наблюдением, что форма рецептора, который опосредует передачу сигналов лептина, выражается в основном в нейронах гипоталамуса, и прямая инфузия лептина в гипоталамус достаточна для воспроизведения большей части или всех метаболических эффектов лептина.Хотя рецепторы лептина и эффекты лептина описаны в других тканях, действия лептина на нейроны в гипоталамусе явно определяют основную часть метаболических и нейроэндокринных эффектов лептина. Ключевыми мишенями лептина в гипоталамусе являются нейроны, которые продуцируют проопиомеланокортикотропин (POMC), нейропептид Y (NPY), меланин-концентрирующий гормон (MCH) и пептид, связанный с Агути (AgRP). Другие факторы сытости, включая глюкозу, также, по-видимому, действуют на эти нейроны, предполагая, что лептин является лишь одним из многих факторов, регулирующих продукцию этих нейронов, и, таким образом, в конечном итоге это состояние этих нейронов, а не только уровни лептина. которые определяют метаболический статус.
Хотя первичная последовательность лептина не указывает на его функцию, кристаллическая структура указывает на то, что лептин является цитокиноподобной молекулой. Это сходство подтверждается первичной последовательностью рецептора лептина, которая указывает на сходство с классом рецепторов цитокинов. На основании этих наблюдений многочисленные исследования продемонстрировали, что рецептор лептина действует через механизмы, общие для других рецепторов цитокинов, включая активацию киназы Janus / сигнального преобразователя и системы активатора транскрипции (STAT) (особенно STAT-3) и индукцию Ген SOCS-3 , который действует как противовоспалительный механизм отрицательной обратной связи, чтобы восстановить систему в исходное состояние.Есть надежда, что лучшее понимание механизмов, с помощью которых лептин регулирует функцию гипоталамуса, может привести к разработке лекарств, которые повышают чувствительность гипоталамуса к лептину, фармакологическое вмешательство, которое может быть полезно при лечении ожирения.
Мутации рецептора лептина в некоторых генетических условиях могут приводить к явному диабету 2 типа, частому осложнению ожирения. Мыши с дефицитом лептина на стандартном генетическом фоне C57 имеют непереносимость глюкозы, хотя и не являются явно диабетическими, что опять же является ожидаемым следствием выраженного ожирения, которое характерно для этих мышей.Ожидаемым последствием лечения лептином у мышей с дефицитом лептина (и людей) является улучшение толерантности к глюкозе, но это улучшение, по крайней мере, частично не зависит от снижения массы тела (как в случае бариатрической хирургии). Это улучшение, по-видимому, почти полностью опосредовано нейронами POMC гипоталамуса, скорее всего, через вегетативную нервную систему, действующую, по крайней мере частично, на глюконеогенез в печени. Хотя это было ожидаемым свойством лептина, недавно внимание привлекло еще более замечательное свойство лептина — он улучшает контроль глюкозы в моделях диабета 1 типа, в которых ожирение не играет роли.Это наблюдение подчеркивает роль нейронов гипоталамуса в регуляции гомеостаза глюкозы, в значительной степени независимого от секреции инсулина. Остается определить, будет ли лептин полезным адъювантом с инсулином для лечения диабета 1 типа у людей.
Редкое заболевание, называемое липодистрофией, влечет за собой очень низкий уровень ожирения и может быть вызвано рядом состояний, включая инфекцию вируса иммунодефицита человека (ВИЧ). Липодистрофия обычно сопровождается патологически низким уровнем лептина и, следовательно, может также вызывать нейроэндокринные нарушения, связанные с дефицитом лептина.В тематических исследованиях было замечено, что лечение лептином у людей с липодистрофией улучшает некоторые симптомы, в том числе способствует половой зрелости, но результаты рандомизированных клинических испытаний в целом разочаровывают. Тем не менее нейроэндокринные нарушения, связанные с липодистрофией, являются наиболее вероятным заболеванием, при котором будет одобрено лечение лептином.
Возможная связь с оксидативным стрессом и сердечно-сосудистыми осложнениями
Расстройства дыхания во сне, связанные с ожирением, такие как обструктивное апноэ во сне (СОАС) и синдром гиповентиляции ожирения (СГС), вызывают перемежающуюся гипоксию (ИГ) во время сна, являющуюся мощным триггером окислительного стресса.Ожирение также приводит к резкому увеличению циркулирующего уровня лептина, гормона, вырабатываемого жировой тканью. Лептин действует в гипоталамусе, подавляя прием пищи и увеличивая скорость метаболизма. Однако люди с ожирением устойчивы к метаболическим эффектам лептина. Лептин также активирует симпатическую нервную систему без каких-либо признаков сопротивления, возможно потому, что эти эффекты возникают периферически без необходимости проникновения через гематоэнцефалический барьер. IH — мощный стимулятор экспрессии и высвобождения лептина из жировой ткани.Гиперлептинемия и резистентность к лептину могут стимулировать генерацию активных форм кислорода, увеличивая окислительный стресс и способствуя воспалению. В текущем обзоре обобщены недавние данные о возможной связи между лептином и окислительным стрессом в патогенезе нарушений дыхания во время сна.
1. Введение
Обструктивное апноэ во сне (СОАС) характеризуется повторяющейся обструкцией верхних дыхательных путей, вызванной потерей тонуса глоточных мышц во время сна. СОАС тесно связан с ожирением, сердечно-сосудистыми и метаболическими осложнениями, повышая сердечно-сосудистую заболеваемость и смертность.Повторяющаяся обструкция верхних дыхательных путей во время сна приводит к колебаниям уровня кислорода в крови. Эти повторяющиеся циклы гипоксемии и реоксигенации называются перемежающейся гипоксией (ИГ), наиболее характерным признаком ОАС, который может способствовать увеличению продукции активных форм кислорода (АФК) и окислительному стрессу [1]. Активация симпатического нерва (SNA), еще один важный результат событий апноэ / гипопноэ, который способствует сопутствующим заболеваниям, связанным с OSA, вызывается IH и окислительным стрессом, а также повторяющимися пробуждениями от сна [2–4].В результате IH окислительно-восстановительный баланс у субъектов с OSA изменяется в сторону систем, продуцирующих оксидант, что приводит к окислительному стрессу. Многочисленные исследования наблюдали наличие окислительного стресса у пациентов с СОАС [5–7].
Лептин, также известный как гормон сытости, является главным посредником в потреблении пищи и энергетическом балансе организма. Лептин вырабатывается жировой тканью и играет множество регулирующих ролей в метаболизме, иммунитете и воспалении [8]. Кроме того, было показано, что лептин является мощным стимулятором вентиляции, действующим на центральные контролирующие органы дыхания.Лептин проявляет свои внутриклеточные эффекты через длинную изоформу рецептора лептина ObRb. ObRb обнаружен почти во всех тканях и на высоком уровне экспрессируется в головном мозге [9]. Уровни лептина в плазме тесно связаны с ИМТ и степенью ожирения. Следовательно, уровни циркулирующего лептина заметно повышены у лиц с ожирением. Однако центральные эффекты лептина на сытость устраняются при ожирении. Резистентность к лептину определяется как неспособность высоких уровней лептина в крови уменьшить чувство голода и способствовать расходу энергии [8].OSA и IH, мощные триггеры окислительного стресса, повышают уровень периферического лептина, а также вызывают резистентность к лептину [10]. Следует отметить, что резистентность к лептину может быть вовлечена в патогенез ОАС через нарушение регуляции проходимости верхних дыхательных путей и диафрагмального контроля [11].
Накапливающиеся свидетельства указывают на отрицательные эффекты резистентности к лептину. И оксидативный стресс, и гиперлептинемия играют роль в развитии сердечно-сосудистой и метаболической заболеваемости и смертности, связанных с ОАС и ИГ.Однако взаимодействие между лептином и окислительным стрессом при OSA ранее систематически не исследовалось. Целью данной статьи является обзор имеющихся в настоящее время данных об этих взаимосвязях и выяснение роли лептина и окислительного стресса в кардиометаболических осложнениях ОАС.
2. Бремя OSA
Обструктивное апноэ во сне (OSA) — серьезная проблема для здоровья, которая характеризуется периодическим коллапсом верхних дыхательных путей во время сна, приводящим к прерывистому ограничению потока вдоха и прекращению потока воздуха, что приводит к громкому храпу, IH , а также гиперкапния во время сна, частые возбуждения и дневная сонливость [12].Повторяющиеся обструкции верхних дыхательных путей с частичной или полной окклюзией верхних дыхательных путей во время сна называются гипопноэ и апноэ соответственно [13]. ОАС — основная причина заболеваемости и смертности в западном обществе [14–16], которая вносит значительный вклад в развитие и прогрессирование нейрокогнитивных, метаболических, сердечно-сосудистых и онкологических заболеваний [17–19]. Распространенность СОАС составляет 24–27% у мужчин среднего возраста, 40–45% у мужчин старшего возраста, 9% у женщин среднего возраста и 25–30% у женщин старшего возраста, но превышает 50% у лиц с ожирением [16 , 20].Однако распространенность ОАС среди населения может быть недооценена, поскольку для постановки диагноза требуется исследование сна, в то время как многие бессимптомные пациенты и пациенты с минимальными симптомами не обращаются за медицинской помощью.
3. Лептин
Впервые идентифицированный Коулманом в 1973 году как циркулирующий фактор, участвующий в регуляции массы тела, лептин был в конечном итоге открыт в 1994 году группой под руководством Чжана [21]. Лептин является ключевым регулятором метаболизма и массы тела, который вырабатывается преимущественно адипоцитами и в физиологических условиях попадает в кровоток пропорционально ожирению [22, 23].У лиц с ожирением обычно наблюдается высокий уровень циркулирующего лептина, который считается провоспалительным адипокином, способствующим хроническому воспалению слабой степени при ожирении.
В дополнение к регуляции метаболизма лептин может вызывать множество эффектов, передавая сигналы центрально или периферически в ткани-мишени. На периферии лептин участвует в регуляции различных процессов, включая модуляцию воспалительных и иммунных функций [24], регуляцию сердечно-сосудистой системы [25], метаболизм глюкозы и секрецию инсулина [26], репродуктивную функцию [27], формирование костей [28]. ] и метаболизм жирных кислот [29].Действие лептина может быть опосредовано как его эндокринными эффектами (т. Е. Циркулирующим лептином, высвобождаемым из адипоцитов), так и паракринными эффектами (продуцируемыми in situ), поскольку экспрессия лептина была продемонстрирована в кости, молочной железе [30], желудке [31], плаценте. [32], легкие [33] и клетки клубочков сонной артерии [34]. Кроме того, лептин может также преодолевать гематоэнцефалический барьер через насыщаемую однонаправленную транспортную систему [35], обеспечивая мозг афферентным сигналом, пропорциональным уровню жира в организме.Лептин проявляет свои эффекты через связывание с рецептором лептина, который имеет несколько изоформ, включая изоформы с короткими и длинными цитоплазматическими доменами, а также растворимую изоформу. Изоформа ObRb с самым длинным внутриклеточным доменом обнаружена почти во всех тканях и является единственной изоформой, которая может активировать внутриклеточный сигнальный каскад лептина [9]. ObRb экспрессируется на высоком уровне в областях мозга, которые участвуют в регуляции питания и расхода энергии. Например, ObRb экспрессируется в гипоталамусе; в ядрах, которые важны для регуляции метаболизма, таких как дугообразное ядро (ARC), вентромедиальное ядро гипоталамуса (VMH) и дорсомедиальное ядро гипоталамуса; и в латеральной области гипоталамуса [36].Кроме того, иммунореактивность ObRb была продемонстрирована в солитарных ядрах (NTS), подъязычном ядре (12N) и дорсальном ядре блуждающего нерва (DNV) [37]. Эти данные указывают на то, что лептин может оказывать прямое влияние на подъязычные двигательные нейроны, поддерживающие дыхание за счет проходимости челюстно-язычных мышц.
Несмотря на такие необычно высокие уровни циркулирующего лептина, похоже, что люди с ожирением не реагируют на его центральные метаболические и респираторные эффекты. В то время как у худых людей лептин имеет тенденцию циркулировать на низких уровнях примерно 5-10 нг / мл [38], было показано, что уровни циркулирующего лептина могут увеличиваться до очень высоких уровней 98 нг / мл после того, как жировая масса тела достигает 30% [39]. ].Лептин оказывает свое действие на сытость в ЦНС, индуцируя различные нервные пути в гипоталамусе [40]. Однако у пациентов с ожирением центральный эффект лептина на сытость отменяется [8]. Это явление называется резистентностью к лептину и определяется как неспособность высоких уровней лептина в циркуляции уменьшить чувство голода и способствовать расходу энергии. Было предложено по крайней мере три возможных механизма для опосредования резистентности к лептину, включая неспособность циркулирующего лептина достичь своих целей в головном мозге в результате ограниченной проницаемости гематоэнцефалического барьера; подавление ObRb на поверхности клетки; и / или ингибирование сигнального пути лептин-ObRb [41].Кроме того, данные исследований на животных показывают, что вызванная диетой воспалительная реакция в гипоталамусе может привести к центральной резистентности к лептину и ожирению [42]. Резистентность к лептину может быть избирательной для центральной нервной системы, а периферическое действие лептина может ускользать от резистентности к лептину и оказывать свое влияние на SNA и артериальное давление [43–45]. Хотя рассматриваются новые гормональные препараты, такие как амилин, и бариатрическая хирургия, общепринятого лечения резистентности к лептину не существует [46–49].
4. Лептин-контроль вентиляции и влияние лептина на верхние дыхательные пути
Накапливающиеся в последние годы данные показывают, что лептин может участвовать в патогенезе ОАС посредством центральной регуляции проходимости верхних дыхательных путей и диафрагмального контроля. Экспериментальные данные на животных моделях показывают, что генетические формы дефицита лептина и резистентности к лептину у мышей связаны с более высокой частотой дыхания с ограниченным потоком и сжимаемости глотки [50, 51].Экспрессия рецептора лептина ObRb в подъязычном ядре, иннервирующем GG-мышцы, также указывает на возможную прямую роль лептина в OSA [37].
Лептин также участвует в патогенезе гиповентиляции, связанной с ожирением. У мышей с ожирением с дефицитом лептина ( ob / ob ) наблюдались гиповентиляция и гиперкапния, которые были нормализованы заместительной терапией лептином. Это снижение гиперкапнической респираторной чувствительности у мышей ob / ob было связано с более низкими дыхательными объемами по сравнению с мышами дикого типа того же веса [52].Положительные эффекты замещения лептина на минутную вентиляцию и дыхательные объемы при дыхании с ограниченным потоком у мышей ob / ob также ранее были продемонстрированы в нескольких исследованиях, что указывает на то, что лечение лептином может иметь потенциал для лечения как ОАС, так и гиповентиляции ожирения [50, 53 ]. Кроме того, активность челюстно-язычных мышц увеличивалась после лечения лептином, что позволяет предположить, что лептин модулирует нервно-мышечный ответ на сопротивление верхних дыхательных путей [53]. Более того, интрацереброваскулярное введение лептина обращало обструкцию верхних дыхательных путей во время сна у лептин-дефицитных мышей ob / ob , и этот эффект был локализован в дорсомедиальном гипоталамусе [51].У людей более высокие уровни лептина были связаны с увеличением минутной вентиляции и снижением гибкости глотки в модели экспериментальной обструкции верхних дыхательных путей у женщин [54]. Однако в другом исследовании очень высокие уровни лептина в плазме были связаны с гиповентиляцией ожирения [55]. Таким образом, как относительный дефицит лептина, так и резистентность к лептину могут быть связаны с нарушением дыхания во сне у людей.
5. ОАС и гиперлептинемия
Повышенные уровни лептина в плазме или гиперлептинемия связаны с различными состояниями здоровья, включая гипертензию, легочное воспаление, а также системное воспаление низкой степени и метаболическую дисфункцию у людей с ожирением.Гиперлептинемия является компонентом метаболического синдрома, и недавно было показано, что повышенный уровень лептина является фактором риска сердечно-сосудистых заболеваний у метаболически здоровых субъектов с ожирением [56].
На экспрессию и секрецию гена лептина влияют многие факторы. Хотя основным фактором, определяющим уровень лептина в кровотоке, является количество белой жировой ткани (WAT), другие факторы, такие как системная и тканевая гипоксия, могут влиять на экспрессию и секрецию лептина [10, 57]. Действительно, все больше данных свидетельствует о том, что циркулирующий лептин увеличивается в ответ на IH.Фактически, клинические данные исследований на людях показали, что субъекты с СОАС имеют повышенные уровни лептина в кровотоке по сравнению с контрольной группой [10]. Более того, повышенный уровень лептина был положительно связан с тяжестью апноэ во сне, измеренной с помощью AHI, и сатурации кислорода ниже 90% времени [58]. Важно отметить, что более высокие уровни лептина при ОАС не зависели от ИМТ или окружности талии [58]. Тем не менее, в нескольких исследованиях сообщалось, что маркеры ожирения, такие как жировая складка кожи, масса тела и ИМТ, являются более точными предикторами гиперлептинемии при ОАС, чем при ИАГ [59].В совокупности эти данные указывают на то, что уровни лептина повышены у пациентов с СОАС.
Взаимосвязь между гиперлептинемией и СОАС была дополнительно изучена с помощью интервенционных исследований, в которых измеряли уровни лептина после лечения СОАС с постоянным положительным давлением в дыхательных путях (CPAP). Исследователи сообщили, что уровни лептина начинают снижаться уже через несколько дней CPAP и остаются сниженными после длительной терапии CPAP. Также было показано, что снижение уровня циркулирующего лептина, вызванное СРАР-терапией, не зависит от ИМТ [60, 61].Кроме того, было обнаружено, что снижение AHI является независимым предиктором снижения уровня лептина после 6 месяцев лечения CPAP. Примечательно, что снижение уровней циркулирующего лептина не ограничивалось только терапией CPAP. Сообщалось, что эффективное хирургическое вмешательство с увулопалатофарингопластикой также снижает уровень лептина у пациентов с тяжелым СОАС [62]. Однако в нескольких исследованиях сообщалось, что терапия CPAP не влияет на уровни циркулирующего лептина при СОАС. Например, недавнее исследование показало, что уровни лептина и липидный профиль у субъектов с избыточной массой тела с ОАС и без него не различались, и что лечение CPAP существенно не изменило ИМТ, окружность талии и шеи или уровни лептина у пациентов с ОАС [63] .Исследования роли лептина у детей с СОАС также демонстрируют противоречивые результаты [64–67]. Следует отметить, что недавнее исследование, проведенное с участием 164 детей с избыточным весом и ожирением, не показало значительных различий в уровнях лептина между субъектами с или без СОАС. Корреляция между лептином и индексом десатурации кислородом исчезла после коррекции ожирения [68]. Подобные результаты были также продемонстрированы в другом исследовании, предполагающем, что на уровни лептина в сыворотке влияет ожирение, но не тяжесть СОАС у детей с привычным храпом [69].Эти данные показывают, что эффективная терапия OSA может снизить уровень лептина у взрослых пациентов.
Данные исследований на животных предполагают, что IH может быть возможным механизмом, опосредующим гиперлептинемию при OSA. Например, у худых мышей, подвергшихся 5-дневному воздействию ИГ, наблюдалось повышение уровня лептина в сыворотке по сравнению с мышами, находящимися в нормоксии [70], что указывает на то, что ИГ может играть роль в повышении регуляции и секреции лептина. Фактически, также сообщалось, что гипоксия усиливает активность промотора гена лептина, экспрессию мРНК и секрецию лептина из культивируемых адипоцитов [71].Учитывая, что лептин активируется гипоксией и что гиперлептинемия может приводить к сердечно-сосудистым осложнениям, вполне вероятно, что высокие уровни лептина способствуют сердечно-сосудистым осложнениям ОАС. У худых мышей все типы гипоксии индуцировали резистентность к инсулину и повышали уровни циркулирующего лептина, но только частый ИГ (60 раз / час) увеличивал перекисное окисление липидов и продукцию TNF- α жировой тканью [72]. Однако двухнедельное воздействие ИГ не увеличивало уровень лептина в сыворотке как у худых, так и у тучных крыс Zucker [73], тогда как уровень лептина повышался к 2–5 неделям ИГ у крыс с ожирением, не страдающим ожирением или вызванным диетой [74, 75].Такое расхождение в результатах указывает на то, что гиперлептинемия при ОАС может модулироваться тяжестью и продолжительностью ГГ и ее взаимодействием с фенотипом ожирения.
Механизмы вредных метаболических эффектов лептина и резистентности к лептину во время ИГ изучались в нескольких исследованиях. У крыс дикого типа и резистентных к лептину крыс IH индуцировал вредное воздействие на метаболизм и повышение уровня лептина в плазме за счет фосфорилирования сигнального преобразователя и активатора транскрипции 3 (STAT3) и экспрессии проопиомеланокортина (POMC) в дугообразном ядре гипоталамуса [76] .Активация симпатической нервной системы и ренин-ангиотензиновой оси при ИГ также может стимулировать выработку и секрецию лептина [77]. Напротив, лептин является мощным стимулятором симпатической нервной системы (СНС), а гиперлептинемия может способствовать развитию гипертонии у людей с ожирением [43, 44] и грызунов [45, 78]. Несколько исследований показали, что уровень лептина в плазме повышен у пациентов с гипертонией, и это положительно коррелировало с развитием гипертонии у людей [79]. Также было продемонстрировано, что инфузии лептина увеличивают симпатическую активность у человека [80].Кроме того, исследования на животных показали, что у худых и страдающих ожирением мышей со сверхэкспрессией лептина наблюдалось повышение артериального давления, что позволяет предположить, что лептин играет роль в патогенезе гипертензии, связанной с ожирением [81]. В целом, текущие данные показывают, что уровни циркулирующего лептина увеличиваются при ИГ, и предполагают, что гиперлептинемия может быть связана с побочными эффектами СОАС, такими как повышенный окислительный стресс и гипертензия.
6. Лептин и окислительный стресс
В последние годы все больше данных указывает на то, что опосредованное лептином увеличение продукции ROS и окислительный стресс могут быть одним из потенциальных механизмов, связывающих OSA с повышенным риском сердечно-сосудистой заболеваемости и смертности [82, 83] .Окислительный стресс вовлечен в патогенез старения и множества заболеваний, включая старение; сердечно-сосудистые, легочные, желудочно-кишечные и метаболические заболевания, включая ожирение; и рак [84–86]. Окислительный стресс, впервые предложенный Сисом в 1985 году, представляет собой нарушение баланса между активными формами кислорода (АФК) и антиоксидантами в окислительно-восстановительной системе клетки [87]. ROS — это общий термин для химически активных химических веществ, содержащих кислород.
Накопление доказательств из многочисленных исследований связывает лептин с окислительным стрессом.Было показано, что лептин может индуцировать образование АФК как в фагоцитарных [88, 89], так и в нефагоцитарных клетках [90–93]. Также сообщалось, что высокие уровни лептина могут вызывать генерацию АФК в основном за счет активации НАДФН-оксидазы [82, 94, 95]. Однако было также показано, что заместительная терапия лептином значительно снижает экспрессию НАДФН-оксидазы в жировой ткани лептин-дефицитных мышей ob / ob [96], что указывает на защитную роль лептина на гомеостатических уровнях. Более того, производство лептина увеличивалось за счет сверхэкспрессии эндогенного антиоксидантного фермента, каталазы, которая катаболизирует перекись водорода, образующуюся в результате дисмутации супероксида, и это коррелировало с улучшением расхода энергии и снижением маркеров воспалительного и окислительного стресса у мышей ob / ob [97] .Взаимосвязь между лептином и окислительным стрессом была недавно исследована на модели окислительного стресса на мышах, продемонстрировав, что усиление передачи сигналов Nrf2 подавляет окислительный стресс и улучшает устойчивость к лептину в гипоталамусе [98]. Кроме того, недавно была продемонстрирована роль лептина в создании адекватной окислительно-восстановительной системы при введении антагониста лептина во время неонатального выброса лептина, что привело к снижению активности некоторых антиоксидантных ферментов в селезенке и провоспалительному профилю цитокинов в лейкоцитах [99].В целом, эти данные показывают, что лептин играет важную роль в развитии и регуляции окислительно-восстановительной системы и что повышенный уровень лептина, то есть гиперлептинемия, может вызывать окислительный стресс и способствовать воспалению.
7. Взаимодействие между лептином и окислительным стрессом при OSA
Ожирение связано с окислительным стрессом и повышенным перекисным окислением липидов, карбонилированием белков и окислительными изменениями нуклеиновых кислот [100]. Дисбаланс между АФК и антиоксидантными системами при ожирении был обнаружен как в митохондриях, так и в цитоплазме.Многочисленные исследования показывают, что OSA и IH взаимодействуют с вызывающим ожирение окислительным стрессом и окислительным повреждением в различных тканях [101, 102]. Окислительное повреждение было связано с множественными осложнениями ожирения и СОАС, включая множественные когнитивные, сердечно-сосудистые, эндокринные и онкогенные осложнения [103, 104]. Параллельно резистентность к лептину является одним из важных патогенных факторов ожирения и СОАС [105]. Как обсуждалось выше, гиперлептинемия и резистентность к лептину (1) вызывают окислительный стресс в различных органах и тканях и (2) приводят к неблагоприятным исходам, которые очень похожи на патогенные последствия окислительного стресса.Тем не менее, прямая причинная связь между резистентностью к лептину и окислительным повреждением тканей при OSA еще предстоит продемонстрировать. Дальнейшие исследования в этом направлении не только улучшат наше понимание патогенеза ОАС, но также могут привести к новым методам лечения.
8. Резюме
Таким образом, IH-индуцированная гиперлептинемия у пациентов с СОАС может играть важную роль в патогенезе апноэ во сне. Лептин является стимулятором дыхания, но более высокие уровни лептина в кровотоке у пациентов с ожирением, страдающих ОАС, не могут модулировать дыхательный драйв из-за устойчивости к центральным эффектам лептина.Устойчивость к лептину сама по себе может способствовать развитию нарушений дыхательного сна. Напротив, провоспалительное действие лептина и возникающее в результате окислительное повреждение ткани на периферии ускользает от центральной резистентности к лептину и оказывает пагубное влияние на SNA, гипертензию и сердечно-сосудистые неврологические и метаболические осложнения при OSA. Все вышесказанное позволяет предположить, что резистентность к лептину является мишенью для лечения нарушений дыхания во время сна, включая СОАС и синдром гиповентиляции ожирения (СГС).Эти результаты показаны на Рисунке 1.
Конфликты интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.

